鸡腿蘑胞外多糖的形貌结构及分子量动态变化与抗氧化的相关性研究
2021-04-26王珊珊孙敏王永霞李惟栋韩春超
王珊珊 孙敏 王永霞 李惟栋 韩春超
(山东中医药大学药学院,济南 250355)
鸡腿蘑(Coprinus comatus),学名毛头鬼伞,是一种新型栽培的药用和食用蘑菇[1]。由于其丰富的营养价值和良好的口感,被誉为具“天然、营养、保健”3 种机能为一体的16 种珍稀食用菌之一[2]。多糖是鸡腿蘑中天然存在的物质,是其生理功能的重要组成部分。据报道,鸡腿蘑子实体中的多糖含量为57.65%,其中还原糖含量为53.64%[3]。研究报道鸡腿蘑多糖具有多种生物活性功能,如降血糖[4-5]、抗氧化[6-7]、抗肿瘤[8]及免疫调节作用[8-9]等。目前,对于鸡腿蘑多糖的研究主要集中在鸡腿蘑多糖的药用价值、鸡腿蘑多糖发酵培养条件及提取工艺优化的方面,涉及鸡腿蘑多糖结构方面的研究很少,且还没有鸡腿蘑多糖结构与功能相关性的文献报道。
液态深层发酵是目前开发鸡腿蘑活性成分的有效手段[2]。研究发现发酵是一个动态变化的过程,发酵过程(如时间)可使发酵产物的含量、结构和活性更多样化[10-12]。然而,目前对于发酵多糖的研究集中在多糖含量的动态积累变化[12-14],较少涉及到多糖的结构及活性的改变。多糖的生物活性取决于它的化学结构和其他理化性质,包括单糖组成、链构象、支链情况、空间构型、相对分子质量及溶解度等[15-16]。因此,本研究拟对不同发酵时间的鸡腿蘑胞外粗多糖的单糖组成、形貌结构及分子量分布进行测定,并进一步探讨与抗氧化活性的相关性,旨在为鸡腿蘑液体发酵生产提供理论参考,也为鸡腿蘑多糖在新药研发和功能性食品开发等方面开创新的应用领域。
1 材料与方法
1.1 材料
1.1.1 菌株 鸡腿蘑菌株(R2000)由山东省农业科学院提供。
1.1.2 试 剂 1,1- 二 苯 基-2- 三 硝 基 苯 肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、D-半乳糖:上海麦克林生物化学技术有限公司;总抗氧化剂能力试剂盒:南京建城生物工程研究所;磷酸二氢钾(KH2PO4)、硫酸镁(MgSO4)、L-鼠李糖、D-葡萄糖:国药集团化学试剂有限公司;D-甘露糖、D-阿拉伯糖:上海源叶生物科技有限公司。
1.1.3 仪器设备 UV-6100 双光束分光光度计:上海美谱达仪器有限公司;Essentia LC-16 型高效液相色谱仪:日本shimadzu 公司;ThermoApreo 扫描电子显微镜:美国ThermoFisher 公司;MultiMode 原子力显微镜:美国Bruker 公司;ELEOS System 凝胶色谱仪:美国Wyatt 公司。
1.2 方法
1.2.1 鸡腿蘑胞外粗多糖的样品制备 用接种棒从获得的鸡腿蘑菌株中勾取3-4 块(1 cm2)菌丝体接种至PDA 斜面培养基(20%马铃薯提取物,2%葡萄糖,2%琼脂)上,并在26℃下孵育7 d,使其恢复活性。勾取10 块(1 cm2)活化好的菌丝体转移到装有50 mL 液体种子培养基(20%马铃薯提取物,2%麸皮提取物,2%葡萄糖,0.1% KH2PO4,0.1%MgSO4·7H2O)的100 mL 锥形瓶中,于26℃、170 r/min下孵育3 d。最后,将30 mL 液体种子(10%的接种量)转移到装有300 mL 发酵培养基(20%马铃薯提取物,5%麸皮提取物,2%葡萄糖,0.1% KH2PO4,0.1%MgSO4·7H2O)的500 mL 锥形瓶中,于26℃、160 r/min 下分别孵育不同的时间。杜宇等[17]以胞外多糖产量为指标确定鸡腿蘑胞外多糖的最优发酵时间为96 h。因此,本课题拟对发酵时间为24 h、48 h、72 h、96 h、120 h 和144 h 的鸡腿蘑胞外多糖进行研究。但实际上考虑到在发酵前48 h 内培养基中的多糖影响较大;其次发酵144 h 的发酵液颜色已经发黑。因此在本研究中只体现了发酵72 h、96 h 和120 h 的胞外多糖的性质。
达到发酵时间后,通过抽滤分离菌丝体和发酵液,发酵液用于进一步提取胞外粗多糖。发酵液经浓缩,80%乙醇醇沉,4℃下静置过夜。醇沉物在4 000 r/min 下离心10 min,沉淀用丙酮和无水乙醇洗涤并溶解于水中。随后,采用Sevage 法脱除蛋白,并再次用80%乙醇沉淀12 h。醇沉物在4 000 r/min下离心10 min,沉淀用丙酮和石油醚洗涤并溶解于水中。最后,将水溶性部分挥发除去有机试剂后,冷冻干燥即得发酵时间为72 h、96 h 和120 h 的鸡腿蘑胞外粗多糖[18]。
1.2.2 鸡腿蘑胞外多糖的单糖分析 通过PMP(1-苯基-3-甲基-5-吡唑啉酮)柱前衍生化-高效液相色谱(High performance liquid chromatography,HPLC)法分析鸡腿蘑胞外多糖的单糖组成[19]。
1.2.2.1 HPLC 色谱条件 色谱柱:ZORBAX Eclipse XDB-C18 HPLC column(4.6 × 250 mm,5-Micron,Agilent,USA);柱温:25℃;检测波长:250 nm;流速:0.8 mL/min;进样体积:20 μL;流动相:0.5%磷酸盐(KH2PO4-NaOH,pH 6.8),缓冲液∶乙腈,体积比83∶17(0-22.5 min)和83.5∶16.5(22.5-35 min,%,V/ V),梯度洗脱。
1.2.2.2 标准品的制备 取500 μL 混合标准液(D-甘露糖、L-鼠李糖、D-葡萄糖、D-半乳糖和D-阿拉伯糖标准品的水溶液浓度均为300 mg/mL)与500 μL 的0.6 mol/L 的氢氧化钠溶液混匀后,精密吸取250 μL 的混合液与250 μL 的0.5 mol/L 的PMP 甲醇溶液均匀混合,于70℃烘箱中反应120 min,取出,冷却至室温。加入250 μL 的0.3 mol/L 的盐酸中和过量的氢氧化钠至pH 7,加水稀释至5 mL,再加入等体积的氯仿溶液,充分涡旋,4 000 r/min 离心10 min,弃氯仿层,萃取 3 次,加水定容至10 mL,过0.45 μm 微孔滤膜,进行HPLC 分析。
1.2.2.3 供试品的制备 准确称取不同发酵时间的鸡腿蘑粗胞外多糖300 mg 置于安瓿瓶中,加入4 mol/L 的三氟乙酸溶液5 mL,混匀、封口,放入烘箱中于120℃条件下水解4 h,冷却至室温,向其加5 mL 甲醇,氮气吹干,重复3-4 次以除去多余的三氟乙酸,然后用0.3 mol/L 的氢氧化钠溶液溶解,定容至10 mL 容量瓶中,得鸡腿蘑胞外多糖水解液。水解液按照1.2.2.2 的方法进行衍生化操作。
1.2.3 鸡腿蘑胞外多糖的形貌结构 通过扫描电子显微镜和原子力显微镜来观察胞外多糖的形貌结构。
1.2.3.1 扫描电子显微镜(Scanning electron microscope,SEM)分析 SEM 用于检测鸡腿蘑胞外多糖的表面形态。用导电黏合剂将样品撒在样品台上,用橡胶吸球吹扫黏附在表面上的样品。样品喷金后,在扫描电子显微镜下观察。
1.2.3.2 原子力显微镜(Atomic force microscope,AFM)分析 通过AFM 可观察鸡腿蘑胞外多糖的超微结构。取适量样品溶液滴到云母表面上,吸附一定时间,然后用超纯水洗涤。用滤纸吸去云母表面多余的液体,并用氮气轻轻吹扫云母表面以获得干燥的样品。将干燥的样品放置在样品台上,在原子力显微镜下观察。实验中采用轻敲模式,所使用的探针是TESP 硅探针,其弹性系数为42 N/m,针尖半径约为10 nm。为了获得高质量的图像,实验过程中扫描速率均小于1 Hz,分辨率为512×512,扫描角度为0°。
1.2.4 鸡腿蘑胞外多糖的分子量分布 采用高效凝胶过滤色谱法(High performance gel filtration chromatography,HPGFC)分析鸡腿蘑胞外多糖的相对分子质量及分子量分布情况。HPGFC 的色谱条件如下。色谱柱:Shodex OHpak 系列 SB-806 串803,流动相:0.05 mol/L 硫酸钠 + 0.02% NaN3,流速:1 mL/min,示差折光检测器,柱温:40℃。将样品溶解在液相中,用微孔滤膜过滤,进样量为500 μL。
1.2.5 鸡腿蘑胞外多糖的体外抗氧化能力测定 测定鸡腿蘑胞外多糖的总抗氧化能力和对DPPH 自由基的清除能力。
1.2.5.1 总抗氧化能力测定 根据试剂盒说明书来测定胞外多糖样品的总抗氧化能力。在样品管中加入2.0-10.0 mg/mL 的样品溶液(0.2 mL),随后依次加入试剂1(1.0 mL),试剂2(2.0 mL)和试剂3(0.5 mL),37℃水浴30 min。最后加入试剂4(0.2 mL)和试剂5(0.2 mL)后充分混合,室温下放置10 min,在520 nm 处测量吸光度。对照管除在加入试剂5 之前添加样品溶液外,其余操作与样品管相同。多糖样品的总抗氧化能力通过下面公式计算:

式中:A1为样品管的吸光度;A2为对照管的吸光度。
1.2.5.2 DPPH 自由基清除能力测定 根据文献[20]报道的方法对鸡腿蘑胞外多糖的DPPH 自由基清除能力进行测定。精密称取5.0 mg 的DPPH 用无水乙醇定容至100 mL,于4℃下避光保存。在样品管中加入1.0 mL 的蒸馏水,随后依次加入1.0 mL 不同浓度(2.0-10.0 mg/mL)的多糖样品溶液和2.0 mL 新鲜配制的DPPH 溶液。同时,在对照管中依次加入1.0 mL 的蒸馏水、1.0 mL 不同浓度的多糖样品溶液和2.0 mL 的无水乙醇溶液,空白管中加入2.0 mL 的蒸馏水和2.0 mL 的DPPH 溶液。混合均匀后,在室温下避光反应30 min,517 nm 处测量吸光度。根据下式计算DPPH 自由基清除率:
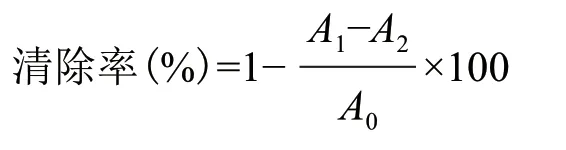
式中:A0为空白管的吸光度;A1为样品管的吸光度;A2为对照管的吸光度。
1.2.6 数据处理 所有数据均以3 次实验结果的均值±标准差表示。
2 结果
2.1 鸡腿蘑胞外多糖的单糖组成分析
2.1.1 混合单糖与鸡腿蘑胞外多糖的HPLC 色谱图 根据1.2.2 项下操作,将混合单糖和样品多糖进行 HPLC 分析,色谱图见图1。由图可知,发酵72 h、96 h 和120 h 鸡腿蘑胞外多糖的单糖组成是一致的,均由D-甘露糖、L-鼠李糖、D-葡萄糖、D-半乳糖和D-阿拉伯糖组成。
2.1.2 鸡腿蘑胞外多糖的相对摩尔比 根据1.2.2.2项下操作,同时对不同浓度的各单糖的标准溶液进行HPLC 分析。根据各单糖的质量浓度对应的峰面积进行线性回归分析,进而获得各单糖的回归方程。结果表明,5 种单糖标准品在相应浓度范围内线性关系均较好,结果如表1。根据回归方程及样品多糖的峰面积进一步计算得出不同发酵时间的鸡腿蘑胞外多糖各单糖的相对摩尔比,结果见表2。由表可知,鸡腿蘑胞外多糖是以半乳糖为主的杂多糖,且发酵72 h/96 h 和120 h 鸡腿蘑胞外多糖的单糖组成没有差异,但各单糖的相对摩尔比不同。
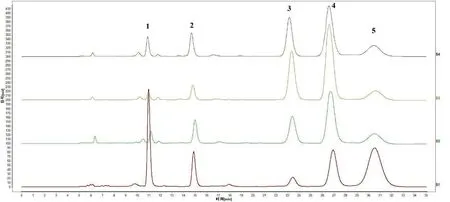
图1 混合单糖与鸡腿蘑胞外多糖的HPLC 色谱图

表1 五种单糖的线性范围和回归方程
2.2 鸡腿蘑胞外多糖的形貌结构分析
2.2.1 SEM 结果分析 SEM 1000×下的鸡腿蘑胞外多糖的形态如图2 所示。由图可知,鸡腿蘑胞外多糖呈板状,且表面粗糙,有大量孔洞。发酵过程中胞外多糖的形态有很明显的变化。发酵120 h 的多糖片段较发酵72 h 和96 h 的多糖均匀,且其板状结构也更规则。
2.2.2 AFM 结果分析 图3 显示了在AFM 下观察到的鸡腿蘑胞外多糖的分子形态。平面图像中有许多球形和不均匀的团块,发酵120 h 的多糖团块较发酵72 h 和96 h 的多糖大。从三维图像中可以看出发酵过程中多糖的分子形态有很明显的变化,发酵120 h 时多糖分子的聚集程度最高。SEM 和AFM 在结果上是一致的。
2.3 鸡腿蘑胞外多糖的分子量分布分析
HPGFC 结果表明鸡腿蘑胞外多糖在发酵72 h、96 h 和120 h 时的分子量(Mw)分别为1.7 kD、6 kD 和58 kD。可见发酵过程中鸡腿蘑胞外多糖的分子量在变大。图4 显示了发酵72 h、96 h 和120 h的胞外多糖的分子量分布情况。由图可知,发酵时间越长,胞外多糖的分子量分布范围越广。发酵72 h 多糖的分子量分布范围为0.46-65 kD,且主要集中在1.7-2.8 kD 之间。发酵96 h 多糖的分子量分布范围处于0.76-259 kD 间,其分子量分布范围更广,且在0.76-3.8 kD 之间比较集中。而发酵120 h 多糖的分子量分布范围为5.8-522 kD,多集中在46-96 kD 范围内,且有少数的多糖分子量大于96 kD。
2.4 鸡腿蘑胞外多糖的体外抗氧化能力分析
2.4.1 总抗氧化能力分析 总抗氧化剂能力是评估样品抗氧化能力的综合指标。如图5-A 所示,鸡腿蘑胞外多糖呈现出浓度依赖性,在2.0-10.0 mg/mL范围内各种样品的总抗氧化能力随浓度的增加而增大。显然,发酵时间为120 h 的多糖的总抗氧化活性最强,总抗氧化能力的强弱顺序为:120 h >96 h >72 h。浓度为10 mg/mL 时,发酵72 h 的多糖总抗氧化能力为2.42 ± 0.18 U/mL,96 h 时为2.96 ±0.19 U/mL,120 h 时为4.63 ± 0.10 U/mL。

表2 鸡腿蘑胞外多糖的单糖组成及摩尔比

图2 鸡腿蘑胞外多糖的SEM 图像
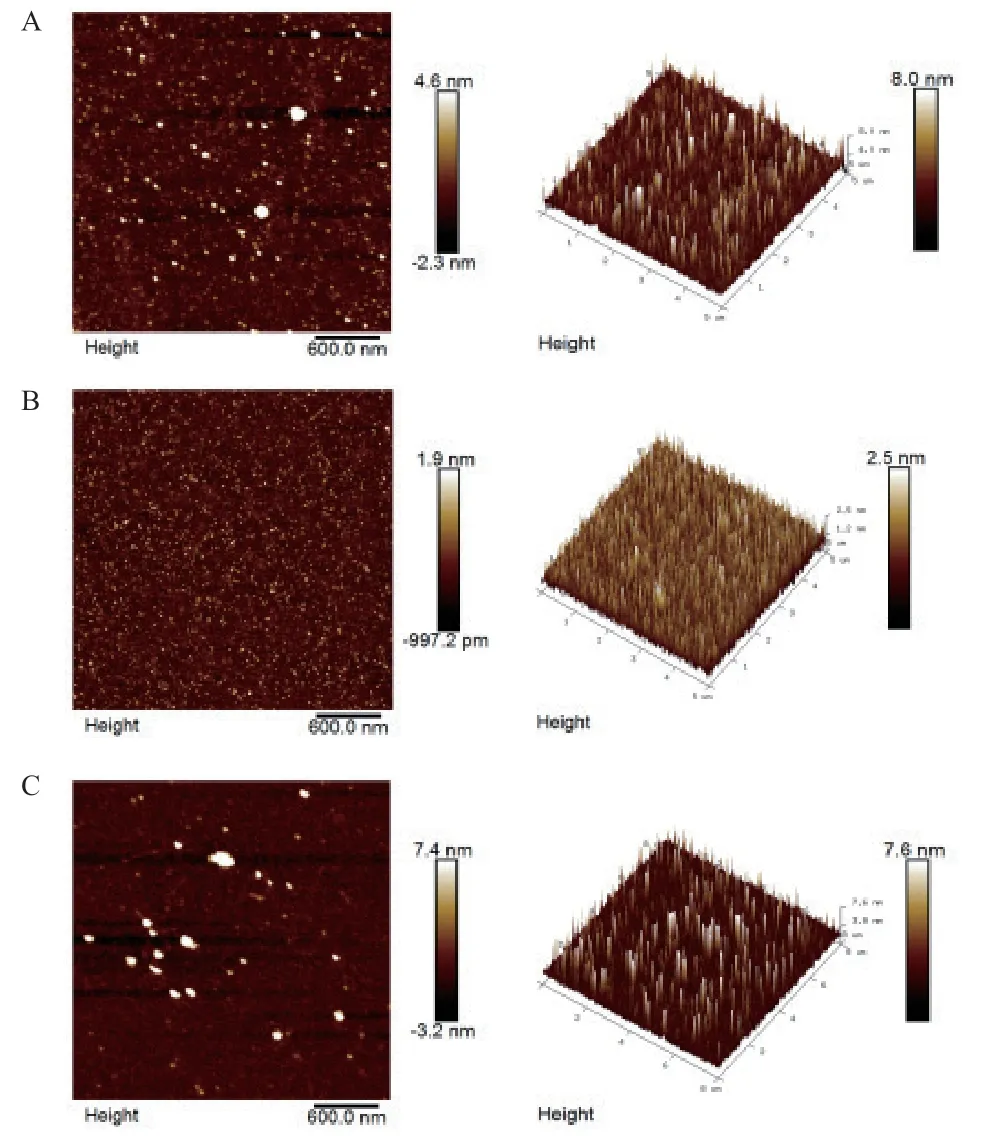
图3 鸡腿蘑胞外多糖的AFM 图像
2.4.2 DPPH 自由基清除能力分析 由图5-B 可知,鸡腿蘑胞外多糖对DPPH 自由基的清除能力呈浓度依赖性,在2.0-10.0 mg/mL 范围内,清除率随样品浓度的增加而增强。发酵120 h 的胞外多糖对DPPH自由基的清除率最高,发酵72 h 和96 h 的清除能力相当。浓度为10 mg/mL 时,鸡腿蘑胞外多糖在发酵72 h、96 h 和120 h 的清除率分别为(26.52±0.84)%、(27.57±0.65)%、(54.80±0.64)%。

图4 鸡腿蘑胞外多糖的分子量分布
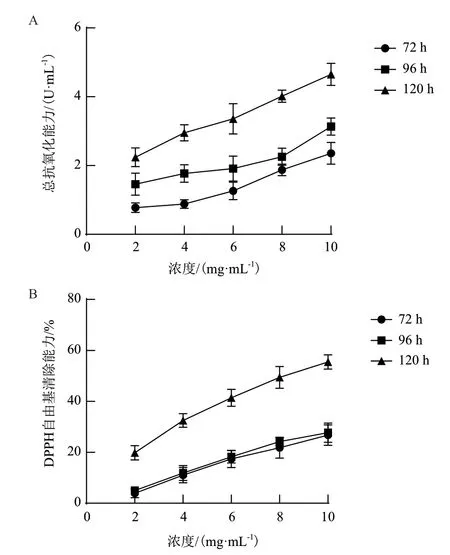
图5 鸡腿蘑胞外多糖的抗氧化活性
3 讨论
发酵是一个动态变化的过程,目前对发酵过程中多糖的研究主要集中于多糖含量的动态积累变化,对结构和活性变化的研究较少。因此,确定发酵过程中多糖的结构和生物活性的动态变化,并在此基础上探讨结构与活性的关系,对建立发酵过程中多糖的构-效关系有很重要的意义。本研究对不同发酵时间的鸡腿蘑胞外粗多糖的单糖组成、形貌结构和分子量分布进行阐述,并建立了与抗氧化活性的联系。HPLC 分析结果表明鸡腿蘑胞外多糖是以半乳糖为主的杂多糖。发酵时间为72 h、96 h 和120 h胞外多糖的单糖组成是一致的,但各单糖的相对摩尔比不同。通过扫描电子显微镜和原子力显微镜确定了发酵72 h、96 h 和120 h 胞外多糖的形态,可进一步分析得到多糖的链构象[21]。SEM 下胞外多糖呈板状,表面粗糙,说明其分支较多,复水性能好[22]。板状结构表明形成这些多糖聚集的键很强[23]。发酵120 h 胞外多糖的板状结构更规则,说明此时构成多糖聚合的键要比发酵72 h 和96 h 的多糖强,其紧密构型反映了高度支化的多糖链间的强交互作用[24]。AFM 是观察生物大分子的空间结构和表面形态的有力工具,可以观察某些线性和支链多糖的微观形态[24-25]。平面图像中的多糖团块表明鸡腿蘑胞外多糖的分子链在水溶液中团聚成球形颗粒,支持其支链结构,且团块的大小与多糖分子聚集的强弱有关[26]。从三维图像中可以看出发酵120 h 的多糖分子聚合度最高,这种多糖分子的聚合现象是由于羟基在分子内和分子间的强烈相互作用而产生的[27]。形貌结构分析表明鸡腿蘑胞外多糖是一种支链多糖,发酵时间对其链构象有一定的影响。采用HPGFC 分析得到了鸡腿蘑胞外多糖的相对分子质量及分子量分布范围,结果显示发酵过程中鸡腿蘑胞外多糖的分子量变大,分子量分布范围变广。杨仁智研究发现毛头鬼伞多糖的分子量在10-100 kD 之间和>750 kD 比较集中,且以小分子量多糖为主[28]。本研究中发酵120 h 的多糖分子量集中在23-96 kD,可推测得知此时的胞外多糖较成熟。Wang 等[21]研究发现分子量大的多糖,其分子聚集作用也强,本研究中发酵120 h 多糖的分子量最大,其多糖分子的聚集度也最高,与Wang 等[21]的研究结果一致。体外抗氧化试验结果表明鸡腿蘑胞外多糖呈现出浓度依赖性,在测试范围内各种样品的抗氧化能力随浓度的增加而增大,与Cao 等[29]的研究一致。在相同浓度下,发酵120 h 多糖的抗氧化能力要高于发酵72 h 和96 h 的多糖。
研究报道多糖的抗氧化作用与其结构有关,多糖链构象、分子结构、单糖组成、分子量和溶解度等都会影响到活性[30-31]。本研究发现发酵72 h、96 h 和120 h 鸡腿蘑胞外多糖的单糖组成没有显著差异,但其形貌结构和分子量分布有显著不同。因此,发酵120 h 鸡腿蘑胞外多糖优越的抗氧化活性可能与其独特的形貌结构和分子量分布有关。推测发酵120 h 胞外多糖的多糖链间的强交互作用以及多糖分子的高度聚集使得其抗氧化活性更强。其次,有研究报道分子量过大的多糖一般无活性,而分子量过低的多糖不能形成活性聚合物结构,所以活性多糖具有一定的分子量范围[32]。发酵120 h 的多糖分子量分布较广,且以低分子量为主,这可能也是其抗氧化活性较高的原因。然而,由于本研究是采用传统的制备粗多糖的方法来制备鸡腿蘑胞外粗多糖的,目前主要是为了考察胞外粗多糖的基本理化性质与抗氧化活性是否存在相关性,因此未对粗多糖的化学成分和纯度进行测定。对粗多糖做进一步的纯化处理,并更深入地对其进行结构鉴定及其他功能考察是本课题下一步研究工作的重点。
4 结论
本课题对发酵时间为72 h、96 h 和120 h 的鸡腿蘑胞外粗多糖的单糖组成,形貌结构和分子量分布进行表征,并进一步探讨与抗氧化活性的联系。单糖组成分析结果表明不同发酵时间鸡腿蘑胞外多糖的单糖组成是一致的,但各单糖的相对摩尔比不同。形貌结构分析表明,发酵120 h 鸡腿蘑胞外多糖的板状结构更加规则,分子聚集作用更强。分子量分布结果表明,发酵120 h 胞外多糖的分子量更大,分子量分布范围也更广。抗氧化试验结果表明发酵120 h 多糖的抗氧化活性更强。推测发酵120 h 胞外多糖的多糖链的紧密构象、多糖分子的高度聚集以及较广的分子量分布使得其抗氧化活性较发酵72 h和96 h 的多糖优越。因此,本研究表明鸡腿蘑胞外粗多糖的抗氧化活性可能与形貌结构和分子量分布有关。
