黄芪多糖下调心肌p38和核因子κB的磷酸化改善老年糖尿病鼠心脏功能
2021-04-26孙奇林陈雯洁赵雪兰王浩陈蔚
孙奇林,陈雯洁,赵雪兰,王浩,陈蔚
1.复旦大学附属华山医院老年科,上海200040;2.复旦大学基础医学实验教学中心,上海200032
糖尿病(diabetes mellitus,DM)是影响人类健康的慢性疾病之一,DM 的患病率随年龄增长而升高,约20%的老年DM 患者合并心血管并发症[1]。与非DM 心血管病患者相比,老年DM 心血管病患者心力衰竭的发病率可增加3 倍[2-3],已成为老年DM 患者的主要死因之一[4]。
老年DM 心血管病的发病机制复杂。近年来的研究发现,心肌纤维化在老年DM 患者病程早期就已出现,是促进老年DM 心血管病发生及进展的重要环节[5]。在老年DM 状态下,心肌细胞和心脏成纤维细胞可被诱导分泌白细胞介素-1(interleukin-1,IL-1)、IL-6 及转化生长因子-(transforming growth factor-,TGF-)等多种促纤维化因子,合成细胞外基质(I 和III型胶原),升高细胞外基质金属蛋白酶1(matrix metalloproteinase 1,MMP1)、MMP3 和MMP9 的表达,引发细胞外基质合成与降解失衡、心肌胶原纤维过度沉积,造成心肌纤维化和心室重构,最终导致心功能下降及心力衰竭[6-7]。黄芪多糖(astragalus polysaccharides,APS)是黄芪的均一多糖部分,为黄芪主要的活性成分之一。课题组前期研究证实,APS 可以改善DM 鼠的心脏功能,保护其心肌组织[8-9]。本研究拟在此基础上,进一步探讨APS 对老年DM 鼠心肌纤维化的干预作用及其可能机制。
1 材料与方法
1.1 试剂与仪器
1.1.1 主要试剂 链脲佐菌素(streptozocin,STZ,美国Sigma);APS(中科院上海生理所);糖化血清蛋白(glycosylated serum protein,GSP)试剂盒(美国Genzyme);BCA 试剂盒(美国Thermo Fisher);聚偏二氟乙烯膜(美国Millpoler);I 型胶原多克隆抗体(美国ADI);III 型胶原多克隆抗体(复旦上医病理学系);羊抗兔二抗(丹麦DAKO);MMP1 抗体、MMP3抗体、MMP9 抗体、IL-抗体、IL-6 抗体、TGF-抗体、胞外信号调节激酶(extracellular signal-regulated kinase,ERK)1/2 抗体、Jun 激酶(Jun kinase,JNK)抗体、p38 丝裂原激活蛋白激酶(mitogen activation proteinkinase,MAPK)抗体、核因子(nuclearfactor-,NF- B)/p65 抗体、GAPDH 抗体(英国Abcam)。
1.1.2 主要仪器 小动物彩色超声诊断仪(加拿大VisualsSonics);微量血糖测试仪(德国Bayer);超薄切片机(澳大利亚Leica);分析天平(德国Sar-torius);组织研磨仪(美国Qiagen);垂直电泳槽、蛋白电泳仪(美国Bio-rad);凝胶成像系统(美国Applied Biosystems);台式冷冻高速离心机5427R(德国Eppendorf)。
1.2 实验动物 18月龄SPF 级自然衰老的雄性C57-BL/6J 小鼠30 只[上海南方模式生物科技发展有限公司,合格证号:SCXK(沪)2014-0002],饲养于复旦大学医学院实验动物科学部。饲养期间每日12 h 光照,小鼠自由饮水和摄食。
1.3 动物分组与干预 30 只小鼠按照随机数字法分为对照(NS)组、老年糖尿病(DM)组和老年APS组,每组10 只。老年DM 组和老年APS 组单次腹腔注射STZ(100 mg/kg)[10];NS 组注射等体积生理盐水。小鼠糖尿病模型建立成功后,老年APS 组予APS 2 g/kg/d 灌胃16 周[11],NS 组和老年DM 组予等体积生理盐水灌胃16 周。
1.4 检测指标
1.4.1 心脏功能及血流动力学 小鼠麻醉后,使用小动物彩色超声诊断仪获取超声心动图。记录左心室短轴缩短率(leftventricularfractionalshortening,LVFS)、左心室收缩压(left ventricular systolic pressure,LVSP)、左心室舒张末期压(left ventricular end diastolic pressure,LVEDP)、左室内压最大上升速率(maximal change of pressure over time,+dP/dtmax)及左室内压最大下降速率(maximal change of pressure over time,-dP/dtmax)。
1.4.2 血糖和心肌酶谱 干预16 周后,剪尾采血法测定各组小鼠空腹血糖(fasting blood glucose,FBG)。颈椎脱臼法处死小鼠,眼球取血后离心取上清,全自动生化仪检测GSP、谷草转氨酶(aspartate aminotransferase,AST)、肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase isoenzymes,CK-MB)及乳酸脱氢酶(lactate dehydrogenase,LDH)水平。
1.5 心肌胶原纤维化评估 心肌组织制作石蜡切片,HE染色观察心肌组织病理变化,Masson 染色评估心肌纤维化程度。免疫组化法检测I、III 型胶原纤维含量及比值,每组随机选取5 个显微镜下无重叠的视野,通过Image J 对染色阳性物质进行灰度测定。
1.6 Western blot 取心肌组织匀浆裂解,BCA 法测定蛋白含量,SDS-PAGE 电泳分离法将蛋白转膜,5%脱脂乳封闭后与相应兔抗鼠一抗4℃孵育过夜,TBTS洗膜后加入HRP 标记的羊抗兔二抗孵育1 h,洗去二抗后ECL 显色成像。以GAPDH 为内参,检测目的蛋白相对表达水平。
1.7 统计学方法 采用SPSS 19.0 进行统计分析,计量资料以均数±标准差(±s)表示。多组比较采用单因素方差分析,事后检验经Bonferroni 校正法得2 组间检验结果,<0.05 为差异有统计学意义。
2 结果
2.1 血糖和心肌酶谱比较 与NS 组相比,老年DM 组和老年APS 组BG、GSP、AST、CK、CK-MB 及LDH升高(均<0.01)。与老年DM 组相比,老年APS 组BG、GSP、CK 和CK-MB 降低(均<0.01),2 组AST 和LDH 差异无统计学意义(>0.05)。见表1。
表1 3 组血糖和心肌酶谱比较(±s)

表1 3 组血糖和心肌酶谱比较(±s)
注:与NS 组比较,*<0.01;与老年DM 组比较,#<0.01
项目 NS 组 老年DM 组 老年APS 组images/BZ_201_1716_1719_1740_1744.pngimages/BZ_201_2050_1719_2074_1744.pngBG(mmol/L)GSP( mol/L)AST(U/L)CK(U/L)CK-MB(U/L)LDH(U/L)6.05±0.18 22.94±2.23 77.80±1.30 64.80±1.20 101.70±2.96 0.14±0.01 24.73±2.08*135.85±8.10*222.03±9.40*387.30±7.30*608.00±8.71*0.64±0.02*15.94±1.42*#85.91±4.20*#194.82±8.20*166.22±6.10*#339.00±6.98*#0.47±0.01*648.600 566.200 798.500 14 174.000 16 538.000 5 271.000<0.01<0.01<0.01<0.01<0.01<0.01
2.2 心脏功能和血流动力学比较 与NS 组相比,老年DM 组LVFS、LVSP、+dP/dtmax 及-dP/dtmax 降低;LVEDP 升高(均<0.01)。与老年DM 组相比,老年APS 组LVFS、LVSP、+dP/dtmax 及-dP/dtmax 升高;LVEDP 降低(均<0.01)。与NS 组相比,老年APS组LVFS、LVSP 和-dP/dtmax 降低(均<0.01),2 组LVEDP 及+dP/dtmax 差异无统计学意义。见表2。
表2 3 组心脏功能和血流动力学比较(±s)

表2 3 组心脏功能和血流动力学比较(±s)
注:与NS 组比较,*<0.01;与老年DM 组比较,#<0.01
项目 NS 组 老年DM 组 老年APS 组images/BZ_201_1819_2275_1843_2300.pngimages/BZ_201_2085_2275_2109_2300.pngLVFS(%)LVSP(mmHg)LVEDP(mmHg)+dP/dtmax(mmHg/s)-dP/dtmax(mmHg/s)64.00±4.30 97.00±3.30 7.80±1.10 8 197.00±471.00 6 851.00±333.00 36.00±1.15*75.00±1.72*13.10±2.10*5 828.00±236.00*4 706.00±227.00*56.00±1.90*#94.00±2.60*#7.60±0.90#8 129.00±438.00#6 489.00±310.00*#447.300 343.400 61.190 69.870 247.400<0.01<0.01<0.01<0.01<0.01
2.3 心肌胶原纤维化比较 与NS 组相比,老年DM 组心肌组织结构紊乱,胶原纤维明显沉积,I 型胶原纤维含量和I/III 型胶原纤维比值升高(均<0.01)。与老年DM 组相比,老年APS 组心肌组织排列紊乱现象好转,胶原纤维沉积减少,I 型胶原纤维含量和I/III 型胶原纤维比值降低(均<0.01)。NS 组与老年APS组胶原纤维含量差异无统计学意义。见表3、图1。
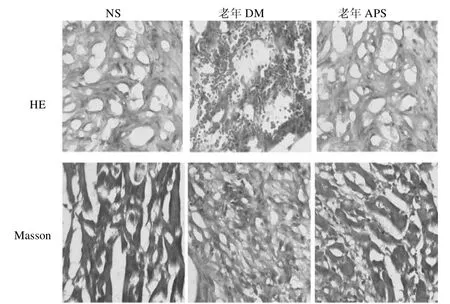
图1 3 组心肌病理HE 染色和心肌胶原纤维Masson 染色(×400)
表3 3 组心肌胶原纤维化比较(±s)

表3 3 组心肌胶原纤维化比较(±s)
注:与NS 组比较,*<0.01;与老年DM 组比较,#<0.01
项目 NS 组 老年DM 组 老年APS 组images/BZ_201_1807_2773_1831_2798.pngimages/BZ_201_2081_2773_2105_2798.pngI 型胶原纤维含量III 型胶原纤维含量I/III 型胶原纤维比值3.65±0.23 1.52±0.11 2.12±0.07 5.46±0.29*1.85±0.13 2.67±0.22*3.92±0.14#1.64±0.07 2.14±0.11#240.500 13.910 48.030<0.01<0.01<0.01
2.4 MMPs 和促纤维化因子蛋白表达 与NS 组相比,老年DM 组心肌细胞外MMP1、MMP3、MMP9、IL-1 、IL-6 和TGF- 蛋白表达增多(均<0.01)。与老年DM 组相比,老年APS 组心肌细胞外MMP1、MMP3、MMP9、IL-1 、IL-6 和TGF-蛋白表达减少(均P<0.01)。与NS 组相比,老年APS 组MMP3(P=0.018)及IL-1 、IL-6、TGF-(均P<0.01)蛋白表达增多,2 组MMP1 和MMP9 差异无统计学意义。见图2。

图2 3 组MMPs 和促纤维化因子蛋白表达比较
2.5 MAPK 的蛋白磷酸化水平 与NS 组相比,老年DM 组心肌ERK1/2、JNK、p38 MAPK 及NF-/p65蛋白磷酸化水平升高(均<0.01)。与老年DM 组相比,老年APS 组心肌p38 MAPK 及NF- B/p65 蛋白磷酸化水平降低(均<0.01),2 组ERK1/2 和JNK的蛋白磷酸化水平差异无统计学意义。与NS 组相比,老年APS 组ERK1/2、JNK 及p38 MAPK 蛋白磷酸化水平升高(均<0.01),2 组NF- B/p65 蛋白磷酸化水平差异无统计学意义。见图3。

图3 3 组ERK1/2、JNK、p38MAPK 和NF- B/p65 磷酸化表达
3 讨论
老年DM 心血管病的发病机制复杂,公认的经典机制包括心肌能量代谢障碍、氧化应激、慢性炎症、胰岛素抵抗和心肌纤维化等。目前认为心肌纤维化是老年DM 心血管病的重要发病机制之一[12]。心肌纤维化导致心肌广泛性坏死、间质纤维化、心室重构及心功能不全等一系列老年DM 心血管病病理过程,最终引发老年DM 患者的充血性心力衰竭[13-14]。
黄芪主治气虚,多用于DM 患者心功能不全的配伍治疗,临床观察确有疗效而机制不明[15],APS 是黄芪主要的有效活性成分之一[16]。本次研究发现,APS干预治疗后老年DM 组心肌酶谱恢复正常,心脏功能改善,血流动力学紊乱得以纠正,提示APS 对老年DM 鼠心血管病有一定的保护作用。APS 干预后,老年DM 鼠的心肌IL-、IL-6、TGF-、MMP1、MMP3和MMP9 蛋白表达减少,I 型胶原纤维含量和I/III 型胶原纤维比值恢复正常,说明APS 可以延缓老年DM鼠心肌纤维化的发生与发展,对老年DM 鼠心脏功能起到有效的保护作用。进一步研究发现,老年DM 鼠心肌ERK1/2、JNK、p38 MAPK 及其下游基因NF-/p65 的蛋白磷酸化水平增高,而APS 可以降低p38 MAPK 及NF-/p65 的蛋白磷酸化水平。考虑该现象可能与p38 MAPK/NF-信号通路调控的生理过程相关。
p38 MAPK 作为一类酪氨酸磷酸化蛋白激酶,与心肌胶原沉积及纤维化的调控关系密切[17]。而NF-是p38 MAPK 下游重要的转录调控因子,其表达活性受p38 MAPK 的正调控。研究表明,p38MAPK/NF-B 信号通路的激活是心血管疾病和心肌纤维化反应链的“基因开关”[18-19]。此次研究结果也支持这一理论。目前认为持续的高血糖能激活心肌p38 MAPK/NF-信号通路,诱导心肌细胞和心脏成纤维细胞分泌炎症细胞因子,合成炎性蛋白和炎症介质,从而介导老年DM 心血管病的心肌纤维化[20]。
综上所述,APS 可能通过下调老年DM 鼠心肌p38 MAPK 及其下游基因NF-的蛋白磷酸化水平,减少老年DM鼠心肌促纤维化因子蛋白和心肌细胞外MMPs 的蛋白表达,抑制心肌I 型胶原纤维过度沉积和I/III 型胶原纤维比例失调,延缓心肌纤维化发生、发展,从而对老年DM 心脏功能起到保护作用。但APS延缓DM心肌纤维化的具体分子机制尚有待进一步研究,未来将进行体内外实验深入探讨APS 对DM心肌纤维化的抑制作用及其机制。
