睾丸绒毛膜癌一例
2021-04-25田金肖雅楠张腾龙王洁金材龙郭成业
田金?肖雅楠?张腾龙?王洁?金材龙?郭成业
【摘要】绒毛膜癌是滋养细胞组织产生的恶性肿瘤。纯绒毛膜癌在睾丸中很少见,臨床上,多见青年患者,且常出现与转移扩散相关的症状,包括肺转移引起的咯血、腹膜后扩散引起的背痛、胃肠道出血和中枢神经系统受累引起的神经症状。该文报告一例46岁睾丸绒毛膜癌患者,以肺转移为首发症状,患者接受了放射治疗、化学治疗和免疫治疗,但治疗效果差,患者于确诊7个月后死亡。该例患者并非处于睾丸绒毛膜癌的高发年龄,病情进展极快,其诊治过程提示睾丸绒毛膜癌恶性程度高,临床特征是转移部位出血,患者预后差。临床医师应拓宽诊断思维,提高对罕见疾病的认识水平。
【关键词】男性;睾丸肿瘤;绒毛膜癌;肺转移;滋养细胞
Testicular choriocarcinoma: one case report Tian Jin, Xiao Yanan, Zhang Tenglong, Wang Jie, Jin Cailong, Guo Chengye. Department of Oncology, Qingdao Municipal Hospital Affiliated to Qingdao University, Qingdao 266000, China
Corresponding author, Guo Chengye, E-mail: chengye_guo@ qq. com
【Abstract】Choriocarcinoma is a malignant tumor derived from trophoblastic tissues. Pure choriocarcinoma is rarely seen in the testis. In clinical practice, it is more common in young patients, often manifested with symptoms related to metastasis and diffusion including hemoptysis caused by lung metastasis, back pain caused by retroperitoneal diffusion, gastrointestinal bleeding and neurological symptoms caused by central nervous system involvement. In this article, 1 male patient with pure testicular choriocarcinoma was reported. The initial symptom was lung metastasis. The patient received radiotherapy, chemotherapy and immunotherapy, but the treatment effect was poor. The patient died at 7 months after diagnosis. This patient was not aged in a high-risk period of testicular choriocarcinoma. The disease progressed at an extremely rapid speed. The diagnosis and treatment prompt that testicular choriocarcinoma is highly malignant, which is manifested with bleeding at the metastasis site and poor prognosis. Clinicians should broaden diagnostic thinking and deepen the understanding of this rare disease.
【Key words】Male;Testicular tumor;Choriocarcinoma;Lung metastasis;Trophoblast
绒毛膜癌占睾丸肿瘤的不到2%,睾丸绒毛膜癌在临床是非常罕见的,容易误诊。单纯性绒毛膜癌由于肿瘤细胞在早期经血行播散,多以肺和脑为靶器官,患者预后较差。笔者近年收治一例睾丸绒毛膜癌患者,患者为46岁男性,以咳痰带血丝为首发表现入院,经病理活组织检查(活检)及免疫组织化学染色检查(免疫组化)证实为纯绒毛膜癌,为提高临床医师对该病的认识水平,现将该例患者的诊治过程总结报告如下。
病例资料
一、病史及体格检查
患者男,46岁。2018年10月17日因查体发现肺占位3 d收入院。入院前3 d患者因“痰中带血丝”在即墨区第二人民医院行胸部CT检查,结果示双肺转移瘤并肺内感染,患者无胸痛、胸闷,无明显黄痰及发热盗汗史,未行治疗,后至青岛大学附属青岛市市立医院胸外科就诊,门诊拟“双肺多发结节”收入院。患者平素健康状况良好,有先天右侧隐睾病史和肩周炎病史20年,无高血压、糖尿病、冠状动脉粥样硬化性心脏病(冠心病),无外伤史,无肝炎、肺结核、疟疾、细菌性痢疾等传染病史。7年前行“疝气”手术,无输血史,接种史随当地。无药物过敏史。吸烟史10余年,未戒烟。无饮酒嗜好。父母已故,具体原因不详。家族中无同类患者,无家族遗传病史。
入院体格检查:体温36.8℃,脉搏75次/分,呼吸20次/分,血压125/80 mm Hg(1 mm Hg = 0.133 kPa)。胸廓无畸形,双侧呼吸运动对称,语颤无增强及减弱,双肺叩诊呈清音,双肺呼吸音低,未闻及干湿性啰音。患者右侧睾丸缺如,皮温正常,未触及明显包块或异常波动感。
二、实验室及辅助检查
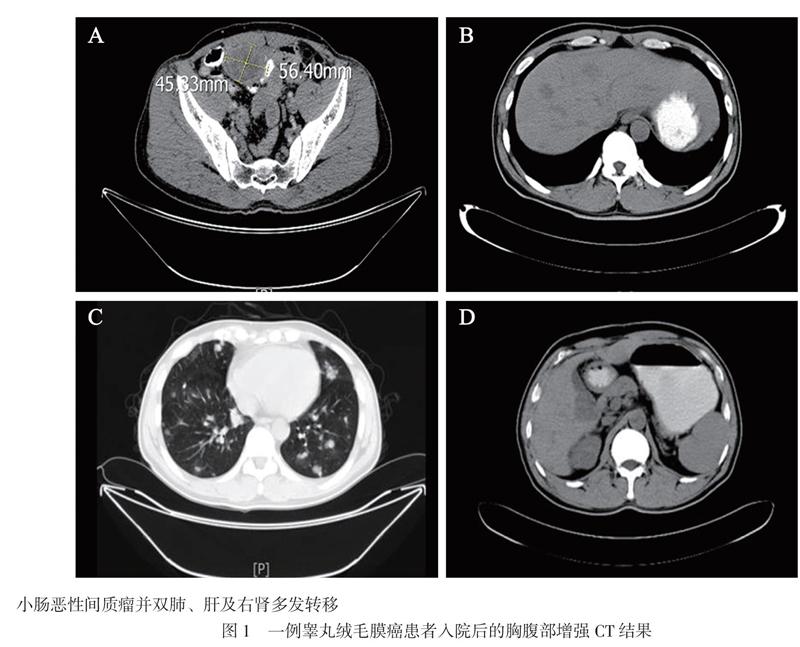
血常规示血红蛋白 58.0 g/L,红细胞1.8×109/L,白细胞9.0×109/L,血小板475×109/L。CRP 5.67 mg/L。总胆红素19.3 μmol/L,白蛋白44.24 g/L。血清肌酐64.69 μmol/L。甲胎蛋白、癌抗原125、癌抗原153、糖链抗原199、神经元特异性烯醇化酶(NSE)、鳞癌相关抗原(SCC)均在正常范围内。癌胚抗原4.50 μg/L。可溶性细胞角蛋白19片段4.93 μg/L。抗结核抗体(-)。全胸腹部增强CT重建扫描:考虑小肠恶性间质瘤并双肺、肝及右肾多发转移,见图1。
三、诊治过程
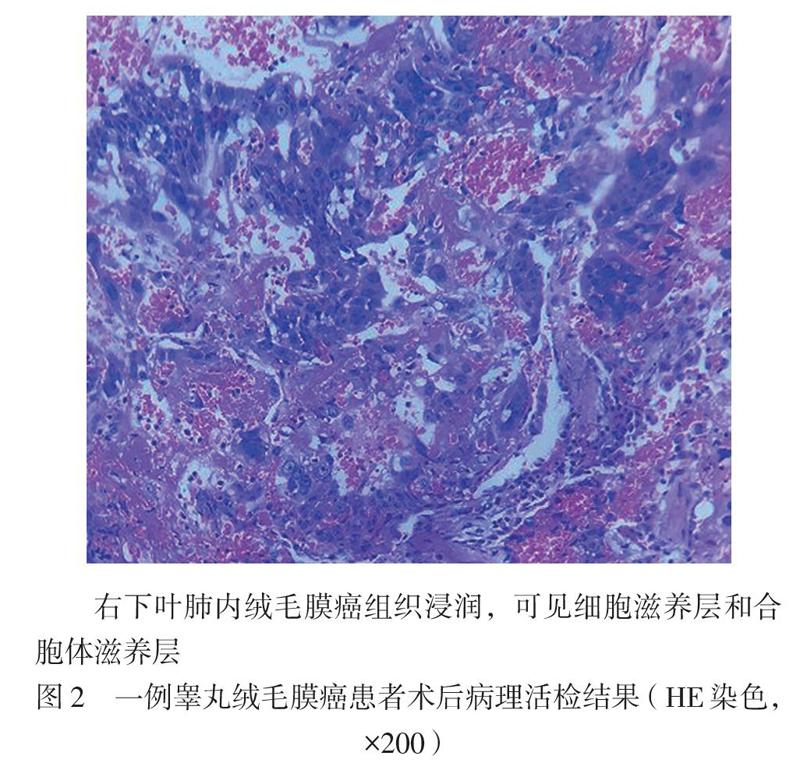
10月26日予患者全身麻醉,行胸腔镜下肺楔形切除术+胸膜粘连松解术+肋间神经阻滞治疗,术中病理活检结果:见低分化癌,倾向低分化鳞癌。石蜡病理活检结果提示右下叶肺内绒毛膜癌组织浸润,可见细胞滋养层和合胞体滋养层。免疫组化:β-人绒毛膜促性腺激素(β-HCG,+),角蛋白5/6(CK5/6,-),P63(部分+),P40(部分+),细胞增殖指数Ki-67 (80%+),甲状腺转录因子-1(TTF-1,-),NapsinA(-),成框基因8编码的转录因子(PAX-8,-),癌胚抗原(-),CK7(+),NSE(-),CK(+),见图2。
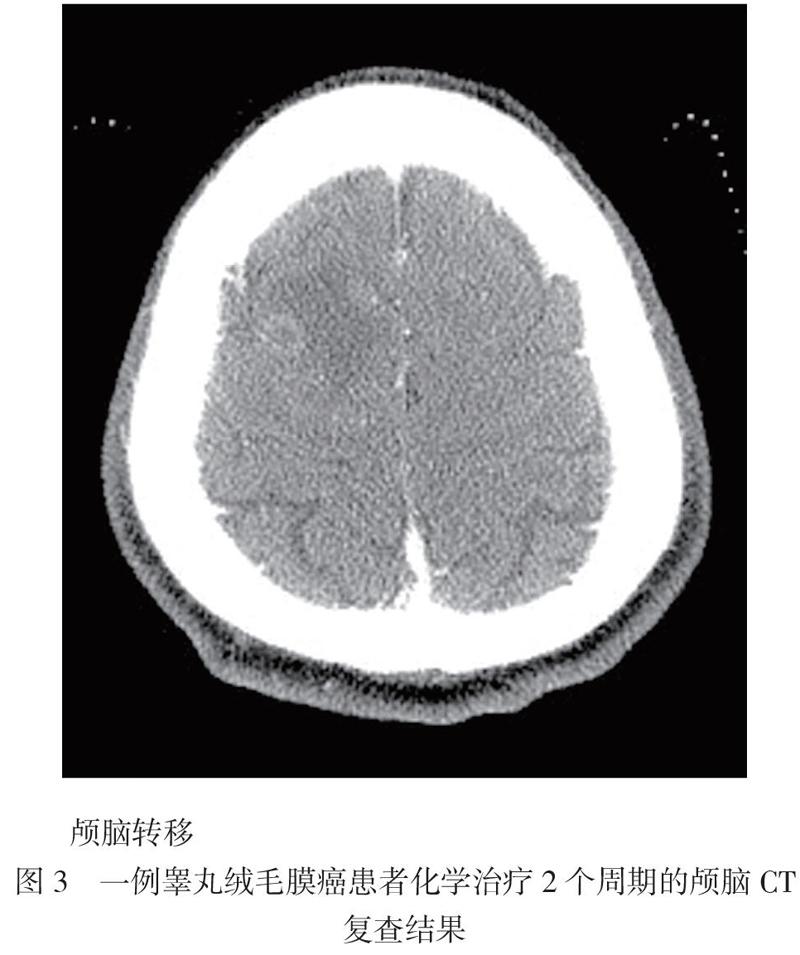
术后患者恢复良好。根据患者病理结果、免疫组化及先天隐睾病史,诊断为单纯睾丸绒毛膜癌肺转移。由于患者入院时无睾丸癌相关临床表现,未行盆腔部位影像学检查及相关肿瘤标志物检查。11月5日患者转至肿瘤科进行内科综合治疗。因其入院时存在重度贫血,给予输血治疗,待一般状况改善后于11月13日开始化学治疗,方案为长春新碱(第1日2 mg)+替吉奥(第1 ~ 7日40 mg每日2次、第8 ~ 14日50 mg每日2次)。第2周期化学治疗入院时影像学复查提示肝转移病灶较前增大,12月5日尝试给予第2周期化学治疗,方案为长春新碱(第1日2 mg)+替吉奥(第1 ~ 14日60 mg每日2次)+放线菌素D(第6 ~ 18日3 mg/d)。化学治疗2个周期后复查颅脑CT提示颅脑转移,见图3。
因病情进展,于第3周期更换化学治疗方案为长春新碱(第1日2 mg) +依托泊苷(第1 ~ 5日0.1 g/d)+放线菌素D(第1 ~ 5日0.3 mg/d)+替吉奥(第1 ~ 14日75 mg每日2次)。患者一般状态恢复后于2019年1月16日至2月12日行全脑放射治疗,4000 cGy/20 f,每周5次。由于患者化学治疗不良反应较为严重,2月14日行第4周期减量化学治疗,方案为长春新碱(第1日2 mg)+依托泊苷(第1 ~ 4日0.1 g/d)+放線菌素D(第1 ~ 4日0.3 mg/d)+替吉奥(第1 ~ 14日75 mg每日2次)。第4周期化学治疗后患者诉腰背部疼痛,复查腰椎胸椎MRI提示T5椎体转移,见图4。2月15日至28日针对胸椎转移行姑息放射治疗,30 Gy/10 f,每周5次。3月1日行信迪丽单抗200 mg免疫治疗。3月6日行第5周期化学治疗,方案为甲氨蝶呤(第1、5日60 mg/d)+顺铂(第1 ~ 5日35 mg/d)。4月22日行第2次信迪丽单抗200 mg免疫治疗。4月24日行第6周期化学治疗,方案为甲氨蝶呤(第1、5日60 mg/d)+顺铂(第1 ~ 5日30 mg/d)。5月19日患者再次入院,入院时其一般状态较差,黑便持续,贫血无改善,处于病情终末期,给予输注去白细胞悬浮红细胞治疗后仍无改善,一般状态差,因经济原因家属放弃进一步治疗,自动出院,随访不久后死亡。
讨论
睾丸生殖细胞肿瘤是起源于胚胎性腺中的原始生殖细胞,在其分化、成熟和移行过程中形成的一组肿瘤。绒癌则是原始未分化的生殖细胞向胚外分化的结果。睾丸中的纯绒毛膜癌临床非常罕见,占睾丸生殖细胞肿瘤的不到1% (0.19%)。睾丸绒毛膜癌的发病率为(2 ~ 4)/1000万,占男性恶性肿瘤0.01% ~ 0.02%[1]。男性绒毛膜癌通常发病年龄为20 ~ 39岁[2]。本例患者为46岁男性,该年龄较少见绒毛膜癌,且为单纯绒毛膜癌,没有与其他生殖细胞肿瘤成分混合,较为罕见。
目前睾丸绒毛膜癌的发病原因尚不清楚,根据流行病学分析有多种危险因素。文献报道,隐睾患者发生绒毛膜癌的概率比睾丸正常者高出20 ~ 40倍[4]。原因不仅在于睾丸本身,可能还与家族遗传因素、性腺发育不全、内分泌失调等有关。基因学研究表明,睾丸肿瘤与12号染色体短臂异位有关,p53基因的改变也与睾丸肿瘤的发生有关[5]。本文患者有先天右侧隐睾病史,但未进一步证实隐睾与此疾病之间的关系。睾丸绒毛膜癌发生于右侧者略多于左侧,与隐睾略多发生于右侧相吻合。
睾丸绒毛膜癌是最具侵袭性且发展最快的生殖细胞肿瘤。在确诊时,大部分病例已经发生转移。国内文献有记载的睾丸绒毛膜癌仅有10例,7例在发现时已有远处转移[3]。由于病灶血管化程度高,患者往往出现转移部位出血的症状[6]。已有报告远处转移发生在肺、肝、脑和一些不寻常的部位如皮肤、胃、小肠等[1]。好发转移部位依次是肺(100%)、肝(86%)、胃肠道(71%)、脾、脑和肾上腺(56%)。绒毛膜癌通常在早期经血行播散到肺和脑[7]。发生脑转移的成人患者通常会出现癫痫发作、卒中样症状、精神错乱或咯血,儿童患者偶可引起性早熟,血HCG水平升高,患者也可能表现出高雌激素特征,例如男性乳房女性化。发生胃转移患者的主要症状是黑便和(或)呕血以及贫血[6]。胃肠道的大多数转移性病变见于小肠[6]。睾丸绒毛膜癌患者经常因转移症状就诊,包括咯血、黑便、神经症状、呼吸困难等。本例患者是以痰中带血为首发症状就诊。
睾丸绒毛膜癌的影像学缺乏可与其他类型生殖细胞肿瘤相鉴别的特征性改变。绒毛膜癌初诊确诊时较为困难,多为手术切除时获得标本经病理确诊。由于病例罕见,其治疗及随访资料有限。绒毛膜癌非常易侵犯血管,可在原发性肿瘤表现不明显的情况下发生广泛播散,因此绒毛膜癌的预后较其他睾丸肿瘤差[8]。早期发现的睾丸纯绒毛膜癌,由于全身其他部位转移灶很微小,可行病变侧睾丸切除加以顺铂为主的联合化学治疗,有获得长期无瘤生存甚至治愈的可能。转移性绒毛膜癌应根据疾病的进展程度进行个体化治疗[9]。对于早期就出现转移灶的睾丸绒毛膜癌,仅能采用以化学治疗为主的综合治疗措施。化学治疗后是否需要切除转移灶,文献报道不一致,有学者认为必须尽可能切除残余病灶[10]。但也有学者认为没必要切除,绒毛膜癌容易全身多处转移,很难做到无瘤生存[11]。HCG的血清水平可用于监测治疗反应。根据国际生殖细胞癌症合作组织指南,患者HCG水平高于50 000 U/L将被认定为预后不良。本例遗憾之处在于治疗期间未检测血HCG水平。该患者CT报告显示小肠恶性间质瘤,结合患者临床表现及该疾病特点,我们怀疑小肠部位肿瘤为转移瘤,因患者病情进展迅速,且一般状态较差,只能行姑息治疗手段,并且患者家属未同意进一步穿刺取得活检证实。此患者从发现患病到死亡大约经历了7个月,一直有痰中带血、消化道慢性失血,贫血严重,需间断性输血治疗,这正验证了该病的临床特征是转移部位出血。
综上所述,睾丸绒毛膜癌的恶性程度高,病程进展极快,临床特征是转移部位出血,预后差。临床医师应拓宽诊断思维,提高对罕见疾病的认识水平。
参 考 文 献
[1] Toberer F, Enk A, Hartschuh W, Grüllich C. Testicular choriocarcinoma with cutaneous metastasis in a 19-year-old man. J Cutan Pathol, 2018, 45(7):535-538.
[2] Alvarado-Cabrero I, Hernández-Toriz N, Paner GP. Clini-copathologic analysis of choriocarcinoma as a pure or predominant component of germ cell tumor of the testis. Am J Surg Pathol, 2014, 38(1):111-118.
[3] 马小波,邹亚斌,钟艳平. 睾丸纯绒癌1例报告及文献复习. 中华男科学杂志,2015,21(10):953-956.
[4] Richie JP. Re: a meta-analysis of the risk of boys with isolated cryptorchidism developing testicular cancer in later life. J Urol, 2013, 190(3):1045.
[5] Li B, Cheng Q, Li Z, Chen J. p53 inactivation by MDM2 and MDMX negative feedback loops in testicular germ cell tumors. Cell Cycle, 2010, 9(7):1411-1120.
[6] Chaar A, Mouabbi JA, Alrajjal A, Barawi M. Metastatic testicular choriocarcinoma: an unusual cause of upper gastro-intestinal bleed. Cureus, 2019, 11(7):e5243.
[7] Smith ZL, Werntz RP, Eggener SE. Testicular cancer: epidemiology, diagnosis, and management. Med Clin North Am, 2018, 102(2):251-264.
[8] Rajpert-De Meyts E, McGlynn KA, Okamoto K, Jewett MA, Bokemeyer C. Testicular germ cell tumours. Lancet, 2016, 387(10029):1762-1774.
[9] Reilley MJ, Pagliaro LC. Testicular choriocarcinoma: a rare variant that requires a unique treatment approach. Curr Oncol Rep, 2015, 17(2):2.
[10] Feldman DR, Bosl GJ, Sheinfeld J, Motzer RJ. Medical treatment of advanced testicular cancer. JAMA, 2008, 299(6):672-684.
[11] Kandori S, Kawai K, Fukuhara Y, Joraku A, Miyanaga N, Shimazui T, Akaza H. A case of metastatic testicular cancer complicated by pulmonary hemorrhage due to choriocarcinoma syndrome. Int J Clin Oncol, 2010, 15(6):611-614.
(收稿日期:2020-12-28)
(本文編辑:林燕薇)
