采用腹腔镜经正中裂入路解剖性肝Ⅷ段切除术治疗肝癌的研究
2021-04-25方扬何军明彭建新
方扬?何军明?彭建新
【摘要】目的 探討采用腹腔镜经正中裂入路解剖性肝Ⅷ段切除术治疗肝癌的手术效果及可行性,总结相关经验。方法 回顾性分析接受腹腔镜经正中裂入路解剖性肝Ⅷ段切除治疗的22例肝癌患者的临床资料,总结手术效果。结果 22例手术均顺利完成,经正中裂入路不容易压迫肿瘤,术中视野暴露好,操作相对简单,但手术创面偏大。22例均无中转开腹或围术期死亡,手术时间186(92,203)min,术中出血量100(50,200)ml。术中对14例实施了Pringle法阻断入肝血流,肝血流阻断时间为(28±6)min。22例术后住院时间为(12.1±2.2)d。22例术后Clavien-Dindo并发症分级系统分级Ⅰ、Ⅱ、Ⅲ(Ⅲa、Ⅲb)级并发症的发生率分别为13.6%(3/22)、4.5%(1/22)、31.8%(7/22),无腹腔出血、肝衰竭、顽固性腹水等并发症。22例术后病理检查结果均为肝细胞癌,病理切缘均阴性,肝切缘宽度为(1.9±0.4)cm。22例的随访时间为22(14,29)个月,10例患者出现肝内局部复发,复发时间为28(10,31)个月,1年内复发率和3年内复发率分别为18.2%、45.5%。结论 腹腔镜经正中裂入路解剖性肝Ⅷ段切除术的视野暴露好,手术效果尚可,用于肝癌患者具有一定的可行性。但因手术创面偏大,故需要术者熟练掌握腹腔镜肝切除技术,具备较强的损伤控制能力。
【关键词】正中裂入路;腹腔镜;解剖性肝切除;肝Ⅷ段
Application of laparoscopic anatomical resection of segment Ⅷ via separation of median hepatic fissure approach in treatment of hepatocellular carcinoma Fang Yang, He Junming, Peng Jianxin. Guangzhou University of Chinese Medicine, Guangzhou 510405, China
Corresponding author, He Junming, E-mail: 1277155944@ qq. com
【Abstract】Objective To evaluate the surgical efficacy, feasibility and summarize experience of laparoscopic anatomical resection of segment Ⅷ via separation of the median hepatic fissure approach in the treatment of hepatocellular carcinoma. Methods Clinical data of 22 patients with hepatocellular carcinoma undergoing laparoscopic anatomical resection of segmentⅧ via separation of the median hepatic fissure approach were retrospectively analyzed. Surgical efficacy of this technique was evaluated. Results All 22 patients successfully completed the surgery. The median hepatic fissure approach yielded a low risk of tumor compression, better surgical field exposure and simpler operation, whereas it might cause larger wound. No patient was switched to open surgery or died during the perioperative period. The median operation time was 186 (92, 203) min, and the median intraoperative blood loss was 100 (50, 200) ml. The average hepatic blood flow block time was (28±6) min for 14 patients undergoing Pringle method. The average length of postoperative hospital stay was (12.1±2.2) d. The proportion of postoperative Clavien-Dindo classification Ⅰ, Ⅱ, Ⅲ (Ⅲa, Ⅲb) was 13.6% (3/22), 4.5% (1/22) and 31.8% (7/22),respectively. No abdominal bleeding, liver failure or refractory ascites was observed. All 22 patients were diagnosed with hepatocellular carcinoma by postoperative pathological examination. All pathological margins were negative, and the average width of liver margin was (1.9±0.4) cm. The follow-up time was 22 (14, 29)months. A total of 10 patients developed intrahepatic local recurrence. The average recurrence time was 28 (10, 31) months. The 1- and 3-year recurrence rates were 18.2% and 45.5%. Conclusions Laparoscopic anatomical resection of segmentⅧ via separation of the median hepatic fissure approach yields good visual field exposure and relatively high surgical efficacy, which is a feasible strategy for hepatocellular carcinoma patients. Nevertheless, it has demanding requirement for the surgeons with skilled laparoscopic hepatectomy and wound control ability.
【Key words】Median hepatic fissure approach;Laparoscopy;Anatomical hepatectomy;Segment Ⅷ
作为全球发病率排名第5的恶性肿瘤,肝癌治疗的首选方案始终是外科手术,外科手术技术的进步使更多的肝癌患者例如肿瘤负荷过大、复杂肿瘤或合并严重肝脏疾病者能够耐受根治性切除术[1]。理想的解剖性肝切除术不仅能保证足够宽的阴性切缘,而且能最大限度地保留正常肝实质,同时能满足快速康复的外科观念,显著改善肝癌患者的生存及预后,5年内生存率可达到60% ~ 65%[2-5]。
由于肝脏本身“楔形”的复杂形态,加之其复杂的管道系统,肝Ⅶ段、Ⅷ段的解剖性肝切除成为了肝脏外科的难点。其中肝Ⅷ段位于右肝膈顶靠前上方,紧邻第一、第二肝门以及下腔静脉前方、肝右静脉和肝中静脉之间,位置较深,术中暴露空间有限。术中暴露困难一度被认为是肝切除的难点,尤其是开腹解剖性肝Ⅷ段切除术,过去学者们普遍认为肝Ⅷ段切除是大部肝外科医师的禁区,而开展腹腔镜解剖性肝Ⅷ段切除术更是难上加难。腹腔镜容易获取深藏于膈下的S8段全面视野,可以在直视下实施更为精确的操作,符合精准外科的理念,目前国内外少数医疗中心采用腹腔镜解剖性肝Ⅷ段切除术治疗肝癌[6-9]。我科从2017年6月起开展了采用腹腔镜经正中裂入路解剖性肝Ⅷ段切除术的项目,目前已完成22例手术,积累了一些经验,现报道如下。
对象与方法
一、研究对象
22例患者中男13例、女9例,年龄(57±17)岁。22例术前行增强CT及普美显MRI均显示病灶为单发且局限于肝Ⅷ段,大小为(5.7±2.5)cm,根据《原发性肝癌诊疗规范(2019年版)》确诊分期均属于CNLC Ⅰa期。22例中合并慢性乙型肝炎10例、肝硬化7例、非酒精性脂肪肝4例、慢性丙型肝炎3例,合并高血压4例、糖尿病2例,有重度饮酒史2例,均无腹部手术史。术前1周测得14例患者凝血酶原(PIVKA-Ⅱ)98 ~ 1208 mAU/ml,6例患者甲胎蛋白20 ~ 246 μg/L,1例患者ALT 45 U/L,22例的碱性磷酸酶(ALP)、总胆红素、白蛋白及凝血酶原活动度(PTA)均正常,术前肝功能评估均为Child-Pugh A级。
二、手术方法
1. 术前准备
术前对22例患者行心脏彩色多普勒超声检查(彩超),评估心肺风险,完善吲哚菁绿试验(15 min滞留率均小于10%),采用增强CT三维重建计算残余肝体积与标准肝体积比值(剩余肝体积比)为84% ~ 113%。 要求患者术前6 h禁食固体食物,术前2 h禁饮。
2. 手术体位及Trocar孔布置
采用气管插管全身麻醉,常规取仰卧分腿位、头高脚低,建立二氧化碳气腹。腹腔镜操作采用5孔法:首先取脐下2 cm建立观察孔,主操作孔位于正中线偏右3 cm剑突与脐连线中点;副操作孔位于右侧锁骨中线主操作平面。主刀医师站于患者双腿间,第一助手站于患者左侧。
3. 第一肝门处理
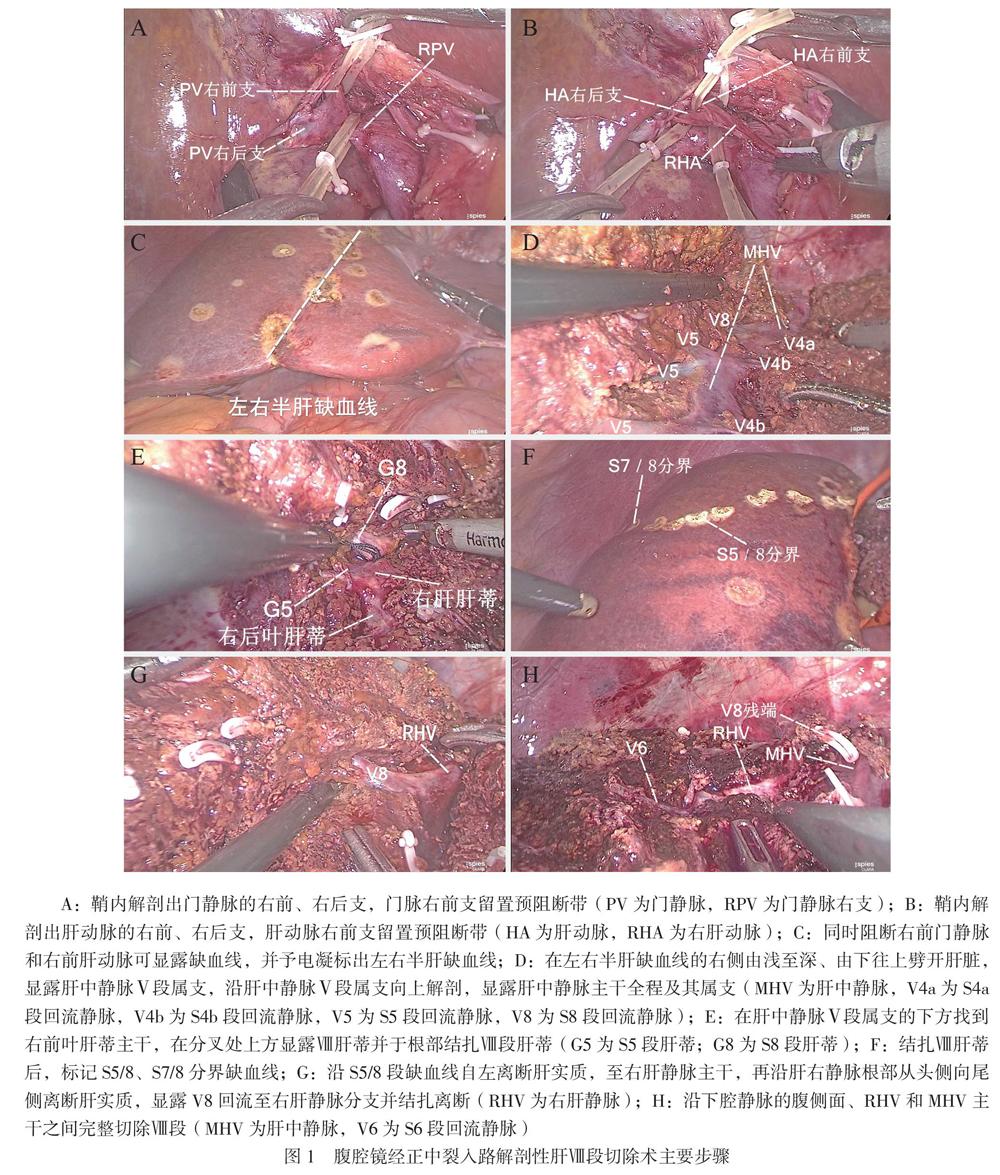
离断肝圆韧带和镰状韧带并向头侧牵拉,常规切除胆囊。向左侧牵拉胆囊管,自右侧分开肝十二指肠韧带前后层腹膜,显露门静脉右支后向上继续解剖门静脉的右前、右后支(图1A);循胆囊动脉解剖出右肝动脉,同法继续向远端分离出肝动脉的右前、右后支(图1B);对门静脉和肝动脉二级分支留置预阻断带并将其悬吊。
4. 离断肝实质
于腹腔镜超声引导下在肝表面标记肿瘤范围和中心位置,同时标记肝中静脉走形。阻断右前门静脉和右前肝动脉,显露缺血线(图1C),必要时以Pringle法间断阻断入肝血流,阻断模式为“15 min+5 min”,在半肝缺血线的右侧自腹侧向背侧、足侧向头侧劈开肝脏,显露肝中静脉Ⅴ段属支,沿肝中静脉Ⅴ段属支向上解剖,显露肝中静脉主干全程(图1D)。在肝中静脉Ⅴ段属支的下方找到右前叶肝蒂主干,在分叉处上方显露Ⅷ肝蒂并于根部结扎(图1E),标记缺血线(即S5/8、S7/8分界,图1F),向头侧继续离断肝中静脉Ⅷ段属支,全程显露肝中静脉,离断Ⅷ段肝蒂。沿缺血线(S5/8分界)自左离断肝实质至右肝静脉主干,再沿右肝静脉根部从头侧向尾侧离断肝实质,遇到肝右静脉的Ⅷd属支予以结扎离断(图1G),再沿下腔静脉的腹侧面、右肝静脉和肝中静脉主干之间完整切除Ⅷ段(图1H)。
用5-0 prolene线缝扎Ⅷ段肝蒂及肝静脉筛孔,麻醉医师通过升压、补液等手段升高中心静脉压,再次评估创面出血情况,对肝断面彻底止血、覆盖止血材料,留置引流管,将标本装入标本袋后经耻骨上横切口取出标本。
5. 术后处理
常规予护肝、护胃、补充白蛋白、抗感染及营养支持等处理。患者于术后6 h可进食流质饮食,24 h可下地活动。
三、观察指标
术中观察指标:手术时间、术中出血量、第一肝门阻斷时间。术后恢复评估指标:术后肝功能相关指标和凝血功能恢复情况、术后并发症情况、术后住院时间。随访:采用定期门诊复查和电话联系进行生存随访,定期进行影像学评估,随访截至2020年11月。
四、统计学处理
采用SPSS 22.0分析数据,符合正态分布的计量资料以描述,术前术后比较采用配对t检验;偏态分布的计量资料以中位数(下四分位数,上四分位数)表示,术前术后比较采用Wilcoxon符号秩和检验。P < 0.05为差异有统计学意义。
结果
一、一般情况
22例术程均顺利,无中转开腹或围术期死亡者,手术时间186(92,203) min,术中出血量100(50,200) ml,肿瘤大小为(6.2±2.3)cm,肝切缘宽度为(1.9±0.4)cm。术中对14例实施了Pringle法阻断入肝血流,肝血流阻断时间为(28±6)min。22例术后住院时间为(12.1± 2.2) d。22例术后病理检查均为肝细胞癌,肝切缘均阴性。
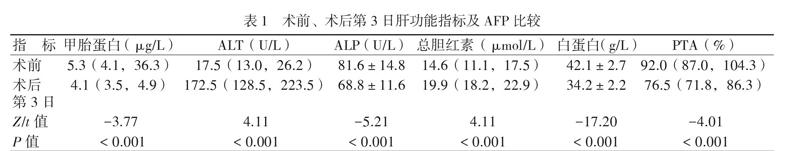
二、术前与术后第3日肝功能指标比较
与术前比较,22例术后第3日的ALT、总胆红素均上升,甲胎蛋白、ALP、PTA和白蛋白均下降(P均 < 0.05),见表1。术后第6 ~ 9日22例的肝功能指标均恢复至正常水平。
三、术后并发症
术后并发右侧少-中量胸腔积液8例,其中4例因气促行右侧胸腔穿刺引流。术区积液合并感染2例、胆漏1例,均行穿刺引流后治愈。Clavien-Dindo并发症分级系统分级Ⅰ、Ⅱ、Ⅲ(Ⅲa、Ⅲb)、Ⅳ、Ⅴ级并发症发生率分别为13.6%(3例)、4.5%(1例)、31.8%(7例)、0%、0%。
四、术后随访
22例随访时间为22(14,29)个月,均无死亡者。随访期间10例出现肝内局部复发,复发时间28(10,31)个月,予以介入、消融治疗。术后1年内复发率和3年内复发率分别为18.2%(4/22)、45.5%(10/22)。
讨论
有学者认为,解剖性肝切除应包括以下4步:首先对目标肝蒂行吲哚菁绿染色和选择性血流阻断来获取肝切面;循此边界进行肝实质切除;并在根部结扎目标肝段Glisson蒂;手术完成后要求肝断面暴露回流肝段的主干静脉[10]。同理,规范的解剖性肝Ⅷ段切除需要在根部结扎Ⅷ段腹侧支和背侧支的肝蒂,创面显露右肝静脉和肝中静脉根部及下腔静脉。目前腹腔镜解剖性肝Ⅷ段切除术的主流做法是以术中超声在肝表面定位肝中静脉和Ⅷ段肝蒂的方法,但要求术者具有较高的术中超声操作水平。由于Ⅷ段肝蒂深藏于肝实质内,位置较深,在极其有限空间中精准结扎所有肝蒂相对困难。
既往的解剖研究显示,右前叶肝蒂主干走行在胆囊床颈部深面、肝中静脉Ⅴ段属支的下方,与正中裂有交叉[11]。另外,Ⅷ段肝蒂被分为主干型和分支型,包括腹侧支、背侧支以及外侧支,术中可直接结扎肝蒂主干或将分支逐一结扎[12-13]。我们实施的腹腔镜经正中裂入路解剖性肝Ⅷ段切除术,能充分显露右前叶Glission蒂主干,明确结扎肝蒂根部Ⅷ段,特别是当Ⅷ段肝蒂属分支型时,可以有效地避免遗漏分支,从而进行更为精准的肝段切除。另一方面,预先鞘内解剖右前叶入肝管道,对右前叶行选择性区域血流阻断,对肝功能和胃肠功能影响小,本研究中的22例患者肝功能指标于术后第6 ~ 9日便可恢复正常,有助于术后快速康复,缩短了术后住院时间。与此同时,从尾侧入路劈开肝中裂可全程显露肝中静脉,再从头侧经肝静脉入路可显露右肝静脉,完全符合腹腔镜视角。
也有学者从肝下缘开始,自足侧沿半肝缺血线劈开肝实质,直接寻找肝中静脉的主干,但容易损伤肝静脉的属支,导致肝脏淤血,有时候甚至需要扩大切除范围。我们的经验是切除胆囊后,在胆囊床附近用超声刀缓慢切开肝实质,首先会遇到Ⅴ段回流至肝中静脉属支,自末梢支向主干方向逐渐寻根而上,找到肝中静脉的主干,肝中静脉右侧属支不断扎,然后在肝中静脉正上方切开肝实质,可避免损伤肝中静脉属支,预防亚肝段淤血的发生。在全程显露肝中静脉时,需要麻醉医师采用低中心静脉压技术以密切配合,否则肝静脉筛孔将发生大出血,在腹腔镜的有限空间内也不利于缝合。而且,经正中裂入路所遇肝内管道少,加之腹腔镜放大效应,切开肝实质后可精准结扎微小管道,大幅度降低术后出血和胆漏等并发症的发生率,本研究中的22例患者出血量较少、手术时间较短。
我们采用经正中裂入路相比头侧入路更不容易压迫到肿瘤,且选择性行右肝前叶区域阻断,降低了肝癌经门静脉转移的概率,而且22例患者的病灶切缘均为宽切缘(切缘超过1 cm),术后1年内复发率为18.2%,李自慧等[14]的回顾性研究显示解剖性肝切除术后的早期复发率为26.5%,相比之下本组22例患者的预后较好。然而,经正中裂入路创面偏大,需要术者熟练掌握腹腔镜肝切除技术,具备较强的损伤控制能力。
随着医学影像和数字医学的不断发展,肝外科医师可以充分准确地掌握肝内管道的走形和变异,另外术中超声的技巧不断被临床医师所掌握,再加上日益完善的肝切除技术、血管外科技术,腹腔镜肝Ⅷ段切除术在将来或会被广泛采用。针对合适的病例,术前做好充分的肝功能评估,依靠三维重建制定严谨的手术计划,掌握精准肝切除理念和拥有丰富腹腔镜肝切除经验的肝外科医师,是手术安全的保障。总之,现阶段实施腹腔镜解剖性肝Ⅷ段切除仍是一大挑战,我们采用的经正中裂入路方式,手术视野范围广,操作相对简单,手术效果尚可,用于肝癌患者具有一定的可行性。
参 考 文 献
[1] 梁伟强, 王猛.术前肝脏储备功能评估的最新研究进展.新医学,2019,50(4):229-233.
[2] Moris D, Tsilimigras DI, Kostakis ID, Ntanasis-Stathopoulos I, Shah KN, Felekouras E, Pawlik TM. Anatomic versus non-anatomic resection for hepatocellular carcinoma: a systematic review and meta-analysis. Eur J Surg Oncol,2018,44(7):927-938.
[3] Tan Y, Zhang W, Jiang L, Yang J, Yan L. Efficacy and safety of anatomic resection versus nonanatomic resection in patients with hepatocellular carcinoma: a systemic review and meta-analysis. PLoS One,2017,12(10):e0186930.
[4] 翟志超, 任為正, 刘志伟, 陈继业, 辛宪磊, 卢实春, 蔡守旺. 解剖性与非解剖性肝切除治疗原发性肝癌远期疗效的比较. 中华肝胆外科杂志, 2017, 23(11):771-775.
[5] 李相成, 江王杰. 解剖性肝切除的沿革. 外科理论与实践, 2020,25(1):20-24.
[6] 张成武.腹腔镜解剖性肝切除的若干进展.肝胆胰外科杂志,2020,32(3):129-132.
[7] Liu S, Liu X, Li X, Li O, Yi W, Khan J, Yang P, Guo C, Peng C, Jiang B. Application of laparoscopic radical resection for type Ⅲ and iv hilar cholangiocarcinoma treatment. Gastroenterol Res Pract, 2020,2020:1506275.
[8] Ome Y, Honda G, Doi M, Muto J, Seyama Y. Laparoscopic anatomic liver resection of segment 8 using intrahepatic glissonean approach. J Am Coll Surg,2020,230(3):e13-e20.
[9] Berardi G, Wakabayashi G, Igarashi K, Ozaki T, Toyota N, Tsuchiya A, Nishikawa K. Full laparoscopic anatomical segment 8 resection for hepatocellular carcinoma using the glissonian approach with indocyanine green dye fluorescence. Ann Surg Oncol,2019,26(8):2577-2578.
[10] Shindoh J, Makuuchi M, Matsuyama Y, Mise Y, Arita J, Sakamoto Y, Hasegawa K, Kokudo N. Complete removal of the tumor-bearing portal territory decreases local tumor recurrence and improves disease-specific survival of patients with hepa-tocellular carcinoma. J Hepatol,2016,64(3):594-600.
[11] 劉巧云, 马心逸, 喻智勇, 高则海, 蔡强, 侯丽莉. 肝右前叶Glisson系统的解剖结构特点及其临床意义. 中国临床解剖学杂志, 2015, 33(2):121-125.
[12] 陈继业, 蔡守旺. 解剖性肝S8段切除手术策略. 临床外科杂志, 2019,27(8):649-651.
[13] 王小军,曹利,李建伟,郑树国. 腹腔镜解剖性肝脏Ⅷ段切除术. 中华肝胆外科杂志, 2019, 25(2):135-136.
[14] 李自慧, 叶甲舟, 陈洁, 白涛, 吴宗权, 邹岭, 黄善坡, 黎乐群, 吴飞翔.解剖性肝切除术对合并微血管侵犯的肝癌患者早期复发的影响.中华肝胆外科杂志,2018,24(1):18-22.
(收稿日期:2020-12-12)
(本文编辑:洪悦民)
