慢性肾脏病患者亚临床甲状腺功能减退症的研究进展
2021-04-25谭妮石磊
谭 妮 石 磊
1.湖北民族大学医学部,湖北恩施 445000;2.湖北民族大学附属民大医院肾病内科,湖北恩施 445000
慢性肾脏病(chronic kidney disease,CKD)患者表现出多种内分泌和代谢紊乱,其中最常见的是在骨代谢上,引起慢性肾病矿物质代谢紊乱和骨异常及继发性甲状旁腺功能亢进;而另一种重要的内分泌紊乱为甲状腺功能减退症(简称“甲减”)。肾脏参与甲状腺素的生成、分泌及降解过程。因此,CKD 将可能影响下丘脑-垂体-甲状腺轴的任一水平,从而导致甲状腺功能异常。甲状腺素在肾脏生长、发育及维持其生理功能中发挥重要作用,甲状腺功能异常亦可影响肾功能。目前关于CKD 与低T3 综合征(low T3 syndrome,LT3S)之间的研究已被广泛关注。亚临床甲状腺功能减退症(subclinical hypothyroidism,SCH)在CKD 及终末期肾病(end-stage renal disease,ESRD)患者中亦较为普遍[1-3],但关于两者之间的研究相对较少,故本文拟就CKD 与SCH 之间的联系进行简要阐述。
1 CKD患者SCH的患病率调查
SCH 为CKD患者中较为常见的甲状腺功能紊乱,其特征是促甲状腺激素(thyroid-stimulating hor mone,TSH)水平升高,游离三碘甲状腺原氨酸(free triiodothyronine,FT3)和游离甲状腺素(free thyroxine,FT4)水平基本正常,在普通人群中,SCH 患病率为5%~10%[4]。流行病学调查研究表明,非透析CKD、血液透析(hemodialysis,HD)和腹膜透析(peritoneal dialysis,PD)患者中SCH的患病率较其他非CKD患者显著升高[1,5-7],但甲状腺功能亢进症的患病率与普通人群相似[8]。
在第三次全国健康与营养检查调查的14 623名参与者中发现,随着估算肾小球滤过率(estimatedglomerular filtration rate,eGFR)下降程度的增加,甲减的患病率逐渐升高:eGFR≥90、45~59 和<30 mL/(min·1.73 m2)的甲减患病率分别为5%、20%和23%[8]。即使考虑年龄、性别和种族/民族的差异之后,与eGFR≥90 mL/(min·1.73 m2)的患者相比,eGFR<30 mL/(min·1.73 m2)的患者患甲减的风险也要高出两倍。在最近一项关于461 607例处于CKD 3~5期的美国退伍军人的研究中发现,23%的患者患有甲减,且eGFR 每降低10 mL/(min·1.73 m2),甲减的风险增加18%[9]。而在这些研究中,很大一部分病例为SCH。在对意大利3089名成年人的研究中也发现,肾功能水平越低,SCH的患病率越高:eGFR≥90 mL/(min·1.73 m2)和<60 mL/(min·1.73 m2) 的SCH 患病率分别为7%和18%[10]。虽然在CKD患者中有关SCH的研究相对较少,但也有类似的高发病率报道,故将近年来有关CKD患者SCH的患病率做一总结(表1),以了解CKD患者SCH的患病情况。
2 甲状腺功能障碍和肾脏疾病之间的潜在双向联系
2.1 CKD导致甲状腺功能紊乱
CKD导致甲状腺功能紊乱的机制目前尚未完全明确,可能与以下改变有关:①肾脏通过T4-5′-脱碘酶亚型D1 的局部脱碘作用参与T3 的产生[16],肾功能不全时,T4-5′-脱碘酶活性降低,T4 经外环脱碘向T3转化的途径减弱。SCH的患病率随CKD 加重而增加,可能是由于T4-5′-脱碘酶活性降低所致[10]。②肾功能不全时,肾脏排泄能力降低引起的碘清除和滞留障碍,通过Wolff-Chaikoff 效应导致甲减。③CKD患者体内蓄积的肌酐、尿素氮、酚类等物质可抑制T4 与蛋白相结合,从而引起T4 下降,导致甲减[17]。④由于循环中的甲状腺素绝大多数与蛋白质结合,有研究认为CKD患者大量蛋白的丢失可能导致全身甲状腺素的耗竭。如肾病综合征患者[18]及PD患者[5]大量蛋白的丢失都可能导致甲状腺功能障碍。⑤硒可通过控制甲状腺素脱碘酶活性调节外周T4 转化为T3,而透析患者常发生硒缺乏,可能导致自身免疫性甲状腺疾病加重[19]。⑥在晚期CKD 尿毒症环境中发生的代谢性酸中毒也可能导致甲状腺功能紊乱[20]。
2.2 甲减影响肾功能
甲减亦可影响CKD患者的肾功能,导致CKD患者肾功能进一步受损及肾脏结构改变,其机制尚未完全明确,但可能与以下几点有关:①在CKD患者中,甲减可通过改变血流动力学,直接加重肾功能损伤。甲减可导致心输出量减少,外周血管阻力增加,肾内血管收缩可导致肾血流减少,易造成肾前损伤。②甲减直接影响(如肾素基因表达降低)和间接影响(如平均动脉压升高)导致肾素-血管紧张素-醛固酮活性降低,从而导致肾功能进一步受损[21]。③甲减也可能对肾脏结构产生不良影响。动物实验表明,甲减与肾体重比、肾小管质量减少以及肾小球结构的不良改变有关(如肾小球体积和面积减少,肾小球基底膜增厚,肾小球系膜基质扩张)[22]。④甲减可导致eGFR 下降从而加速CKD 进展。在动物研究中发现,甲减可降低eGFR、肾血浆流量和肾小球经乳头静水压力[4]。临床病例亦可观察到,严重甲状腺功能低下的患者肾血浆流量和eGFR 均有所减少[23]。
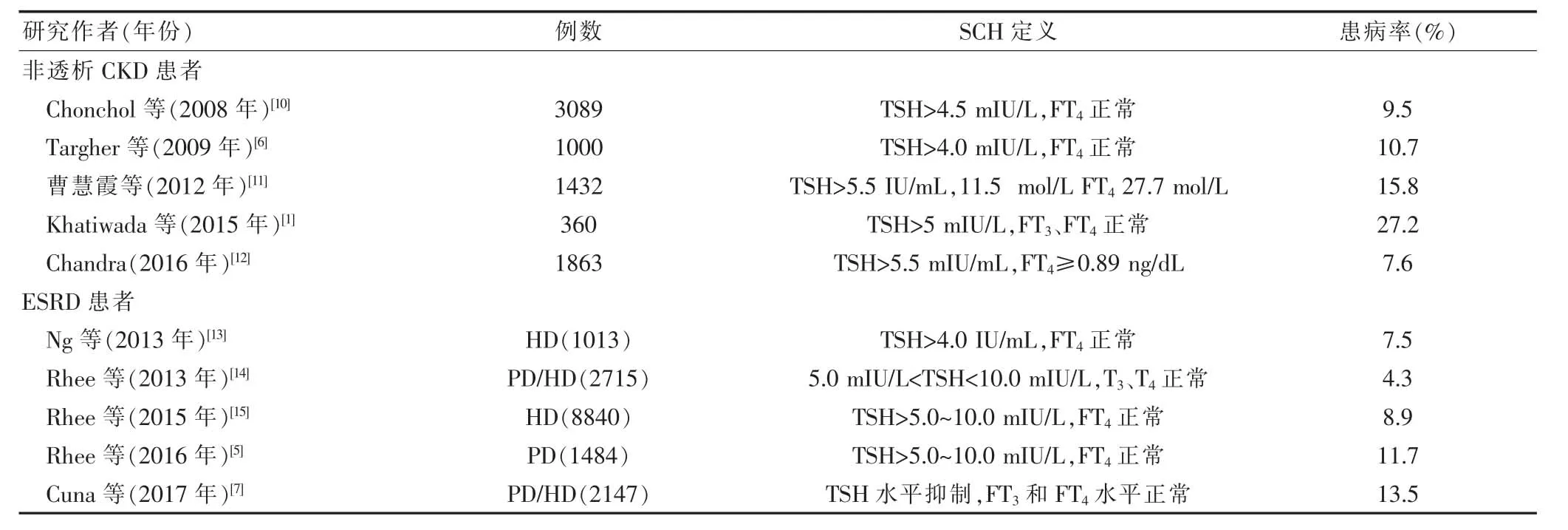
表1 CKD患者中SCH 患病率的调查
3 CKD患者甲状腺功能障碍的治疗
心血管疾病是CKD 最常见的并发症,也是CKD患者不良预后的主要原因[24]。考虑CKD 和ESRD患者过度的冠心病、心力衰竭和心血管死亡率,可以合理地认为SCH的心血管后遗症可能被放大。越来越多的证据表明,在CKD 人群中,甲减和SCH 与较高的死亡风险[15]、心血管疾病相关[5,25-26]。有研究指出,CKD患者中SCH 与血脂代谢、心功能不全及内皮功能紊乱等相关[27-28],而这些因素均可导致心血管疾病,故SCH 也可能成为CKD 及ESRD患者心血管疾病的危险因素。
引起ESRD患者死亡的主要原因为心血管疾病,人们越来越关注甲减作为心血管疾病中一个未被充分认识的危险因素,对于其治疗也成为关注的重点。甲状腺素是非透析CKD 及ESRD患者最常用的处方药之一,但甲状腺素替代治疗对于CKD患者甲状腺功能障碍的相关研究有限,治疗效果尚不清楚。
Shin 等[29]对180例SCH 合并CKD 2~4期患者进行甲状腺素治疗的研究中发现,在平均(34.8±24.3)个月的随访期间,没有接受甲状腺素替代治疗的患者eGFR 总体下降率明显高于治疗组,且甲状腺素替代治疗是肾脏预后的独立预测因子,表明甲状腺素治疗不仅能更好地保留肾功能,也是CKD患者肾脏转归的独立预测因子。Bajaj 等[30]对CKD(糖尿病和非糖尿病)患者进行甲状腺功能筛查,对甲状腺功能低下者行甲状腺素替代治疗3~6个月后发现eGFR 显著增加,值得注意的是经6个月治疗后,非糖尿病性CKD患者eGFR 增加量明显高于糖尿病性CKD患者,而3个月时两者无显著差异,表明甲状腺素替代治疗可改善CKD患者的肾功能。Tang 等[31]在左甲状腺素对CKD 3~4期患者营养状况的影响研究中表明,左甲状腺素治疗可以延缓肾脏疾病的进展,对CKD 3期患者具有更高的疗效。Deng 等[32]在分析156例CKD 3~4期患者合并甲减的营养不良情况时,发现经甲状腺素治疗后CKD患者的营养不良情况 (血清白蛋白水平、血红蛋白水平、左手握力)可得到部分改善。
尽管这些有限的数据表明甲状腺素替代治疗有益,但需要指出的是,甲状腺素补充有一个潜在的狭窄的治疗-毒性窗口,理论上存在蛋白质能量消耗、心血管事件和骨丢失的风险[33]。因此,关于外源性甲状腺素补充在CKD患者甲状腺功能障碍中的安全性和有效性,需要严格的纵向研究、未来更大样本量和延长随访期的随机对照试验来提供的更为明确的信息。
4 总结
CKD患者常伴随甲状腺功能紊乱,以SCH 和LT3S常见,其中SCH 患病率为7.6%~27.2%。关于肾脏疾病与甲状腺功能之间的相互关系,仍有许多知识空白,需进一步的研究以了解CKD患者甲状腺功能障碍的发病机制。目前现有的临床实践指南缺乏对CKD患者甲状腺功能障碍的筛查建议,但考虑到CKD患者SCH 可通过影响血脂代谢、心功能障碍等引起不良心血管疾病,并导致更高的死亡风险,故建议临床医师对于CKD患者,尤其老年患者进行定期的甲状腺功能筛查,早期识别甲状腺功能紊乱。
