早期动脉粥样硬化形成的数值计算
2021-04-25刘亚涛胡继文刘文一雷卫瑞陈学坤
刘亚涛, 胡继文, 刘文一, 雷卫瑞, 陈学坤
(南华大学 数理学院,湖南 衡阳 421001)
引言
与动脉粥样硬化(AS)相关的心、脑血管疾病是世界范围内死亡率最高的疾病[1],因此对AS的发病机制和动脉硬化斑块的演化问题研究受到了医学界的广泛关注。通常认为,AS是动脉内膜因炎症而引起的脂肪沉积的一种血管疾病[2]。内膜是血液与动脉壁接触的第一层,是最先、也最容易感染受损的一层组织。内膜损伤部位通常会聚集低密度脂蛋白(LDL)、单核细胞(SC)、巨噬细胞(MC)和富含脂肪的泡沫细胞(FC),这个过程被称为AS斑块的形成[3]。脂类物质沉积的生长将导致管腔变窄、管壁弹性缺失,引起动脉血流量减少,从而触发诸如心、脑梗塞等常见的心血管疾病。许多研究者从实验[4]或理论计算等[5]角度去研究AS斑块形成过程中不同生化物质间的相互作用的病理学机理。Cobbold等人[6]和Rhman[7]等人借助体外实验结果,重点计算了LDL胆固醇的氧化过程。Fok提出了内膜增厚的数学模型[8]:将内膜作为一个自由边界,导致细胞因子的释放和平滑肌细胞(SMCs)的迁移。Ougrinovskaia等使用常微分方程(ODE)模型得到了动脉粥样硬化早期巨噬细胞不同受体对胆固醇的摄取情况。Chang和Vafai[9]基于微观结构原理,利用孔隙理论和纤维基质模型,并考虑了LDL的转运,获得了动脉粥样硬化斑块的形成过程中设计的一些生物物理机制。
综合前述研究的实验和理论模型,结合影响AS产生和形成重要脂质成份,本文提出了一个对流-扩散-反应计算模型[3,10]。该模型的主要成分包括低密度脂蛋白(LDL)、泡沫细胞(FC)、氧化的低密度脂蛋白(LDLox)等,通过耦合生物壁面的多孔效应,利用有限元法,计算了生物大分子在损伤部位的粘附、扩散过程,并与内膜中的相关趋化因子等物质发生生化反应,引起的各物质的浓度变化和浓度扩散。本文重点研究了LDL、LDLox及FC在血压120mmHg、150mmHg和180mmHg下的扩散反应浓度之间的差异,以及它们扩散的二维演化图。另外,我们计算了感染区血管半径及斑块的体积,分析了120mmHg血压下内膜损伤部位36个月内动脉管腔半径的变化和斑块的体积增长状态,定量描述了AS形成进度及变化特征。
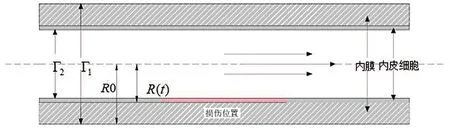
图1 腔内血流示意图。图中三条紫色平行线表示血流方向,内膜和内皮区域均已在图中显示,粉色区域即是内皮层损伤部位,R(t)表示管腔半径,R0表示动脉血管的半径。Fig.1 Diagram of intracavitary blood flow.The three purple parallel lines in the figure represent the direction of blood flow;both the intima and endothelial regions have been shown in the figure;the pink region is the damaged area of the endodermis;R(t) is the radius of lumen;and R0 is the radius of artery.
1 模型和方法
考虑局部损伤的区域中各物质成份的扩散反应及病变区域斑块的生长,建立如图1所示的几何模型。
1.1 计算模型
依据早期动脉粥样硬化形成机制[11],建立了一个由主要七种成份物质的计算模型:低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、巨噬细胞(M)、泡沫细胞(F)、氧化的低密度脂蛋白(LDLox)、化学引诱剂(P,通常为MCP-1型)、ES细胞因子(Q,通常为TNFα型)。其中,每一个变量成份都是时间t和位置(x,y)的函数,即由7个偏微分方程构成的对流-扩散-反应方程组[3,10]如下:
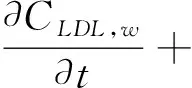
(1)
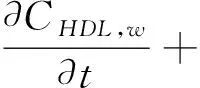
(2)
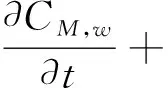
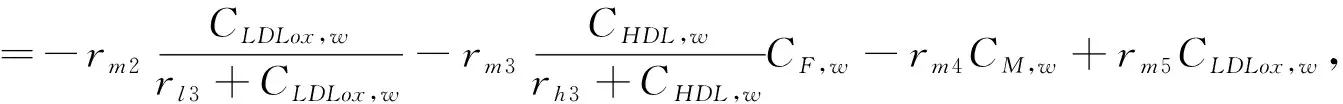
(3)
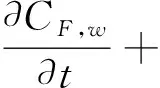
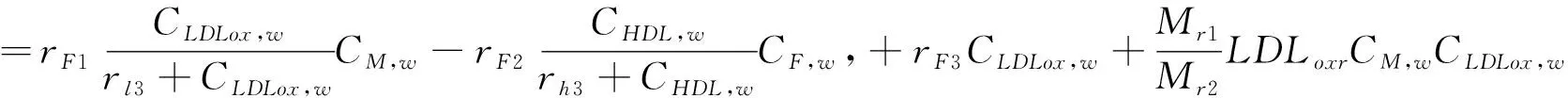
(4)
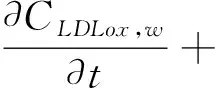
(5)
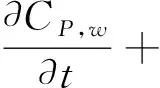
(6)
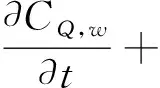
(7)
在方程(1-7)中,等号左边的项表示各物质浓度的对流与扩散。等号右边的项表示各物质的反应状态,系数表示反应动力学常数[11]。(为方便,下面表述均针对等号右边项)在方程(1)中表示 LDL的氧化形成。方程(2)中第一项表示通过反向胆固醇转运从泡沫细胞中吸收HDL的损失,第二项表示HDL的其他损失。方程(3)第一项表示巨噬细胞转化为泡沫细胞的速率,第二项表示泡沫细胞RCT(逆向胆固醇运输)巨噬细胞池的速率,第三项表示巨噬细胞的死亡和分化,最后是巨噬细胞的增加速率。方程(4)第一项表示巨噬细胞向泡沫细胞转化的速率,第二项表示泡沫细胞进行RCT并返回炎性巨噬细胞池的速率。第三项表示巨噬细胞的凋亡,最后是LDLox氧化增加。方程(5)首项表示LDL的氧化,其次是巨噬细胞对LDLox的摄取。方程(6)第一项是由巨噬细胞消耗LDLox促使化学引诱剂的产生速率,第二项表示化学引诱剂P的损失。方程(7)第一项是增加巨噬细胞产生ES细胞因子的速率,第二项为ES细胞因子在内膜内的损失。
在二维域Ω⊂R2中,且 Ω={(x,y),0≤x≤L,0≤y≤2R0},其边界条件如下:
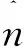
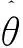
LDL(x,y,0)=L0,h(x,y,0)=h0,P(x,y,0)=0,F(x,y,0)=0,M(x,y,0)=0,LDLox(x,y,0)=0,Q(x,y,0)=0
为描述流体流动,血流动力学方程表述如下:
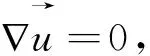
(8)
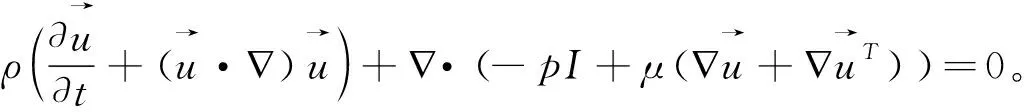
(9)
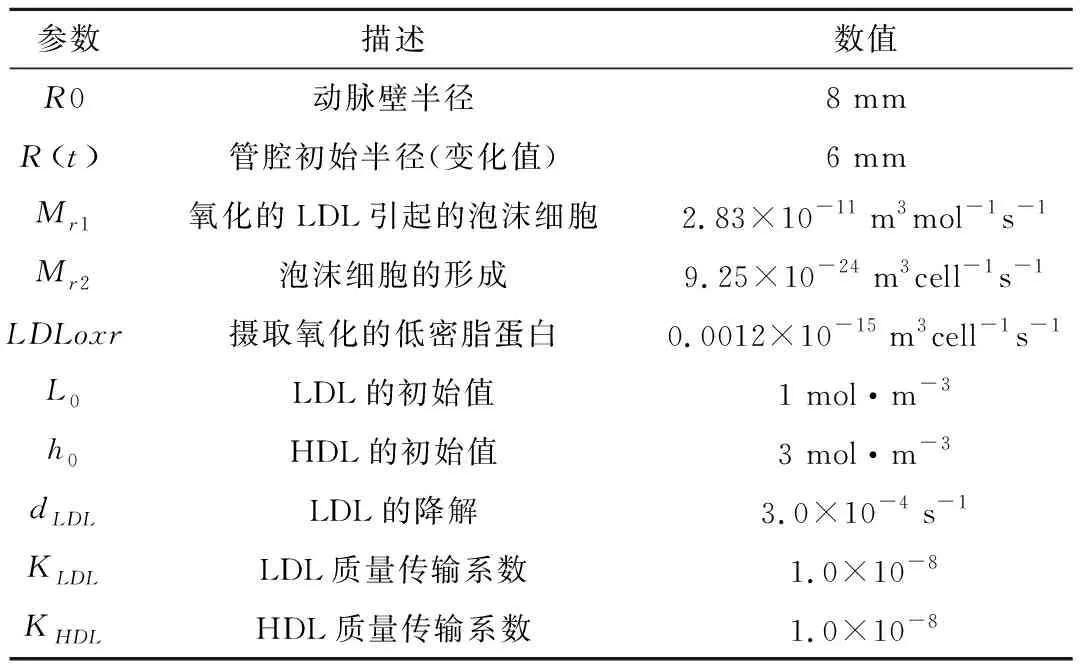
表1 与模型相关的参数
1.2 血管半径和斑块体积
假设血流为不可压缩流体,这意味着通过动脉壁的流量Q是恒定的[12]。由方程(1-7),我们计算出各物质成分的浓度分布,由此引起损伤部位反应物质的累积效应,导致动脉粥样硬化的发生和血管内管腔狭窄。我们定义病变区域管腔半径的变化和体积增长的动力学方程为如下形式[12]:
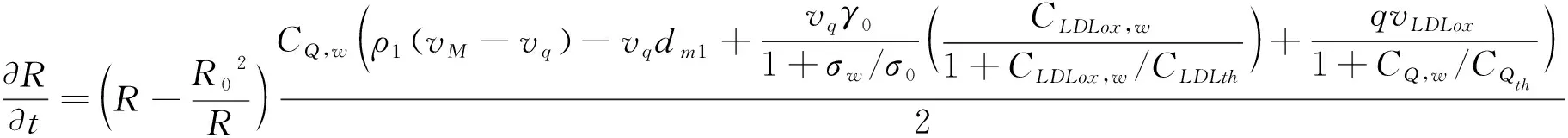
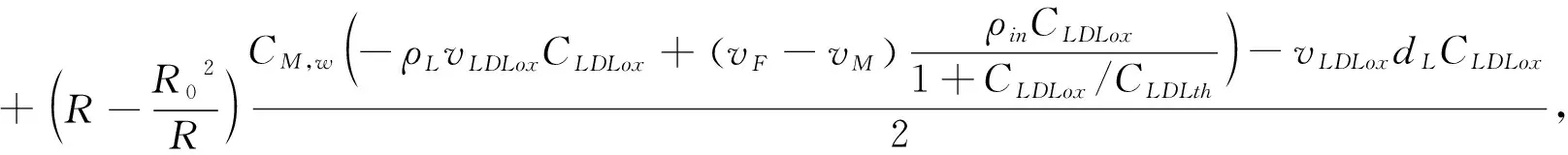
(10)
V(t)=-lpπ(R2(t)-R20)
(11)
方程(10)和(11)中涉及的参数含义及对应值如表2所示。
2 数值结果和分析
假设动脉管腔的半径为6mm,血管内壁存在局部损伤区,假定损伤区域的长度为10mm,这是基于斑块影像学测量数据而设定[13]。由对流-扩散-反应方程及血流动力学方程,根据有限元法,建立有限元矩阵方程,对整个区域进行网格划分。使用单位大小的自由三角形网格划分模型:血管壁由2079个网状顶点和3911个三角形单元组成,血液包含 3056个顶点和5851个三角形单元。利用方程(1-7)及表1中的参数计算了从0到36个月内的物质浓度演化,重点讨论了LDL、LDLox、FC三种物质成份在180mmHg、150mmHg和120mmHg下沿深度方向的反应值,及其管腔的半径变化和斑块的体积增长。
2.1 LDL浓度分布
图2给出了低密度脂蛋白(LDL)在内膜损伤处36个月内的反应—扩散结果,及在不同血压下LDL随深度方向的浓度变化特点。
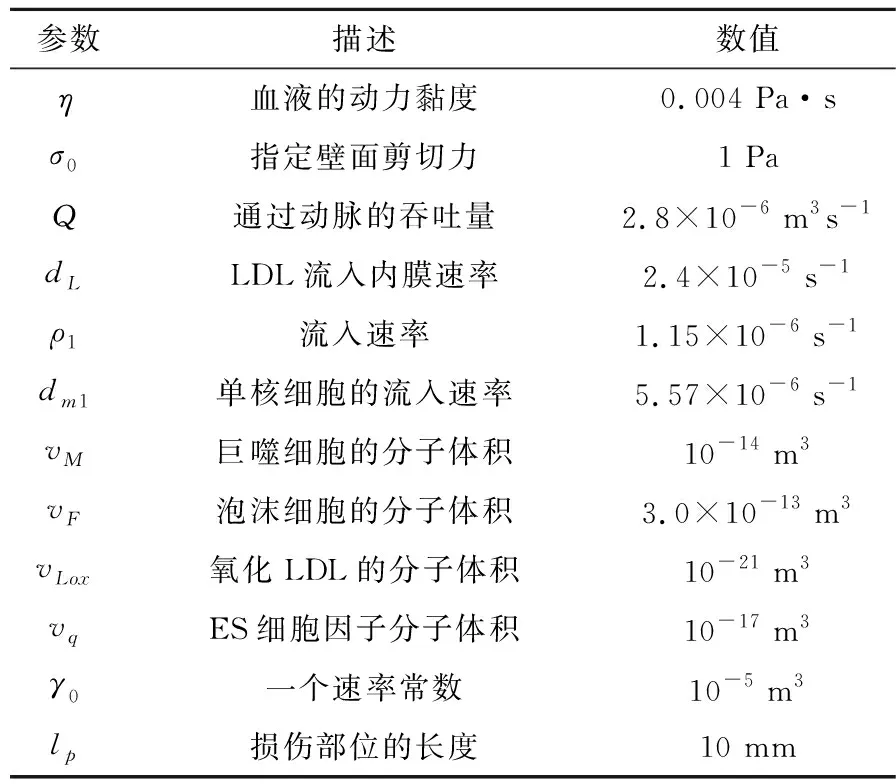
表2 体积增长模型相关参数
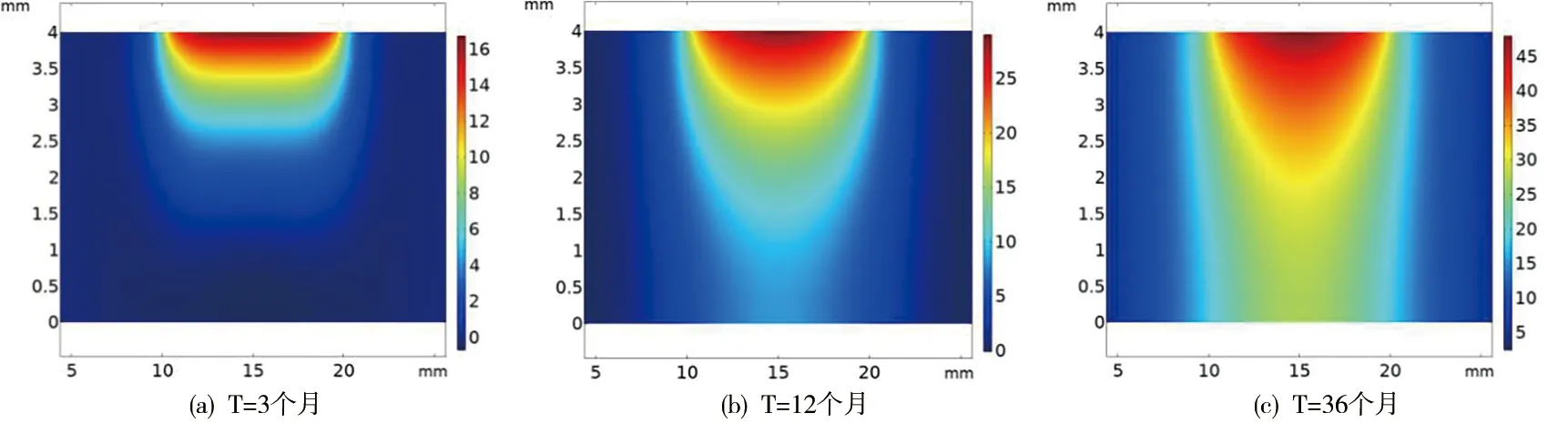
图2 120mmHg下不同时刻LDL反应浓度的二维云图
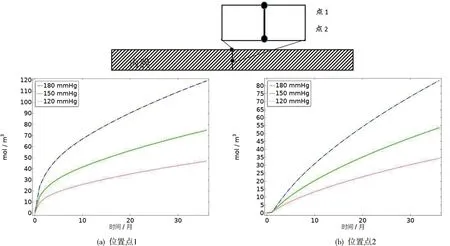
图3 表示LDL在不同血压下扩散浓度随时间的变化
从二维云图中我们可以看出,损伤部位浓度值最大,随着时间的延长,扩散的范围在水平和竖直方向都逐渐增大,而且容易发现在竖直方向上扩散的速度较水平方向快,这是由于在竖直方向上物质分子是由对流作用扩散,而在水平方向上,主要是依靠物质分子自身的浓度梯度扩散。图3给出了不同血压下LDL的反应后浓度沿深度方向的扩散结果。分析线图a和b可知,在位置点1,随着血压的增加(下同),LDL的浓度(单位:mol/m3)在36个月后分别达到了46.7、74.7和119.2,位置点2,36个月后LDL浓度值为34.3、53.5和83。比较a与b,随着损伤部位深度的增加,LDL的浓度变化会有减小趋势,这与二维云图中得到的结果是一致的。
2.2 LDLox浓度分布
与LDL类似,下图给出了氧化的低密度脂蛋白(LDLox)在内膜损伤处三年内的反应—扩散结果,及在不同血压下LDLox随深度方向的浓度变化特点如图4所示。
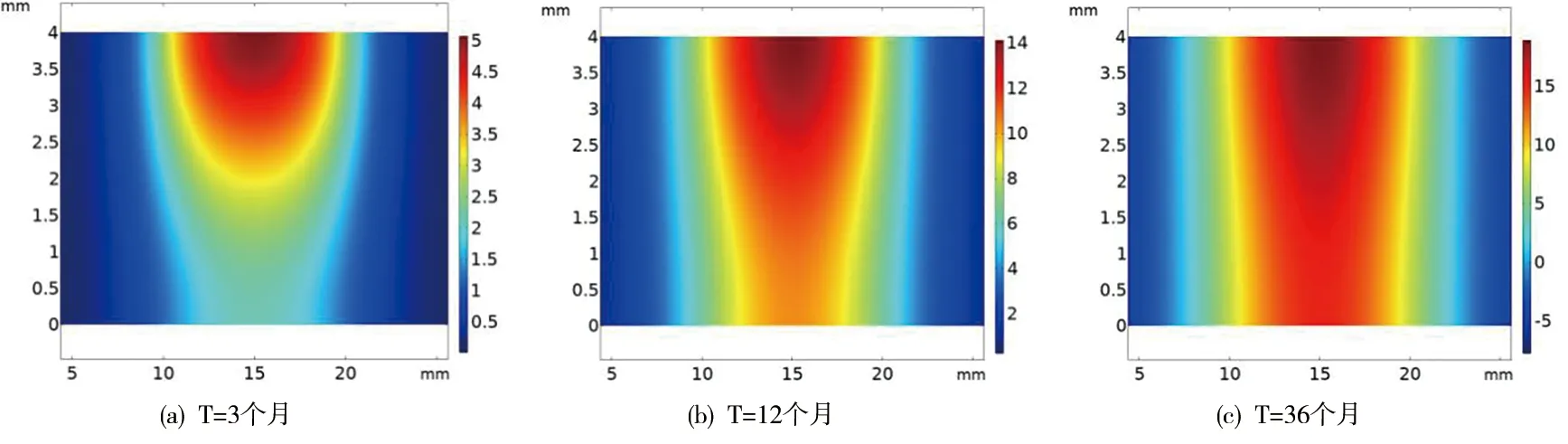
图4 120mmHg下不同时刻LDLox反应浓度的二维云图
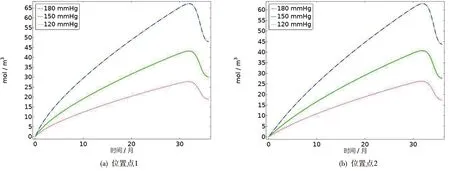
图5 表示LDLox在不同血压下扩散浓度随时间的变化
根据AS反应的机理,由于LDL的浸润,在内膜中被游离的自由基氧化变成LDLox。从二维云图看,随着LDL进入内膜在损伤部位不断被氧化,所以损伤部位LDLox的浓度值较其他位置更明显。从扩散程度看,在深度和水平方向的扩散范围相比于LDL有所增强。从图5中,我们得到了在不同血压下LDLox浓度值(单位:mol/m3)随时间经历了先升高后降低的过程,大约32个月时达到最大值。其最大值在位置点1分别为27.7、43.2和67.1,位置点2为26.3、40.7和62.8。与上述LDL比较可以得出,低密度脂蛋白进入内皮细胞后并非完全被氧化,存在一些游离态和凋亡损失,这也与一些医学解释相符合[14]。LDLox的反应浓度出现先增加再减小最后趋于稳定的变化状态,是由于随着氧化的持续发生,内膜中由单核细胞形成的巨噬细胞对LDLox的胞吞作用引起,使得LDLox呈现下降的趋势。最后随着时间的延长,反应的过程趋于缓慢,致使LDLox出现了相对稳定的状态。
2.3 FC浓度分布
最后,我们计算了泡沫细胞(FC)在内膜损伤处36个月时间内的反应—扩散结果,及在不同血压下FC随深度方向的浓度变化特点(如图6所示)。
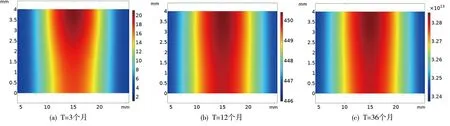
图6 120mmHg下不同时刻Foam cell反应浓度的二维云图
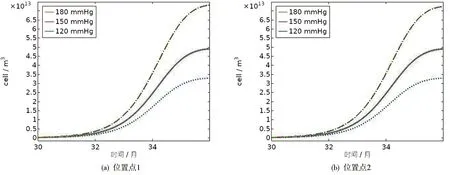
图7 表示Foam cell在不同血压下扩散浓度随时间的变化
二维云图表示泡沫细胞(FC)反应浓度的扩散,为了便于区分,我们截取了30-36个月的曲线变化,得到在位置点1泡沫细胞的浓度值(单位:cell/m3)分别为3.28×1013、4.9×1013、7.32×1013,位置点2有3.24×1013、4.84×1013、7.23×1013。与LDL、LDLox相比,泡沫细胞的浓度值较大。在动脉硬化中,脂质泡沫细胞的大量堆积,促使动脉斑块的形成。不同血压下浓度值的结果也表明,血压的增大,在一定程度上对动脉硬化的发生起促进作用。
2.4 管腔半径变化及斑块的体积增长
为了更好的展示损伤部位斑块的生长情况,我们结合上述方程(1-7)和方程(10-11)计算得到了如图8所示的管腔半径R(t)随时间的变化及斑块体积的增长情况。
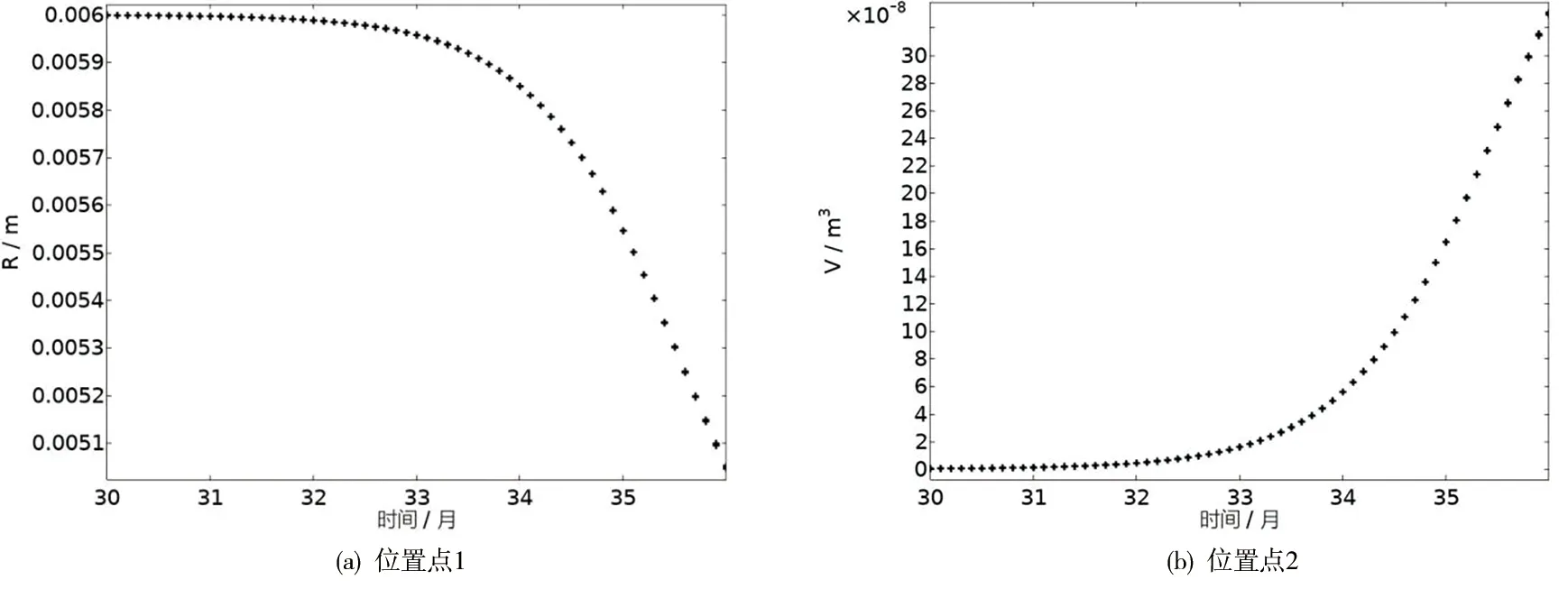
图8 管腔半径和斑块体积随时间的变化
从图8(a)可以看出,经过36个月的时间演化,损伤位置处管腔的半径从最初的6mm减小为趋于5mm的位置,得到了管腔狭窄的演化,更好的解释了斑块的生长过程。为了更精确得到斑块体积的增长,我们通过数值计算得出图8(b)中斑块体积的变化,最大体积约为334mm3(为便于观察,图中我们截取了后6个月的半径和体积的变化情况)。
3 结论
本文基于对流-扩散-反应动力学方程和多孔介质稀物质传递之间的耦合效应,利用有限元方法,计算了在不同血压下脂质类物质LDL、LDLox和Foam cell在内膜中随时间的扩散反应过程及分布特点,同时计算了病变区管腔半径的改变和动脉粥样硬化斑块的体积增长。得到了扩散浓度主要集中在病变区域,随深度增加浓度值逐渐减小。并通过不同血压下的比较,得到了血压引起的物质分子浓度值的改变。在一定程度上解释了血压对动脉粥样硬化的影响。最后,为了更好的解释斑块形成时,病变区域管腔半径和斑块体积的变化,我们通过计算得到损伤部位36个月后管腔半径减小1mm,斑块体积增长334mm3。由此可见,半径和体积的变化还是相对缓慢,说明动脉粥样硬化是一种慢性疾病,其斑块的形成需要一个长期的累积过程。
