动脉粥样硬化兔血清、外周血单核细胞、主动脉组织B7-H3、B7-H4表达变化及意义
2021-04-23李志乐韦秋宇言纬刘莉黄照河韦宝敏
李志乐,韦秋宇,言纬,刘莉,黄照河,韦宝敏
右江民族医学院附属医院,广西百色533000
动脉粥样硬化(AS)是心血管疾病的始动环节与病理基础,慢性炎症反应参与其发生发展的过程[1]。炎症反应过程中可释放细胞因子和炎症细胞,导致斑块破裂、血栓形成,从而参与了AS 的发生。白细胞介素1β(IL-1β)和γ-干扰素(IFN-γ)均是促进AS 发生发展的炎性因子[2-3],而白细胞介素10(IL-10)可通过抗炎及调控线粒体自噬发挥抑制AS 的作用[4]。B7-H3、B7-H4 是近年新发现的 B7 家族成员,作为负性协同刺激因子能抑制CD4+和CD8+T 淋巴细胞的活化与增殖[5-6]。目前,关于B7-H3、B7-H4 的生物学效应机制仍有争议,其在AS 发生发展中的炎症调节机制还有待进一步研究。2018年 9 月—2020 年 6 月,本研究观察了 AS 兔血清、外周血单核细胞、主动脉组织中协同刺激因子B7-H3、B7-H4 的表达变化,并分析其与IL-10、IL-1β、IFN-γ表达的关系,为探索B7-H3、B7-H4影响AS发生发展的相关机制提供依据。
1 材料与方法
1.1 材料 实验动物:成年健康新西兰大白兔20只,清洁级,雄性,3 月龄,体质量2.0~2.5 kg;实验动物许可证号:SCXK 桂2012-0003,购自右江民族医学院实验动物中心。主要药物及试剂:胆固醇购自安徽天启化工公司,蛋黄粉购自毫州市红日实业有限公司;ELISA 试剂盒购自武汉默沙克生物科技有限公司,TRIzol试剂盒购自美国Invitrigen 公司,逆转录试剂盒购自上海睿时生物科技有限公司,Real Master Mix试剂盒购自北京TIANGE公司。
1.2 动物分组、造模与标本获取 选取20 只成年健康雄性新西兰大白兔,采用随机数字表法分为AS组和对照组,各10 只。AS 组持续给予高脂饮食14周,对照组给予普通饮食14周,高脂饮食由3.0%胆固醇、8.5%蛋黄粉、8.5%猪油和80%普通动物饲料制成。实验前后0周、14周采集兔耳缘静脉血,14周末处死并留取主动脉,部分行主动脉病理检测,剩余置于液氮中行PCR检测。
1.3 血脂水平检测 两组分组处理前(0周)和分组处理14周末,在空腹情况下,分别采集兔耳缘静脉血2 mL,静置30 min后3 000 r/min离心15 min,分离血清。采用7170 型全自动生化分析仪检测血脂水平,包括总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)。
1.4 主动脉形态及病理观察 采用HE 染色。两组分组处理14 周末,采集耳缘静脉血后进行处死。分离兔主动脉弓起始处至胸主动脉段,生理盐水冲洗并分离主动脉,剪取同一部位0.5~1.0 cm 长的血管段,置于10%缓冲甲醛液中固定24 h,石蜡包埋,剩余置于液氮中保存备用。取石蜡标本,血管横断面连续切片,厚度约为5µm,常规进行HE 染色。DMR+550 型病理图像分析仪测定粥样斑块最大横截面积、主动脉横截面积和内膜厚度,斑块面积比=粥样斑块最大横截面积/主动脉横截面积×100%。将剩余的主动脉从背侧面纵行正中线剪开、铺平,用NIKON100 对铺平的主动脉进行摄像,将照片输入计算机,观察脂质条纹、斑块破裂及血栓形成等病理情况。
1.5 血清炎性因子及sB7-H3、sB7-H4水平检测 采用ELISA 法。取1.3 中分离的血清,按照ELISA 试剂盒说明书进行操作,检测两组血清炎性因子IL-1β、IFN-γ、IL-10及sB7-H3、sB7-H4水平。
1.6 外周血单核细胞与主动脉组织B7-H3、B7-H4 mRNA表达检测 采用实时荧光定量PCR法。两组分组处理14周末,采用密度梯度离心法分离外周血单核细胞。取两组外周血单核细胞及液氮冻存的主动脉组织,采用TRIzol 法提取总RNA,测定260、280 nm 处的光密度值及其完整性,逆转录合成cDNA。采用ABI7500 实时荧光定量PCR 仪进行PCR 反应。B7-H3、B7-H4 及内参 β-actin 引物序列见表1。PCR反应条件:95 ℃预变性 2 min;95 ℃、15 s,58 ℃、15 s,68 ℃、31 s,共 45 个循环扩增。采用 2-ΔΔCt法计算B7-H3、B7-H4 mRNA相对表达量。

表1 B7-H3、B7-H4及内参β-actin引物序列及扩增长度
1.7 统计学方法 采用SPSS23.0 统计软件。计量资料以-x±s表示,结果比较采用t检验;血清sB7-H3、sB7-H4 与 IL-1β、IFN-γ、IL-10 的关系采用Pearson相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组兔不同时间点血脂水平比较 见表2。
表2 两组兔不同时间点血脂水平比较(mmol/L,±s)
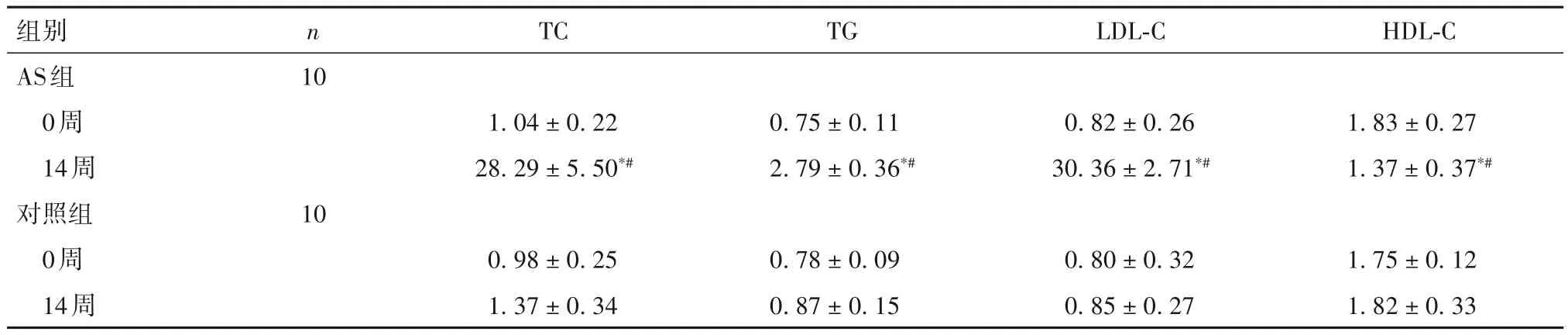
表2 两组兔不同时间点血脂水平比较(mmol/L,±s)
注:与同组0周比较,*P<0.05;与对照组同时间点比较,#P<0.05。
组别AS组0周14周对照组0周14周n 10 10 TC 1.04±0.22 28.29±5.50*#0.98±0.25 1.37±0.34 TG 0.75±0.11 2.79±0.36*#0.78±0.09 0.87±0.15 LDL-C 0.82±0.26 30.36±2.71*#0.80±0.32 0.85±0.27 HDL-C 1.83±0.27 1.37±0.37*#1.75±0.12 1.82±0.33
2.2 两组兔主动脉形态及病理比较 ①主动脉形态:对照组兔主动脉内膜光滑、平坦、完整。AS组兔主动脉病灶呈弥漫性、颗粒状及息肉状,甚至不规则改变,较严重者斑块融合成片,可见脂样物质突出管腔,边缘粗糙。②主动脉病理改变:对照组兔主动脉壁结构清晰,内膜、中膜及外膜组织结构正常,光滑完整。AS 组主动脉内膜明显增生增厚,血管内膜下可见泡沫细胞与脂质沉积,形成粥样脂质斑块,局部钙化,中膜平滑肌细胞增生,呈典型AS 病理改变。AS 组兔斑块面积比 为 66.82% ± 15.45%、内 膜 厚 度(86.02 ±12.32)µm,对照组分别为 0、(8.12 ± 3.85)µm;两组比较P均<0.05。
2.3 两组兔血清 IL-1β、IFN-γ、IL-10 及 sB7-H3、sB7-H4水平比较 14周时,AS组兔血清IL-1β、IFN-γ 水平均高于同组0周及对照组同时间点,而IL-10、sB7-H3 及sB7-H4 水平均低于同组0 周及对照组同时间点(P均<0.05)。见表3。
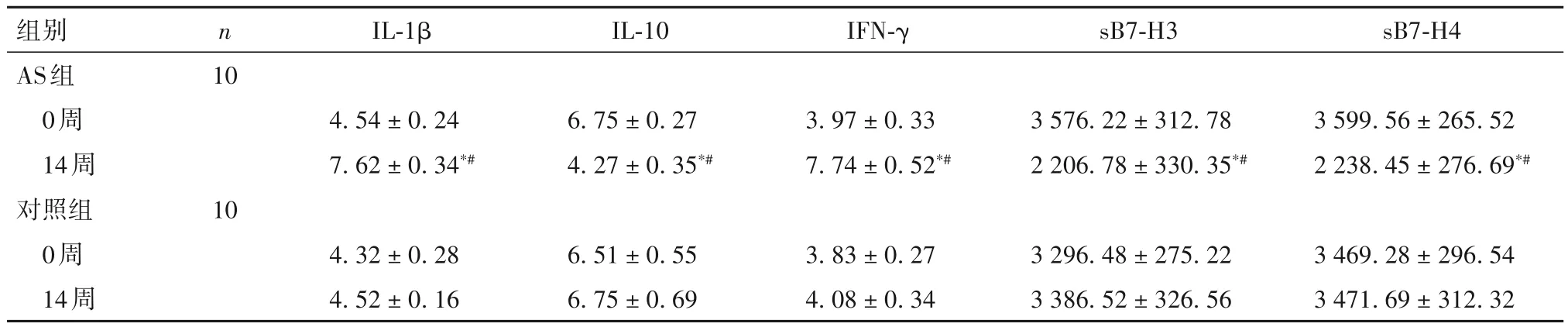
表3 两组兔血清IL-1β、IFN-γ、IL-10及sB7-H3、sB7-H4水平比较(ng/L,-x± s)
2.4 两组兔外周血单核细胞与主动脉组织B7-H3、 B7-H4 mRNA表达比较 见表4。
表4 两组兔外周血单核细胞与主动脉组织B7-H3、B7-H4 mRNA表达比较(±s)

表4 两组兔外周血单核细胞与主动脉组织B7-H3、B7-H4 mRNA表达比较(±s)
注:与对照组比较,*P<0.05。
组别AS组对照组n 10 10 B7-H3单核细胞0.533±0.182*0.958±0.206主动脉0.516±0.165*0.899±0.192 B7-H4单核细胞0.612±0.204*0.983±0.175主动脉0.497±0.216*0.862±0.163
2.5 血清B7-H3、B7-H4 与IL-1β、IFN-γ、IL-10 的相关性分析结果 血清sB7-H3与IL-1β、IFN-γ 均呈负相关关系(r分别为-0.554、-0.534,P均<0.05),与IL-10 呈正相关关系(r=0.692,P<0.05)。血清sB7-H4 与 IL-1β、IFN- γ 均 呈 负 相 关 关 系(r分 别为-0.485、-0.466,P均<0.05),与IL-10 呈正相关关系(r=0.676,P<0.05)。
3 讨论
目前认为,AS是一种以剧烈的免疫活动为特征的慢性炎症性疾病,由单核细胞、巨噬细胞、T 细胞等多种免疫细胞参与,因此炎症免疫反应在AS的发生、发展中发挥重要作用[7]。研究发现,自身免疫性疾病可导致心血管疾病的发病率和病死率增加,系统性红斑狼疮患者颈动脉粥样硬化发病率约为健康对照组的2 倍,这可能与免疫功能失调和慢性炎症等因素有关[8-9]。CD4+T 细胞诱导的抗原特异性免疫反应是近年来AS 炎症反应机制中的一个研究热点。B7 家族是免疫球蛋白超家族,B7-H3 是新发现的B7家族成员,与慢性炎症性疾病的发生发展密切相关,在高血压合并颈AS 患者中呈高表达[10]。B7-H4 是另一个新发现的B7 家族成员,能抑制CD4+和CD8+T 细胞增殖,减少炎性因子产生,进而负性调控T淋巴细胞的免疫应答[11-12]。目前,协同刺激分子B7-H3、B7-H4在免疫调节方面的生物学功能已经成为当今研究的热点,但其在AS炎症反应中的作用鲜见报道。
本研究对大白兔给予高脂饮食14 周后,AS 组兔血清TC、TG 及LDL-C水平较同组0周及对照组同时间点均明显升高,而HDL-C 水平显著低于同组0周及对照组同时间点;在主动脉形态学方面,AS 组兔主动脉病灶呈弥漫性,呈灰白色颗粒状、息肉状、不规则或椭圆形,较严重者斑块融合成片,可见脂样物质突出管腔,边缘粗糙;在主动脉病理学方面,AS组兔主动脉内膜明显增生增厚,血管内膜下可见泡沫细胞与脂质沉积,形成粥样脂质斑块,局部钙化,中膜平滑肌细胞增生,呈典型AS 的病理改变;且AS组兔主动脉内膜厚度与粥样斑块面积比均明显高于对照组,证实成功构建AS兔模型。
既往研究表明,IL-10 作为抗AS 的炎性因子,由Th2 细胞分泌,可抑制巨噬细胞释放炎症介质,具有逆转与稳定AS斑块的作用[13]。另有研究发现,人类抗原呈递细胞中B7-H4 表达显著增强,是通过IL-10自分泌的方式刺激导致的,提示IL-10 参与上调B7-H4 表达[14];同时,B7-H3、B7-H4 也可通过促进 IL-10分泌的方式抑制炎症反应[15]。这提示在AS 进展过程中,B7-H3、B7-H4可能通过促进IL-10分泌介导抗AS 炎症反应。IL-1β、IFN-γ 均是参与介导体液免疫反应而促进AS 进展的炎性因子,主要由巨噬细胞、中性粒细胞和内皮细胞产生,通过炎症小体的组装介导 Caspase-1 激活,从而调控炎症反应[16-17]。动物实验表明,B7-H3可抑制IL-1β、IFN-γ 等炎性因子的分泌与激活,而IL-1β、IFN-γ 在 B7-H4-/-小鼠中的表达明显升高。临床研究表明,抑制IL-1β 表达可治疗多种慢性炎症性疾病,表明IL-1β 可作为临床上AS 抗炎治疗的潜在靶点[18]。本研究结果显示,AS组14 周兔血清sB7-H3、sB7-H4 水平及外周血单核细胞和主动脉B7-H3、B7-H4 mRNA 表达较对照组均明显下降,而血清IL-1β、IFN-γ 水平上调,进一步行Pearson 相关分析结果显示,血清sB7-H3、sB7-H4分别与IL-1β、IFN-γ 呈负相关关系。由此我们推测,B7-H3、B7-H4可能通过介导抑制IL-1β、IFN-γ表达来抗AS 炎症反应,而IL-10 可抑制T淋巴细胞凋亡,减少IL-1β、IFN-γ 等炎性因子的分泌,抑制炎性反应,减轻炎症对血管的损伤。协同刺激因子B7-H3、B7-H4 在AS 炎症反应过程中起到中枢调节作用,可能通过促进 IL-10 分泌及抑制IL-1β、IFN-γ 表达,以减轻AS炎症反应,为AS炎性反应中的保护性因子。
综上所述,AS兔血清、外周血单核细胞、主动脉组织协同刺激分子B7-H3、B7-H4 表达均降低,B7-H3、B7-H4 可减轻AS 炎症反应,其机制可能与促进IL-10分泌及抑制IL-1β、IFN-γ表达有关,B7-H3、B7-H4有望成为AS防治的新靶点。
