玉米醇溶蛋白-葡萄糖美拉德反应产物制备姜黄素纳米颗粒
2021-04-22黄国清肖军霞
董 潇,黄国清,肖军霞
(青岛农业大学食品科学与工程学院 山东青岛266109)
姜黄素(curcumin)是从姜科姜黄属植物姜黄(Curcumin longa)中提取的一种天然酚类色素,具有无毒、无害的特点[1]。随着对姜黄素研究的深入,发现其具有抗炎、抗氧化、调脂、抗病毒、抗感染、抗肿瘤、抗凝、抗肝纤维化、抗动脉粥样硬化等广泛的药理活性,且毒性低,不良反应小[2]。人体临床试验表明,姜黄素以相对较高的水平摄入(8 g/d,持续8 周),不会对健康产生不良影响,这表明它作为营养保健品是安全的[3]。然而,姜黄素作为功能性食品和饮料中的营养保健成分使用时,因化学不稳定性、水溶性低、口服生物利用度差等原因往往受到限制[4]。这些问题通常可以通过将姜黄素包封在口服摄入的食品级纳米颗粒基递送系统中来克服[5]。
以玉米醇溶蛋白(Zein)包埋姜黄素是增加其水分散性和稳定性,提高其生物利用度和生物活性的有效途径。玉米醇溶蛋白是玉米蛋白粉中的主要蛋白质,约占总蛋白的70%[6]。玉米醇溶蛋白是一种典型的醇溶水不溶型植物蛋白,不溶于水,只溶于60%~95%的乙醇。通过反溶剂沉淀机制将玉米醇溶蛋白-乙醇溶液注入水中,由于溶解度降低,因此玉米醇溶蛋白便可自发形成纳米粒子[7]。因其特殊的分子结构和性质,故玉米醇溶蛋白在食品、医药和化工行业可作为良好的包装材料[8-9]。
为了进一步提高玉米醇溶蛋白纳米粒子对姜黄素的包埋效果,Yao 等[10]使用生物聚合物涂层(藻酸盐/明胶)的静电沉积来增加玉米醇溶蛋白纳米颗粒的稳定性。研究结果表明:该涂层可以吸附到玉米醇溶蛋白纳米颗粒表面并增加它们的静电和空间排斥,进而提高纳米颗粒的稳定性。杨晓泉团队[11-18]近五年来在玉米醇溶蛋白的改性、制粒与应用方面做了大量工作,包括制备蛋白纳米粒子,利用干法制备玉米肽糖基化纳米粒子,利用玉米醇溶蛋白与多糖及蛋白质的相互作用合成多种玉米醇溶蛋白复合粒子(包括玉米醇溶蛋白/酪朊酸钠、玉米醇溶蛋白/硬脂酸、玉米醇溶蛋白/甜菜果胶、玉米醇溶蛋白/甲壳素复合粒子等),并对这些粒子在活性物质输送和乳液稳定等领域做了一系列的研究,这些研究为拓宽玉米醇溶蛋白的应用领域奠定了良好的基础。
美拉德反应是氨基化合物(如胺、氨基酸、蛋白质等)和羰基化合物(糖类)之间发生的非酶褐变反应,也称为羰氨反应。美拉德反应产物(Maillard reaction products,MRPs)种类繁多,不仅对食品的色泽、风味有重要贡献,还能提高食品的氧化稳定性,延长货架期[19]。通过美拉德反应来改善蛋白质功能特性,其反应本质是利用生物大分子多糖的多羟基特性改善共价复合物的亲水-亲油平衡,利用多糖的无规线团结构特质改善复合物的热稳定性,同时利用多糖的大分子本质改善复合物的界面空间稳定效果[20],美拉德反应被广泛用于蛋白质的改性[21]。由于玉米醇溶蛋白不溶于水,这极大地限制了美拉德反应在玉米醇溶蛋白改性中的应用,目前仅极少量文献报道在干热条件下玉米醇溶蛋白可与单糖发生美拉德反应[22],然而,对于湿热条件下玉米醇溶蛋白与还原糖的美拉德反应及其产物在姜黄素纳米颗粒制备中的应用还未见报道。
由于葡萄糖(Glucose,Glu)在乙醇水溶液中具有较好的溶解性,本文首先利用葡萄糖为模式多糖,通过美拉德反应对玉米醇溶蛋白进行改性,研究美拉德反应发生的最适条件,对所得MRP 的部分性质进行表征;然后,利用反溶剂法制备姜黄素纳米颗粒,研究所得纳米颗粒的部分性质,并与未改性玉米醇溶蛋白比较,以明确美拉德反应能否提高玉米醇溶蛋白纳米颗粒的功能性质。本文有望为美拉德反应在玉米醇溶蛋白改性中的应用提供参考。
1 材料与方法
1.1 材料与试剂
玉米醇溶蛋白(食品级),高邮市日星药用辅料有限公司;姜黄素(分析纯),上海生工生物工程股份有限公司;葡萄糖(分析纯),天津市光城化学试剂有限公司;牛血清白蛋白(生化试剂),天津市巴斯夫化工有限公司;考马斯亮蓝G250、氢氧化钠、盐酸、无水乙醇、95%乙醇、磷酸(分析纯),莱阳市东方化工有限公司。
1.2 仪器
紫外可见分光光度计(UV-2000),上海尤尼科仪器有限公司;恒温磁力搅拌器(90-3),上海亚荣生化仪器厂;低速大容量离心机(DL-5-B),上海安亭仪器设备厂;激光粒度分析仪(NANO ZS90),英国马尔文仪器公司;集热式恒温加热磁力搅拌器(DF-101S),巩义市于华仪器有限责任公司;真空冷冻干燥机(SCIENTZ-10N),宁波新之生物科技股份有限公司;傅里叶变换红外光谱仪(NicoletIR200),赛默飞世尔科技;热重分析仪(TGA 2-SF),梅特勒-托利多仪器公司。
1.3 方法
1.3.1 Zein/Glu 美拉德反应条件的优化
1.3.1.1 时间对Zein/Glu 美拉德反应的影响 取10 mL 质量分数3%的玉米醇溶蛋白-乙醇溶液(70%),按葡萄糖和玉米醇溶蛋白质量比2∶1 加入0.6 g 葡萄糖。用NaOH 溶液调节pH 至13.0,置于90 ℃水浴中分别反应30,60,90,120,150 min后冷却至室温。取反应溶液适当稀释后,测定美拉德反应发生的程度。
1.3.1.2 温度对Zein/Glu 美拉德反应的影响 取10 mL 质量分数3%的玉米醇溶蛋白-乙醇溶液(70%),按葡萄糖和玉米醇溶蛋白质量比2∶1 加入0.6 g 葡萄糖。用NaOH 溶液和HCl 溶液调节pH 至13.0,分别置于50,60,70,80,90 ℃水浴下反应90 min 后,冷却至室温。取反应溶液适当稀释后,测定美拉德反应发生的程度。
1.3.1.3 pH 值对Zein/Glu 美拉德反应的影响 取10 mL 质量分数3%的玉米醇溶蛋白-乙醇溶液(70%),按葡萄糖和玉米醇溶蛋白质量比2∶1 加入0.6 g 葡萄糖。用NaOH 溶液调节pH 分别至10.0,11.0,12.0,13.0,14.0,置于90 ℃水域中反应90 min 后,冷却至室温。取反应溶液适当稀释后,测定美拉德反应发生的程度。
1.3.1.4 混合比例对Zein/Glu 美拉德反应的影响取10 mL 质量分数3%的玉米醇溶蛋白-乙醇溶液(70%),按葡萄糖和玉米醇溶蛋白质量比1∶1,2∶1,3∶1,4∶1,1∶2,1∶3 分别加入葡萄糖。用NaOH溶液调节pH 值至13.0,置于90 ℃水域中反应90 min 后,冷却至室温。取反应溶液适当稀释后,测定美拉德反应发生的程度。
1.3.2 MRP 的表征
1.3.2.1 MRP 程度的测定 Zein/Glu 美拉德反应的程度用其在290 nm 和420 nm 下的吸光值表示。等美拉德反应完成后,取出部分样品并用70%乙醇适当稀释,以70%乙醇为参照,分别在290 nm 和420 nm 下比色。
1.3.2.2 溶液pH 值变化 待在最佳条件下发生美拉德反应后,直接用pH 计测定反应体系的pH值,以未发生美拉德反应的玉米醇溶蛋白-乙醇溶液作为对照。
1.3.2.3 玉米醇溶蛋白溶解性 通过反应体系中可溶性蛋白的含量来间接反应美拉德反应对玉米醇溶蛋白溶解性的影响,可溶性蛋白的含量采用考马斯亮蓝G250 法测定,以牛血清白蛋白为参照[7]。
1.3.3 负载姜黄素的Zein/Glu MRP 纳米颗粒取100 mL 质量分数3%的玉米醇溶蛋白-乙醇溶液(70%),在最佳条件下制备Zein/Glu MRP,反应结束冷却至室温,用磁力搅拌器以500 r/min 搅拌1 h,之后加入0.36 g 姜黄素持续搅拌1 h,3 000 r/min 离心10 min,除去不溶性杂质,得到澄清的溶液,4 ℃条件下储存备用。
将4 mL 上述过程中制备所得溶液用1 mL 注射器分4 次缓慢分散至16 mL pH 4.0 的蒸馏水中,分散的同时以1 000 r/min 的速度磁力搅拌3 min,得纳米颗粒分散液,用旋转蒸发器蒸发掉乙醇,并用相同体积pH 4.0 的蒸馏水补充至20 mL,制得负载了姜黄素的Zein/Glu MRP 纳米颗粒分散液。用未发生美拉德反应的玉米醇溶蛋白按照相同的工艺制备负载了姜黄素的纳米颗粒作为对照。
将所得纳米颗粒分散液分别倒入平皿,-18℃下冷冻48 h 后用真空冷冻机冻干,轻轻研磨成均匀粉末后置于干燥箱内备用。
1.3.4 包埋效率及载药量 准确称取6 mg 姜黄素溶解于100 mL 95%的乙醇溶液中,振荡摇匀。准确吸取上述溶液0.25,0.5,1,2,3,4 mL,用乙醇定容至15 mL,分别配制成1,2,4,8,12,16 μg/mL的标准溶液,用紫外可见分光光度计测定波长在425 nm 时的吸光度值,根据数据绘制得到姜黄素标准曲线[23]。根据如下两个公式计算包埋效率和载药量:


1.3.4.1 纳米颗粒表面姜黄素含量 准确称取0.1 g 纳米颗粒粉末于试管中,加入10 mL 无水乙醇,轻轻摇晃1 min。静置一段时间后,取其上清液1 mL,加入9 mL 无水乙醇稀释。以无水乙醇作对照,测定425 nm 处的吸光值,根据标准曲线测定姜黄素含量[24]。
1.3.4.2 纳米颗粒中姜黄素总含量 准确称取0.1 g 纳米颗粒粉末于试管中,加入10 mL 无水乙醇,在室温下用500 W 超声处理15 min 以提取姜黄素。此时试管下层为白色沉淀,上清液为黄色液体。3 000 r/min 离心5 min,取其上清液1 mL,加入9 mL 无水乙醇稀释。以无水乙醇作对照,测定425 nm 处的吸光值,根据标准曲线测定姜黄素含量[24]。
1.3.5 红外光谱 取少量冻干后的样品粉末于玛瑙研钵中,加入一定量KBr 进行研磨,将研磨好的粉末压片。将压片置于红外光谱仪在波长4 000~400 cm-1进行扫描分析,空白KBr 作为背景对照[25]。
1.3.6 微观结构 在导电胶上将冻干粉末状样品均匀分散,置于金属载物台上,电压为2 kV,用常温真空喷镀法喷金处理,置于扫描电镜下观察,选取具有代表性的视野,进行显微拍摄。
1.3.7 释放率 准确称取冻干纳米颗粒25 mg 用80 目尼龙网纱过滤网布包住,加入无水乙醇溶液250 mL,常温磁力搅拌,分别于0,1,2,3,4,5 h 时取1 mL 上清液,加入1 mL 无水乙醇稀释后测定425 nm 处的吸光值,根据标准曲线确定姜黄素的含量[24]。每次取出1 mL 释放液后再新加入1 mL无水乙醇以保持体系体积恒定。

1.3.8 热稳定性 称取待测样品粉末0.0030 g 加入到热重分析仪坩埚中,以氮气为保护气,按10℃/min 的速率从30 ℃加热到500 ℃,以未发生美拉德反应的玉米醇溶蛋白姜黄素纳米颗粒作为对照,通过计算机记录加热过程中的数据以及加热变化曲线[26]。
1.3.9 贮藏稳定性 将在最适条件下制备的装载了姜黄素的玉米醇溶蛋白纳米颗粒溶液和Zein/Glu MRP 纳米颗粒溶液于室温下放置一段时间,分别在第0 h、1 周、2 周、3 周、4 周和5 周时取样,测定粒径和电势变化。
1.3.9.1 粒径 将纳米颗粒分散液用70%乙醇稀释200 倍后,通过粒度分析仪在默认条件下测定粒径,每个样品测量3 次[27]。
1.3.9.2 Zeta 电势 将纳米颗粒分散液用70%乙醇稀释200 倍后,通过粒度分析仪在默认条件下测定zeta 电势,每个样品测量3 次[27]。
1.4 数据处理
本论文中所有试验数据均用OriginPro Portable 作图,结果以±s 表示。采用SPSS 16.0进行统计分析,组间差异显著性分析采用方差分析(ANOVA)中的Tukey HSD 测试,当P<0.05 时认为差异显著。
2 结果与分析
2.1 Zein/Glu 美拉德反应条件的优化
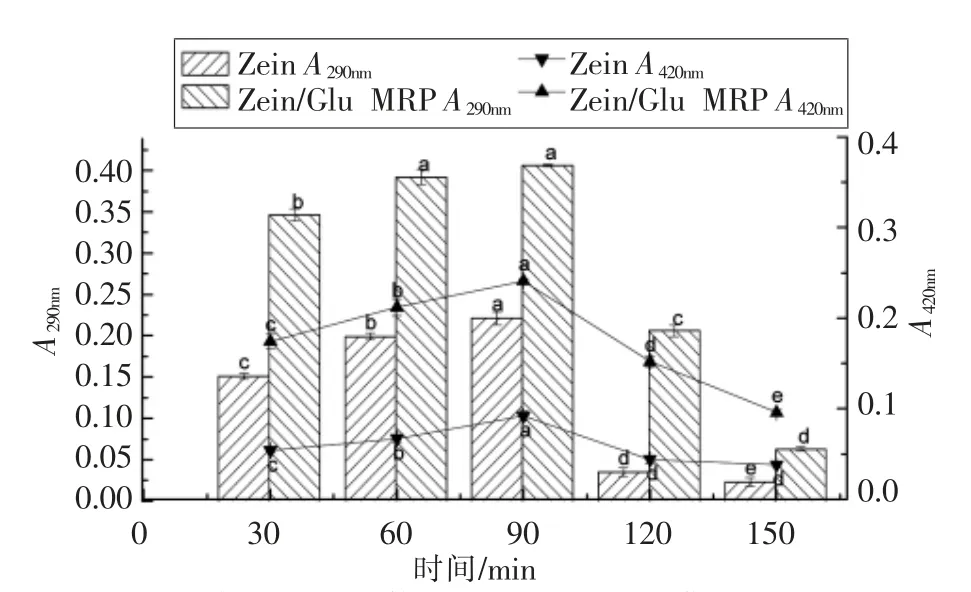
图1 时间对Zein-Glu 美拉德反应的影响Fig.1 Effect of reaction time on the Maillard reaction between zein and glucose
2.1.1 时间对Zein/Glu 美拉德反应的影响 美拉德反应初级阶段和中间阶段的产物分别在290 nm 和420 nm 处有较强吸收,因此可用这两个波长下的吸光值来表示美拉德反应程度的变化[28]。由图1可知,随着反应时间的延长,Zein/Glu MRP和玉米醇溶蛋白的A290nm和A420nm均呈现出先增加后减小的趋势,但前者的吸光值在所有反应时间下均大于后者,表明玉米醇溶蛋白与葡萄糖之间发生了美拉德反应。目前绝大多数多糖的美拉德反应均发生在水溶液中,但在有机相中的美拉德反应目前还极少有报道[29],这可能是美拉德反应尚未被用于玉米醇溶蛋白改性的一个重要原因。在本文中,由于葡萄糖在乙醇水溶液中具有较好的稳定性,这为其与玉米醇溶蛋白分子的充分接触和美拉德反应的发生创造了条件。图1的结果表明,玉米醇溶蛋白与单糖在有机相中也可以发生美拉德反应,因此美拉德反应也可以用于玉米醇溶蛋白的改性。
当反应时间由30 min 增加至90 min 时,Zein/Glu MRP 的A290nm和A420nm随之增加,表明美拉德反应的初级产物大量生成并转化为中间阶段产物[28];当反应时间进一步延长至120 min 和150 min 时,两个吸光值均随之显著下降,表明此时中间阶段产物被大量消耗生成了高分子产物,美拉德反应开始进入高级阶段。由于高级阶段产物溶解度差、副产物多,因此本文选择90 min 为玉米醇溶蛋白的最佳改性时间进行后续研究。
2.1.2 温度对Zein-Glu 美拉德反应的影响 温度对Zein-Glu 美拉德反应的影响见图2。随着温度的升高,Zein/Glu MRP 的A290nm和A420nm均呈现增长的趋势,且Zein 在两个波长下的吸光值都小于Zein/Glu MRP,进一步证实玉米醇溶蛋白与葡萄糖之间发生了美拉德反应,且高温有利于反应的发生,这与绝大部分蛋白质-糖体系的美拉德反应规律一致[4]。由于在选定的温度范围内A290nm和A420nm均未呈现下降趋势,表明此时美拉德反应都在初级和中级阶段,因此选取90 ℃为最适反应温度进行后续研究。
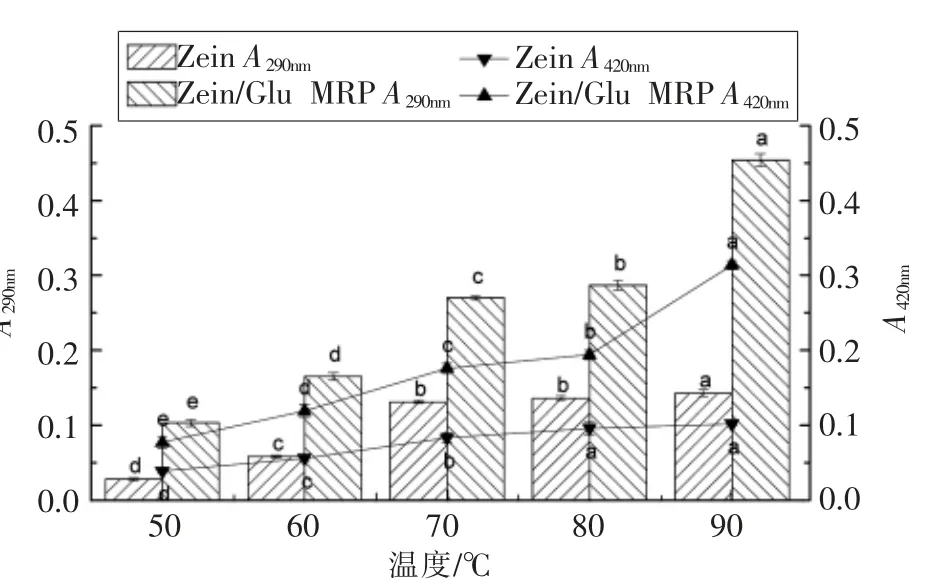
图2 温度对Zein-Glu 美拉德反应的影响Fig.2 Effect of temperature on the Maillard reaction between zein and glucose
2.1.3 pH 值对Zein-Glu 美拉德反应的影响 由于玉米醇溶蛋白在碱性溶液中有较好的溶解性[30],因此本文还研究了pH 值对Zein-Glu 美拉德反应的影响。由图3可以看出,随着体系pH 值由10增至13,Zein/Glu MRP 的A290nm和A420nm均随之显著增加;但是当pH 值达到14 时,两个吸光值均剧烈下降,表明极碱性质不利于玉米醇溶蛋白与葡萄糖之间美拉德反应的发生。因此选取pH 13为最适pH 值进行后续研究。
2.1.4 混合比例对Zein/Glu 美拉德反应的影响玉米醇溶蛋白与葡萄糖的质量比对两者美拉德反应的影响见图4。在玉米醇溶蛋白质量不变的情况下,随着葡萄糖质量的增加,Zein/Glu MRP 的A290nm和A420nm都呈现出先增大后减小的变化趋势,且在玉米醇溶蛋白与葡萄糖的质量比为1∶3时达到最大值。这表明,当葡萄糖过量时仅会使玉米醇溶蛋白发生微弱的糖基化反应。考虑到葡萄糖为单糖,微弱的美拉德反应可能会对玉米醇溶蛋白功能性质的改善不够明显,因此本文确定Zein∶Glu 质量比1∶3 为最佳混合比例,在上述确定的最佳条件下制备Zein/Glu MRP 进行后续研究。
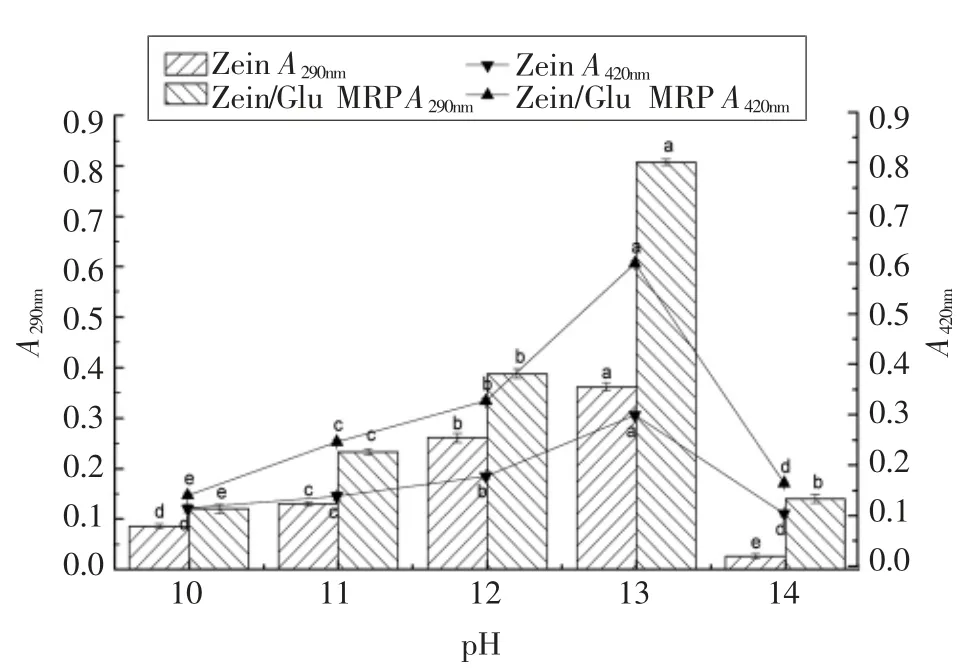
图3 pH 值对Zein-Glu 美拉德反应的影响Fig.3 Effect of pH on Maillard reaction between zein and glucose
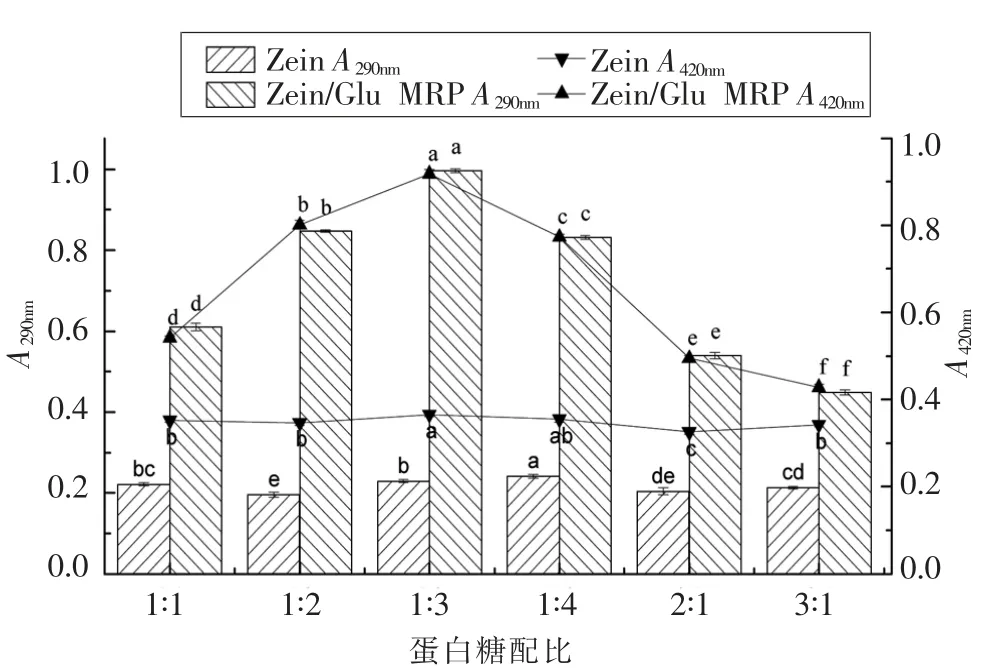
图4 Zein 与Glu 的比例对Zein-Glu 美拉德反应的影响Fig.4 Effect of zein to Glu mass ratio on their Maillard reaction
2.2 Zein/Glu MRP 的表征
2.2.1 溶液pH 值变化 由于与多糖的美拉德反应会消耗掉-NH2并产生小分子有机酸,因此蛋白质-糖之间的美拉德反应通常会使反应体系的pH值降低[31]。美拉德反应前后反应体系pH 变化见图5a。可以看出,起始Glu/Zein 混合溶液的pH 值为13,在最适条件下反应一段时间后急剧下降至7.85,而未发生美拉德反应的玉米醇溶蛋白溶液pH 值仅发生了轻微变化(pH 11.51)。这进一步证实了玉米醇溶蛋白与葡萄糖之间发生了美拉德反应,且反应程度较为剧烈。
2.2.2 玉米醇溶蛋白溶解性 美拉德反应通常会提高蛋白质的溶解性[32]。美拉德反应前后可溶性蛋白含量变化见图5b。未改性玉米醇溶蛋白的可溶性蛋白含量为231.54 mg/g,而在本文选择的最佳条件下发生美拉德反应后达到了287.79 mg/g,增加了24.3%,这表明美拉德反应使得玉米醇溶蛋白的溶解性得到了改善。
2.3 包埋效率及载药量
美拉德反应对玉米醇溶蛋白包埋效果的影响见图6所示。以姜黄素作为芯材时,Zein/Glu MRP的包埋效率为53.10%,载药量为1.59%;而玉米醇溶蛋白的包埋效率仅为2.30%,而载药量则达到了2.80%。这表明,与葡萄糖的美拉德反应可以显著提升玉米醇溶蛋白的包埋效率,从而使得大部分姜黄素被包埋于纳米颗粒内部。在纳米颗粒的制备过程中未发生姜黄素的损失,因此理论上两种纳米颗粒的载药量应该相同。图6中载药量的差异可能与包埋效率有关系。由于Zein/Glu MRP 纳米颗粒的包埋率更高,导致在利用无水乙醇提取时不完全,结果使测得的载药量有所降低。
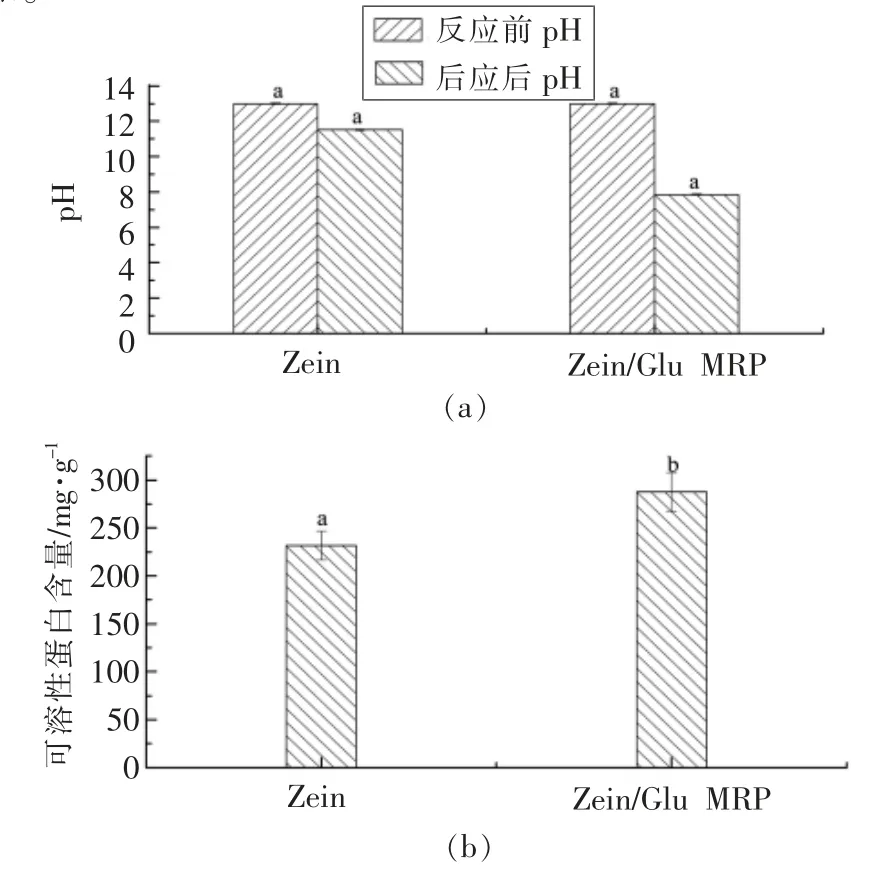
图5 美拉德反应对反应体系pH 值(a)及可溶性蛋白含量(b)的影响Fig.5 Effect of Maillard reaction on the pH (a)and soluble protein content (b)of the reaction system
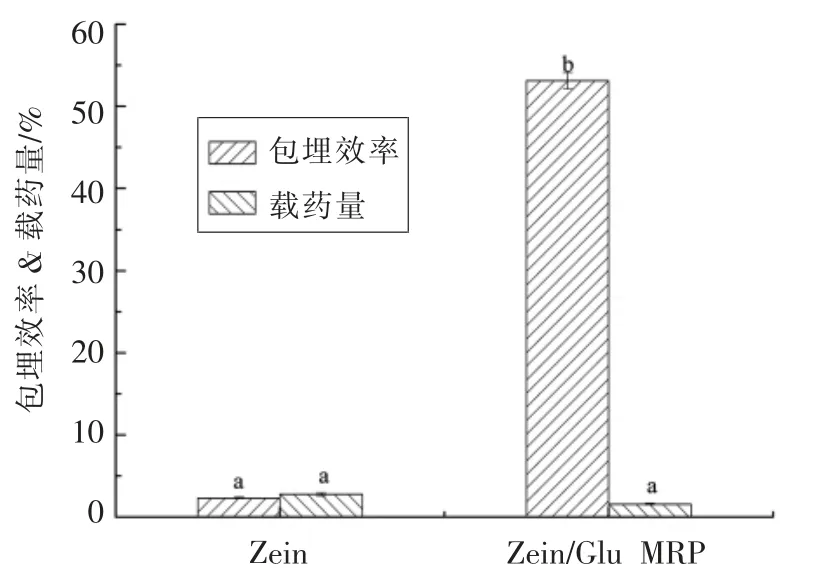
图6 美拉德反应对玉米醇溶蛋白包埋效率的影响Fig.6 Effect of Maillard reaction on the embedding efficiency of zein
2.4 傅里叶红外光谱分析
纳米颗粒的红外光谱分析图见图7。酰胺(RCONH2)的特征吸收峰出现在3 050~3 500 cm-1处,所有样品都在这个波数范围内有一个较宽的吸收峰,其中装载了姜黄素的Zein/Glu MRPs 纳米颗粒的峰相较于装载了姜黄素的玉米醇溶蛋白纳米颗粒的峰宽,表明发生的美拉德反应会改变酰胺基团的含量;羰基(C=O)的特征吸收峰在1 750~1 680 cm-1,由图7可知,装载了姜黄素的Zein/Glu MRP 纳米颗粒在此范围内的峰比装载了姜黄素的玉米醇溶蛋白纳米颗粒、姜黄素和玉米醇溶蛋白的峰宽,表明玉米醇溶蛋白与葡萄糖发生了美拉德反应。
2.5 溶液形态
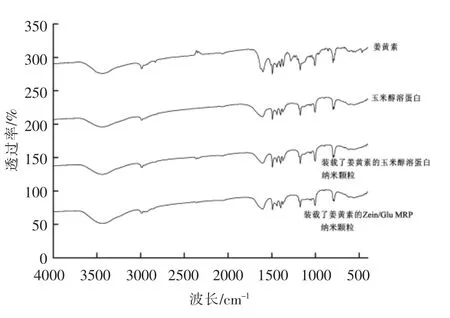
图7 装载了姜黄素的Zein 和Zein/Glu MRP纳米颗粒的红外光谱图Fig.7 FTIR spectrum of the curcumin-loaded zein and Zein/Glu MRP nanoparticles

图8 Zein(a)和Zein/Glu MRP(b)稳定姜黄素纳米颗粒溶液形态Fig.8 Morphology of the aqueous curcumin solutions stabilized by zein (a)and Zein/Glu MRP (b)
由两种玉米醇溶蛋白稳定的姜黄素纳米颗粒溶液的形态见图8。玉米醇溶蛋白和姜黄素本身均溶于水,但是图8可以看出整个体系非常均一,无分层或沉淀出现,表明纳米颗粒乳液制备成功。另外,Zein/Glu MRP 稳定乳液(图8b)的颜色要深于玉米醇溶蛋白稳定的姜黄素纳米颗粒溶液,这是由于美拉德反应导致褐变所致。
2.6 微观结构
装载了姜黄素的Zein/Glu MRP 纳米颗粒冻干后的扫描电镜状态见图9所示。可以看出,纳米颗粒之间发生了较为严重的聚集现象,这可能会影响冻干粉末的流动性;虽然如此,基质表面可以看到较多的球状结构,表明形成的纳米颗粒为球形。有文献报道表明,玉米醇溶蛋白通过反溶剂法制备的芦丁纳米颗粒[33]和姜黄素纳米颗粒[34]均为球形,这与图9的结果基本一致,但是这两篇报道中均未观察到严重的聚集现象,表明美拉德反应可能会改变玉米醇溶蛋白的表面性质,从而使得聚集的趋势增强。
2.7 释放率
为了检验所得纳米颗粒是否具有缓释功能,对两种负载了姜黄素的纳米颗粒在乙醇中的释放性能进行了研究。由图10可知,随着释放时间的延长,两种纳米颗粒中姜黄素的释放率均随着浸泡时间的延长而增加,当浸泡时间达到12 h 时,两种纳米颗粒中姜黄素的释放率分别达到了76.91%和82.96%。另外,装载了姜黄素的玉米醇溶蛋白纳米颗粒在浸泡的起始阶段(1~6 h)姜黄素的释放率急剧增加,随后缓慢变化,表现为“突释”行为(burst release),装载了芦丁的玉米醇溶蛋白纳米颗粒也表现出了类似的释放行为[8];而装载了姜黄素的Zein/Glu MRP 纳米颗粒中的姜黄素在整个浸泡过程中释放率均比较稳定,表现出了较好的缓释功能 (sustainable release)。这是由于Zein/Glu MRP 纳米颗粒的保留率更高,被包埋在颗粒内部的姜黄素释放较为困难,从而使最终的累积释放率较低,但是释放速度更加缓慢。因此,通过美拉德反应可以改善玉米醇溶蛋白纳米颗粒的缓释性能。

图9 装载了姜黄素的Zein/Glu MRP纳米颗粒的扫描电镜图Fig.9 SEM images of the curcumin-loaded Zein/Glu MRPs nanoparticles
2.8 热稳定性
纳米颗粒的TGA 变化见图11。姜黄素的质量损失大致分为两个阶段,从200 ℃左右时,反应物的质量开始下降,到400 ℃左右时,质量损失约45%,随后失重速率降低,400~500 ℃期间,质量损失约5%。玉米醇溶蛋白及装载了姜黄素的玉米醇溶蛋白纳米颗粒的质量损失大体可以分为3 个阶段,从100 ℃左右时,两种样品的质量均降低了5%左右,这是由于失水所至,随后失重速率降低;从260~350 ℃时,两种样品的质量降低到了50%左右,质量损失约45%,装载了姜黄素的玉米醇溶蛋白纳米颗粒开始失重缓慢,而玉米醇溶蛋白失重速率依旧增加,在370 ℃时达到峰值;从370~500 ℃玉米醇溶蛋白的质量降低到了25%左右,而装载了姜黄素的玉米醇溶蛋白纳米颗粒的质量降低到了35%左右。
装载了姜黄素的Zein/Glu MRP 纳米颗粒的质量损失大致分为4 个阶段,在100 ℃左右质量降低到约90%;当温度达到150~200 ℃之间时,失重率进一步剧烈下降,纳米颗粒的质量降低到65%左右,而另外3 个样品中未观察到此现象,表明美拉德反应生成了一些易热分解或易挥发的物质;当温度进一步升高到500 ℃时,纳米颗粒的质量缓慢降低到30%左右,这一数值高于玉米醇溶蛋白纳米颗粒和玉米醇溶蛋白,表明发生了美拉德反应的玉米醇溶蛋白再包埋姜黄素能够提高纳米颗粒的热稳定性。
2.9 贮藏稳定性
2.9.1 粒径 贮藏时间对纳米颗粒粒径的影响见图12a。无论是装载了姜黄素的玉米醇溶蛋白纳米颗粒还是装载了姜黄素的Zein/Glu MRP 纳米颗粒,粒径均随着贮藏时间的延长而增加,表明颗粒发生了聚集,稳定性有所降低。刚制备的两种纳米颗粒溶液的粒径并无显著差别,但是在第3~5周时Zein/Glu MRP 稳定姜黄素纳米颗粒显著小于玉米醇溶蛋白纳米颗粒,表明前者具有更好的稳定性。
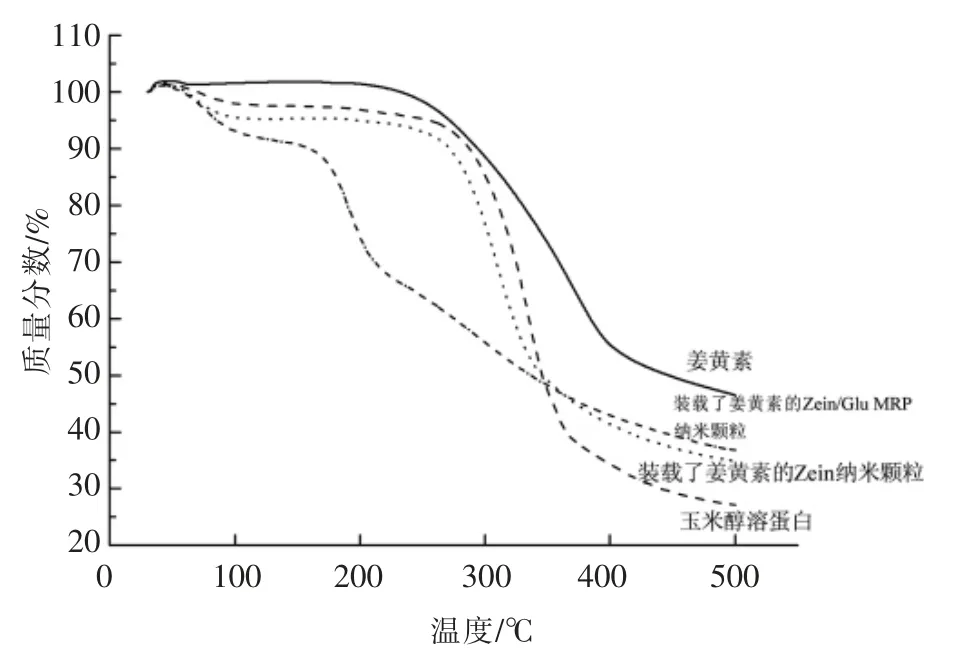
图11 装载了姜黄素的Zein/Glu MRP纳米颗粒的热重分析Fig.11 Thermal weight analysis of the curcumin-loaded Zein/Glu MRP nanoparticles
2.9.2 Zeta 电势 贮藏过程中两种纳米颗粒Zeta电势的变化如图12b 所示。可以看出,刚制备的Zein/Glu MRP 纳米颗粒带负电荷,而玉米醇溶蛋白纳米颗粒基本呈电中性;当贮藏时间达到2 周时,玉米醇溶蛋白纳米颗粒的电势无显著变化,而Zein/Glu MRP 纳米颗粒的电势显著降低;当贮藏时间进一步延长时,玉米醇溶蛋白纳米颗粒的电势显著增加,而Zein/Glu MRP 纳米颗粒的电势开始下降且显著低于前者。

图12 贮藏时间对装载了姜黄素的Zein 和Zein/Glu MRP 纳米颗粒粒径(a)及Zeta 电势(b)的影响Fig.12 Effect of storage time on the particle size (a)and zeta potential (b)of curcumin-loaded zein and Zein/Glu MRP nanoparticles
上述现象可能与两种纳米颗粒的包埋率有关。由图6可知,玉米醇溶蛋白纳米颗粒表面附着的油量大于Zein/Glu MRP 纳米颗粒,油层会屏蔽玉米醇溶蛋白表面的电荷,从而使得玉米醇溶蛋白纳米颗粒的表面电荷基本为0,而后者携带负电荷(图12b)。携带的负电荷增加了颗粒之间的静电斥力,因此有利于Zein/Glu MRP 纳米颗粒在贮藏过程中的稳定性(图12a)。但是当贮藏时间达到3 周及以上时,玉米醇溶蛋白纳米颗粒表面附着的油滴通过疏水性相互作用聚集到一起并从纳米颗粒表面脱落从而导致电势增加,而Zein/Glu MRP 颗粒则由于姜黄素从颗粒中缓慢泄露出来而覆盖在颗粒表面导致其电势增加。
3 结论
在70%的乙醇溶液中,玉米醇溶蛋白可以与葡萄糖发生美拉德反应,且当以控制美拉德反应在中间阶段为目标时两者的最适反应条件为Zein∶Glu 质量比3∶1、溶液pH 13、反应温度90 ℃、反应时间90 min。在此条件下,反应体系的pH 值由13 急剧下降至7.85,可溶性蛋白质含量增加了24.3%。在上述最佳条件下制备的Zein/Glu MRP以反溶剂法制备姜黄素纳米颗粒,与未改性的玉米醇溶蛋白相比,包埋效率提高了22 倍,且在乙醇溶液中具有更好的缓释性能;同时,其热稳定性和贮藏稳定性都得到了显著提高。因此,玉米醇溶蛋白与葡萄糖在70%乙醇溶液中发生的美拉德反应对玉米醇溶蛋白作为一种纳米颗粒载体的功能性质有显著的促进作用。
