补肾健骨类中药活性成分对高糖诱导成骨细胞的保护作用及机制研究*
2021-04-22王绪平黄孝闻王娜妮张子玥
王绪平 张 扬# 黄孝闻 王娜妮 张 丽 张子玥 寿 旦
1 浙江省中医药研究院 浙江 杭州 310007
2 浙江中医药大学 浙江 杭州 310053
3 上海财经大学浙江学院 浙江 金华 321013
糖尿病性骨质疏松症(DOP)是糖尿病并发骨量减少,易骨折的疾病,近年发病率呈上升趋势。目前DOP的治疗存在疗效不确切、药物不良反应等问题[1]。因此寻找安全有效的DOP治疗药物具有重要价值和现实意义。
中医学认为DOP属于“消渴”“骨痿”范畴,补肾固本是其治疗大法[2]。补肾健骨类中药淫羊藿、骨碎补、补骨脂、菟丝子、女贞子等是治疗该症的中药,文献资料表明该类中药具有促进骨愈合的作用[3,4]。有关DOP的研究表明,高浓度葡萄糖对成骨细胞的增殖、分化和矿化产生明显的抑制作用[5,6]。胰岛素受体底物(IRS1)作为调节β细胞功能的重要信号分子,通过PI3K通路调节胰岛素分泌[7]。PI3K/AKT通路也与骨代谢关系密切。胰岛素依赖型糖尿病通过抑制AKT,减弱骨形成[8]。
本研究拟拓展对补肾健骨类中药在骨类疾病中的作用研究,通过建立高糖诱导的成骨细胞模型,检测IRS1表达,阐明淫羊藿苷等补肾健骨类中药活性成分保护高糖诱导成骨细胞的作用机制,为中药在DOP的研发方面提供研究基础。
1 仪器与试剂
1.1 实验动物:新生大鼠由浙江省中医药研究院动物房提供,购于浙江省动物实验中心,动物实验许可证号:SYXK(浙)20190010。
1.2 仪器:311型二氧化碳细胞培养箱(Thermo Scientific,USA);ECLIPSE Ti型倒置荧光显微镜(Nikon,Japan);microfuge 20R小型高速冷冻离心机(BECKMAN COULTER);Spectra Max 190全波长酶标仪(Molecular Devices,USA);NEST细胞培养板培养皿(无锡耐思生物科技有限公司);AE240电子天平(Switzerland);超低温冰箱(Thermo,USA);超低温冰箱(Thermo,USA);美国ABI RT-PCR仪。
1.3 药品及试剂:柚皮苷(中国药品生物制品检定所,批号:110722-201910);补骨脂二氢黄酮(宝鸡市辰光生物科技有限公司,批号:20191103);淫羊藿苷对照品(中国药品生物制品检定所,批号:110703-201809);DMEM培养基(吉诺生物医药技术有限公司,批号:1712201806);胎牛血清(Gibco,批号:1907133);MTT细胞增殖及细胞毒性检测试剂盒(南京凯基生物科技发展有限公司,批号:20180828);DMSO(VETEC,批号:WXBC1590V);胰蛋白酶、Ⅱ型胶原蛋白酶均购自南京凯基生物科技发展有限公司。β-actin、IRS1、AKT、Runx2引物合成,生工生物工程(上海)股份有限公司;BioRT cDNA First Strand Synthesis Kit(杭州博日科技有限公司,批号:20190601);BioEasy SYBR Green I Real Time PCR Kit(杭州博日科技有限公司,批号:20190902);AKT抗体(批号:ab66138)、Runx2抗体(批号:ab76956)、GAPDH抗体(批号:ab181602)、辣根酶标记山羊抗兔IgG(批号:ab6721)及山羊抗鼠IgG(批号:ab8245)(英国Abcam公司)。
2 方法
2.1 原代大鼠成骨细胞培养:将新生24h内的Wistar大鼠,引颈处死,75%酒精消毒。无菌操作取颅盖骨。将颅盖骨置于含DMEM液的培养皿中,尽量去除颅盖骨上的骨膜、血管及结缔组织,DMEM液反复洗涤至骨片发白。将骨片置于0.25%胰蛋白酶-EDTA液中,用剪刀剪成1mm×1mm×1mm的组织块。先后用0.25%胰蛋白酶-EDTA液与0.1%Ⅱ型胶原酶37℃水浴消化。离心弃上清,DMEM液重悬,离心弃上清。用含10%胎牛血清的DMEM培养液重悬,吹打均匀,接种至培养瓶中。37℃、5% CO2条件下培养,每3d换液1次。待细胞长满后,用0.25%胰蛋白酶-EDTA 液消化传代接种适宜的实验器皿中,37℃、5% CO2条件下培养,用倒置相差显微镜观察细胞形态及生长状况,收集细胞进行后续实验。
2.2 实验分组与给药:取第3代生长良好的大鼠成骨细胞,以1×105接种于96孔板,实验分4组:空白组、葡萄糖高剂量组(45mmol/L)、葡萄糖中剂量组(30mmol/L)和葡萄糖低剂量组(20mmol/L)。培养24h充分贴壁后,各组更换不同浓度葡萄糖培养液,继续培养24h,48h,72h后测定。
精确称取相应对照品柚皮苷、补骨脂二氢黄酮、淫羊藿苷,用PBS液配成0.3mg/ml,临用前用DMEM培养液进行梯度稀释,0.22μm滤器除菌,4℃保存备用。取上述实验中葡萄糖诱导的成骨细胞最佳浓度为高糖成骨细胞模型。分别加入前期预实验结果中最佳浓度的柚皮苷、补骨脂二氢黄酮、淫羊藿苷对照品。
2.3 MTT法测定成骨细胞活性:取生长良好的大鼠成骨细胞,以1×105接种于96孔板中,实验分为5组:空白组、葡萄糖组、柚皮苷组、补骨脂二氢黄酮组和淫羊藿苷组,各组分别加入相应培养液作用24h、48h、72h后,采用MTT法测定各组不同培养时间的成骨细胞活力,按照公式计算细胞存活率:细胞存活率=(A实验组/A对照组)×100%。
2.4 RT-PCR检测成骨细胞PI3K、IRS1、Runx2的mRNA表达水平:大鼠成骨细胞接种于6孔板中,实验分为5组:空白组、模型组(加入30mmol/L的葡萄糖)、柚皮苷组、补骨脂二氢黄酮组及淫羊藿苷组。柚皮苷组、补骨脂二氢黄酮组、淫羊藿苷组分别选取前期实验中最佳给药浓度进行给药,各组分别加入相应培养液作用24h,用Trizol法提取总RNA,按照试剂盒说明进行逆转录反应和实时荧光定量PCR检测。以β-actin为内参基因,采用ΔΔCt法进行分析,PCR引物序列见表1。
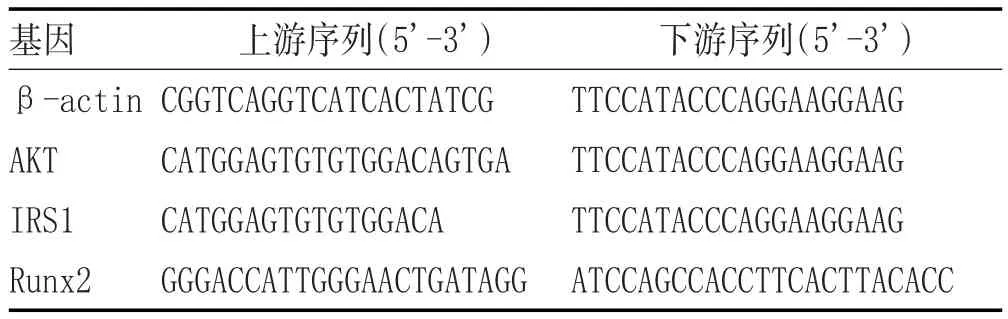
表1 实时荧光定量PCR引物序列
2.5 Western Blot检测成骨细胞AKT、IRS1、Runx2蛋白表达的影响:大鼠成骨细胞按“2.1”和“2.4”培养细胞,并给药,给药后48h收集各组细胞,裂解并提取总蛋白。用BCA法测定样本蛋白浓度,各组取20μg蛋白进行电泳,室温下,半干法转移到PVDF膜上,封闭液封闭。封闭后与1∶1000稀释的一抗(AKT、IRS1、Runx2、GAPDH抗体)4℃孵育过夜。次日加相应二抗室温下孵育1h,PBST洗涤PVDF膜3次,每次5min,BioRad系统曝光。收集条带用“Image Lab”软件量化。
2.6 统计学处理:实验数据和资料用均数±标准差表示,采用SPSS 20.0统计学软件对实验数据进行统计学分析,采用配对t检验(a=0.05),比较各组间实验结果,并进行差异分析,P<0.05为差异有统计学意义。
3 结果
3.1 高糖诱导的成骨细胞形态学观察:倒置显微镜下可见,正常成骨细胞接种后悬浮在培养液中,形态为圆形透亮的小颗粒,4h后即可见部分细胞贴壁,并开始逐步伸展。24h后活细胞逐渐伸出伪足样的突起,形态多不规则,胞浆丰富,胞核较圆,轮廓清晰。48h后可见主要为梭形,5d左右贴满瓶壁,不规则排列。约14d左右开始形成矿化结节,可逐渐增大,呈簇状。高糖环境下成骨细胞形态与空白对照组的细胞比较,模型组的细胞经高糖作用7天后细胞数目明显减少,胞体收缩,突起变短,细胞核缩小,不规则。见图1。
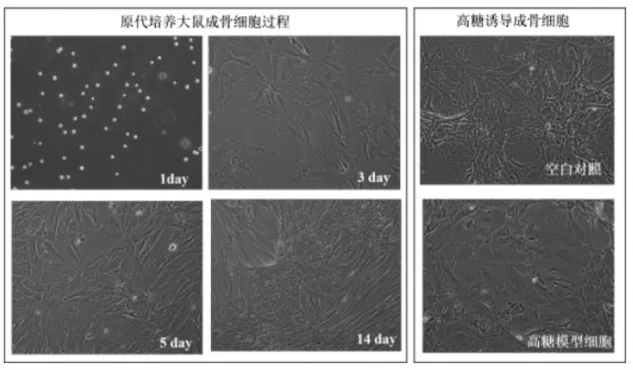
图1 不同培养时间和高糖诱导的原代大鼠成骨细胞形态图
3.2 高糖作用对成骨细胞增殖的影响:高糖对成骨细胞存活率的影响见表2。由表2可知,葡萄糖高、中、低剂量组分别作用于成骨细胞24h后,与空白对照组比较,细胞活性均显著增加,差异有统计学意义(P<0.05)。作用成骨细胞48h后,模型组的细胞活性下降,其中葡萄糖中剂量组下降最大。
表2 高糖对成骨细胞存活率的影响(±s)
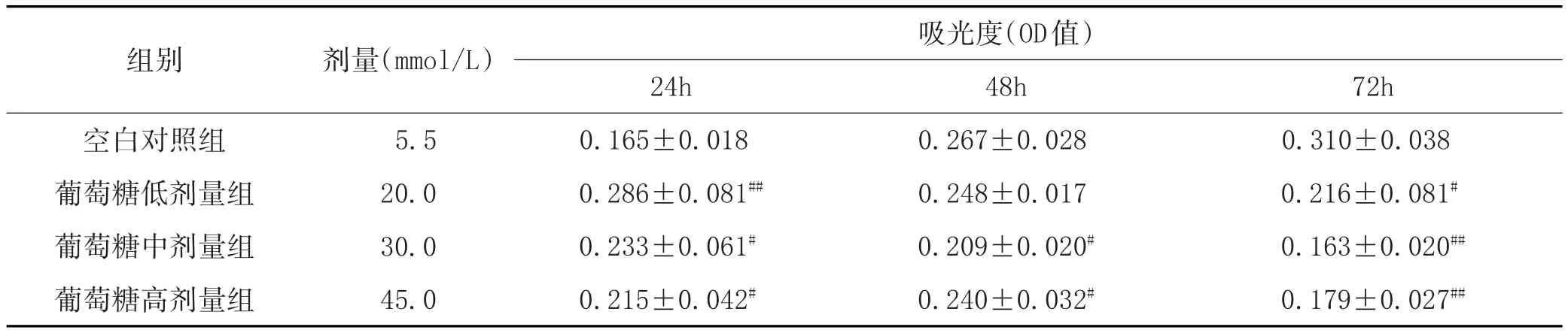
表2 高糖对成骨细胞存活率的影响(±s)
注:与空白对照组比较,#P<0.05,##P<0.01。
剂量(mmol/L)组别空白对照组葡萄糖低剂量组葡萄糖中剂量组葡萄糖高剂量组72h 0.310±0.038 0.216±0.081#0.163±0.020##0.179±0.027##5.5 20.0 30.0 45.0 24h 0.165±0.018 0.286±0.081##0.233±0.061#0.215±0.042#吸光度(OD值)48h 0.267±0.028 0.248±0.017 0.209±0.020#0.240±0.032#
在高糖作用成骨细胞72h后,模型组的细胞活性继续下降,各剂量组与正常成骨细胞活性的空白对照组比较,有显著性差异(P<0.05),其中葡萄糖中剂量组下降最大。结果表明,成骨细胞在高糖环境下其细胞活力随葡萄糖作用时间及浓度的变化而变化,其中葡萄糖中剂量组对细胞损伤最大,故后续试验选用葡萄糖30mmol/L给药,即为模型组。
3.3 补肾健骨中药活性成分促进高糖诱导成骨细胞的增殖作用:由表3可知,高糖作用48h、72h后与空白对照组相比吸光度(OD值)均显著降低,差异有统计学意义(P<0.01),显示模型组细胞生长活力下降。淫羊藿苷给药48h后,与模型组比较OD值均显著增加,显示给药组细胞生长活力上升(P<0.05,P<0.01),柚皮苷、补骨脂二氢黄酮组细胞增殖不明显。提示淫羊藿苷能改善葡萄糖对成骨细胞生长的抑制作用。
表3 3种成分对高糖成骨细胞存活率的影响(±s)
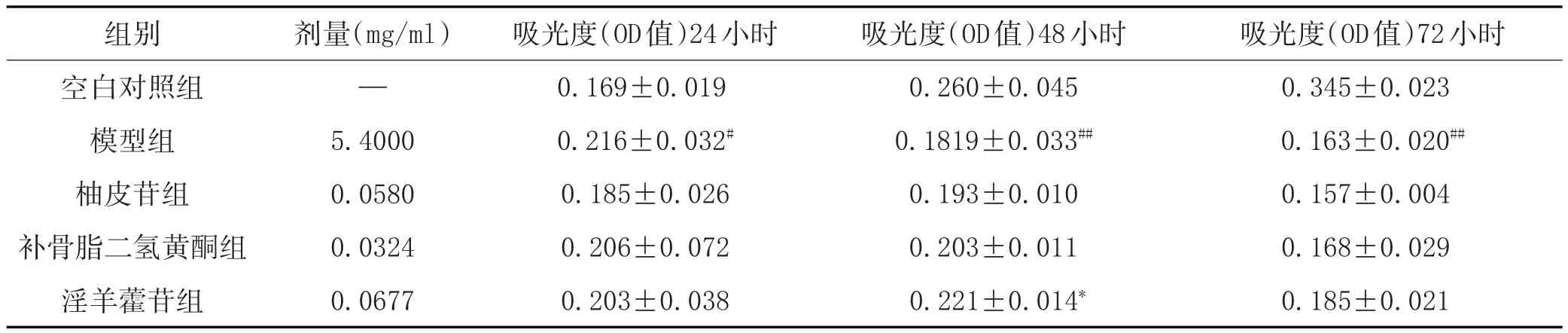
表3 3种成分对高糖成骨细胞存活率的影响(±s)
注:空白对照组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
组别空白对照组模型组柚皮苷组补骨脂二氢黄酮组淫羊藿苷组吸光度(OD值)72小时0.345±0.023 0.163±0.020##0.157±0.004 0.168±0.029 0.185±0.021剂量(mg/ml)—5.4000 0.0580 0.0324 0.0677吸光度(OD值)24小时0.169±0.019 0.216±0.032#0.185±0.026 0.206±0.072 0.203±0.038吸光度(OD值)48小时0.260±0.045 0.1819±0.033##0.193±0.010 0.203±0.011 0.221±0.014*
3.4 中药活性成分对高糖成骨细胞IRS1、AKT、Runx2的mRNA表达的影响:与空白对照组比较,模型组AKT、IRS1的mRNA的表达水平下降(P<0.05,P<0.01),与模型组比较,中药活性成分柚皮苷、补骨脂二氢黄酮、淫羊藿苷均可上调AKT、IRS1、Runx2的mRNA表达(P<0.05,P<0.01),结果如表4所示。
表4 3种成分对AKT、IRS1、Runx2的mRNA表达量的影响(±s)
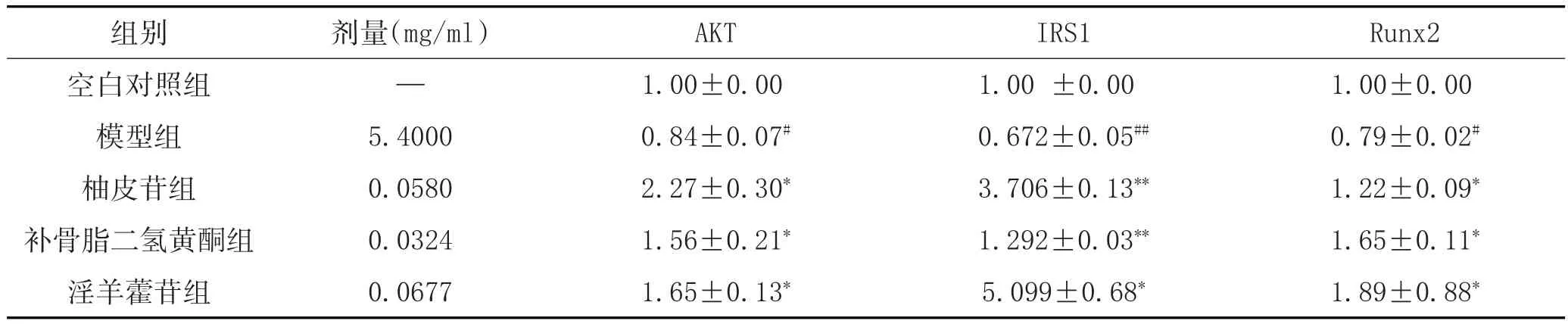
表4 3种成分对AKT、IRS1、Runx2的mRNA表达量的影响(±s)
注:与空白对照组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
组别空白对照组模型组柚皮苷组补骨脂二氢黄酮组淫羊藿苷组Runx2 1.00±0.00 0.79±0.02#1.22±0.09*1.65±0.11*1.89±0.88*剂量(mg/ml)—5.4000 0.0580 0.0324 0.0677 AKT 1.00±0.00 0.84±0.07#2.27±0.30*1.56±0.21*1.65±0.13*IRS1 1.00±0.00 0.672±0.05##3.706±0.13**1.292±0.03**5.099±0.68*
3.5 中药活性成分对高糖成骨细胞AKT、IRS1、Runx2蛋白表达的影响:结果见图2,与空白对照组比较,模型组细胞AKT、IRS1、Runx2的蛋白表达均显著降低(P<0.05)。与模型组比较,中药活性成分柚皮苷组、补骨脂二氢黄酮、淫羊藿苷组均能提高AKT、IRS1、Runx2的蛋白表达水平(P<0.05)。
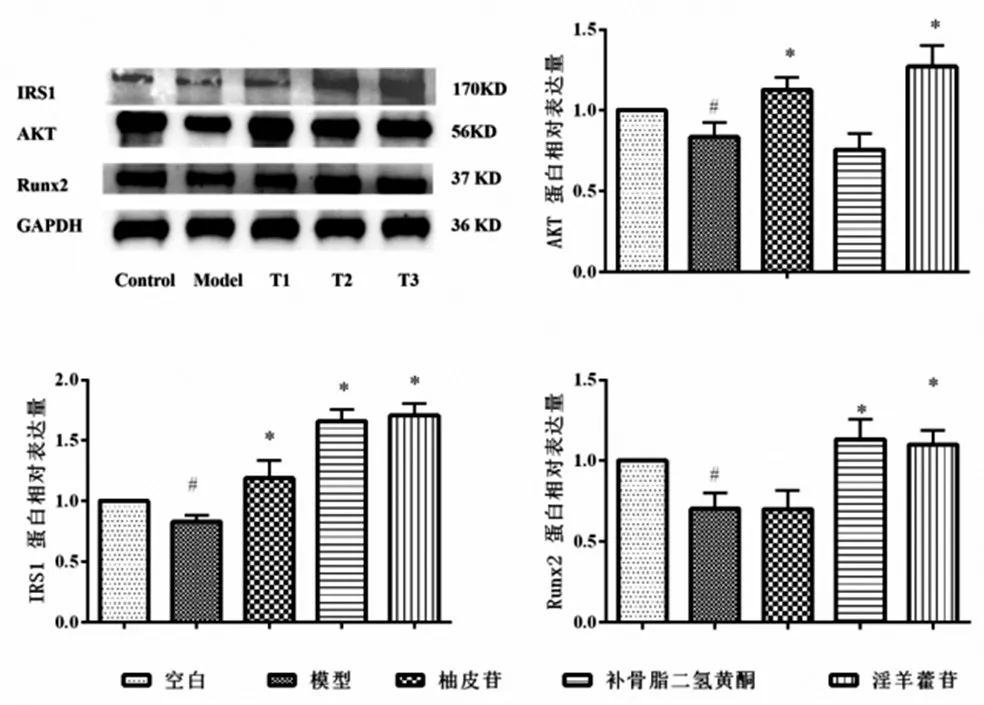
图2 各组AKT、IRS1、Runx2蛋白水平表达情况
4 讨论
项目组前期药物筛选的研究提示,补肾健骨中药骨碎补、补骨脂、淫羊藿中的有效成分柚皮苷、补骨脂二氢黄酮和淫羊藿苷,具有促进成骨细胞增殖作用。文献显示,上述3种成分均具有促进骨愈合的作用,能促进成骨细胞增殖和分化[8-11]。本研究结果表明,成骨细胞在高糖介入的环境中,其细胞活力随葡萄糖作用时间及浓度的变化而变化,作用24h细胞活力增加,48h、72h细胞活力下降,细胞增殖呈先扬后抑趋势。在高糖诱导的模型细胞中加入3种活性成分,结果提示淫羊藿苷能显著增强高糖成骨细胞活力。
有研究表明,骨质疏松症的相关信号通路中,BMPSmads、PI3K/AKT等信号通路主要作用于成骨细胞,促进骨形成[12,13]。BMP-Smads信号通路是成骨细胞增殖相关的关键及经典通路,进入核内,激活Smad1/5/8,启动磷酸化转录因子Runx2,上调特异性成骨细胞产物,促进骨基质合成及矿化反应[14,15]。
本研究证实,我们选取的3种补肾中药活性成分可调控高糖诱导下成骨细胞中的ISR1/AKT/Runx2信号通路,从而影响高糖介入环境下的大鼠成骨细胞。本实验探究补肾健骨中药有效成分保护高糖诱导成骨细胞的作用机制,为临床防治DOP新药的研发提供一定的理论基础。
