PD-1抑制剂治疗消化系统恶性肿瘤后超进展发生率及影响因素分析
2021-04-22陈诗韵千年松苟苗苗戴广海
陈诗韵,千年松,闫 欢,苟苗苗,戴广海
1 解放军医学院,北京 100853;2 解放军总医院第一医学中心 肿瘤内科,北京 100853
近年来免疫疗法成为难治性或复发性恶性肿瘤医学界研究热点。许多临床研究已经证实免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)在多种恶性肿瘤的治疗中有良好的疗效,因此ICIs成为了部分癌症的标准治疗方式[1-4]。KEYNOTE-059试验显示,PD-L1阳性的晚期胃癌患者三线治疗应用帕博利珠单抗,客观缓解率(objective response rate,ORR)为22.7%,中位缓解持续时间达8.1个月;在三线治疗的总人群中,ORR为16.4%[5]。因此FDA批准帕博利珠单抗用于胃癌的三线治疗。PD-1单抗应用于错配修复缺陷(deficiency of mismatch repair,dMMR)/微卫星高度不稳定(microsatellite instability-high,MSIH)的晚期结直肠癌患者的一项临床试验中,患者总缓解率为31%,1年总生存(overall survival,OS)率为73%[6]。对于难治性或身体不能耐受靶向药物索拉非尼治疗的肝癌患者,CheckMate-040试验表明,在纳武利尤单抗剂量递增队列和剂量扩大队列中的患者ORR分别为15%、20%[7]。而KEYNOTE-224试验显示帕博利珠单抗的缓解率为17%[8],结果令人鼓舞。但由于患者体内免疫系统和癌细胞的相互作用是动态且异质的,部分患者在接受免疫治疗后出现了前所未有的反应,如肿瘤延迟反应、假性进展(pseudoprogression,PsPD)[9-10]。更重要的是,最新证据表明PD-1单抗可以导致肿瘤出现超进展(hyper progressive disease,HPD),发生率为4% ~ 29%[11]。这种肿瘤的加速生长与不良的预后密切相关[12-13]。尽管HPD先前有过报道,但目前可获得的数据有限,且大多数都是有关非小细胞肺癌、黑色素瘤或头颈部鳞状细胞癌的相关报道。近期一项国内的研究专门针对消化系统肿瘤HPD进行了报道,发生率为20%,但可评估病例相对较少[14]。为此,本研究对消化系统恶性肿瘤患者使用PD-1单抗治疗时超进展的发生率进行评估并探究其发生的相关因素。
资料与方法
1 资料来源 收集解放军总医院第一医学中心2015年4月- 2019年4月使用PD-1抑制剂治疗的各类型Ⅳ期消化系统恶性肿瘤患者135例的临床数据。纳入标准:1)年龄≥18岁;2)经临床及病理学证实为Ⅳ期消化系统恶性肿瘤;3)免疫治疗前后均有可获得的CT扫描数据;4)接受过PD-1抑制剂治疗;5)根据RECIST 1.1评估存在目标病灶。排除标准:1)无法获得使用免疫检查点抑制剂前6 ~ 8周的CT/MRI扫描数据或基线CT/MRI扫描数据或接受免疫治疗后6 ~ 8周的CT/MRI扫描数据;2) 根据RECIST 1.1评估标准,无可测量的靶病灶;3)确诊后生存时间<6 周。
2 PD-1抑制剂用药方法 纳武利尤单抗:3 mg/kg,静脉注射,每2周1次,用药3个疗程,在第3疗程后2 ~ 4周进行免疫治疗后首次影像学评估;帕博利珠单抗:2 mg/kg,静脉注射,每3周1次,用药2个疗程,第2疗程后3 ~ 5周进行评估。即两种PD-1抑制剂均为开始应用免疫治疗后6 ~ 8周内进行首次评估疗效。
3 超进展定义及肿瘤的评估公式 1)超进展定义:对免疫治疗后首次影像学评估为疾病进展患者的肿瘤病灶进行再次评估,肿瘤生长速率(tumor growth rate,TGR)的差值(TGRD)超过50%定义为超进展。2)肿瘤生长速率计算公式:根据Ferté等[15]的公式进行计算。根据RECIST标准,肿瘤评估时定义t为时间(以月为单位),Dt为目标病灶的最长直径之和。肿瘤体积公式:

其中V0为基线处的肿瘤体积,Vt为t个月时的肿瘤体积。
假设肿瘤的生长遵循指数规律,将TG设为增 长因子,则在t时刻含未知值的肿瘤体积公式为:

TG可以通过对公式1-1和1-2,以e为底数求 对数得到:

TGR被定义为肿瘤体积每个月的百分比增长率:
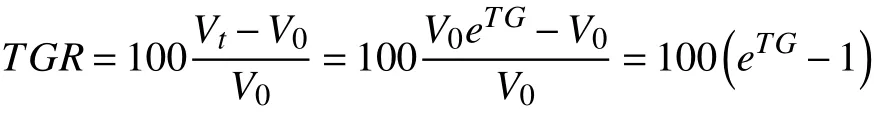
在使用免疫检查点抑制剂前6 ~ 8周时、基线时、接受免疫治疗后6 ~ 8周时行CT/MRI扫描评估肿瘤体积。我们将基线前6 ~ 8周内至基线间的肿瘤生长速率设为TGRPRE,将基线至基线后6 ~8周的肿瘤生长速率设为TGRPOST。TGR差值(TGRD)=TGRPOST− TGRPRE,TGRD>0意味着免疫治 疗可能会使肿瘤生长加速。
4 主要分析指标及方法: 1)总生存率及生存时间;2)病理特征:恶性肿瘤种类、肿瘤细胞上PD-L1的表达;3)不同消化系统肿瘤的基因状态:胰腺癌、结直肠癌患者的KRAS状态;4)临床特征:年龄、吸烟史、手术史、使用PD-1抑制剂前疗效评估、转移器官数目、ECOG体力状况评分、乳酸脱氢酶(lactate dehydrogenase,LDH)水平、肝转移、嗜中性粒细胞和淋巴细胞比值等;5)本研究各癌种病例数有限,初步探索并分析胰腺癌的特征性肿瘤标志物CA199对其免疫治疗 后发生超进展的预测价值。
5 统计学分析 采用SPSS23.0统计学软件进行统计分析。计数资料采用χ2检验或Fisher精确检验,用Kaplan-Meier方法描绘生存曲线。计量资料以Md(IQR)表示,组间比较采用两独立样本Mann-Whitney检验。绘制接收者工作特征曲线(receiver operation characteristic,ROC)以确定CA199增幅预测超进展的阈值。所有检验均为双侧,P<0.05为差异有统计学意义。
结 果
1 一般情况 共纳入135例患者的数据。男性75例,女性60例,患者的中位年龄为59(25 ~ 86)岁,年龄<60岁者占57.0%,ECOG体力状况评分0或1分者占94.8%,原发肿瘤部位在胰腺、食管、结直肠、胆管、肝、壶腹部、胃者分别为25例(18.5%)、10例(7.4%)、22例(16.3%)、22例(16.3%)、1 7例(12.6%)、6例(4.4%)、33例(24.4%)。见表1。
2 HPD发生率及相关因素分析 在免疫治疗后首次CT/MRI扫描中,根据RECIST 1.1评估标准,57例(42.2%)患者在接受免疫治疗后首次评估最好的疗效是疾病进展(PD),其中有22例(16.3%)患者的TGRD≥ 50%,被鉴定为HPD(表1、图1),胰腺癌、食管癌、结直肠癌、胆管癌、肝癌、壶腹癌、胃癌患者超进展的发生率(例数)分别为28.0%(7/25)、20.0%(2/10)、22.73%(5/22)、13.64%(3/22)、11.76%(2/17)、16.67%(1/6)、6.06%(2/33)。单因素分析显示使用免疫治疗前转移器官数目超过2个(P<0.01)、肝转移(P=0.030)、乳酸脱氢酶高于正常水平(P<0.01)的患者接受PD-1抑制剂治疗后更频繁地观察到HPD的发生(表1)。胰腺癌及结直肠癌患者的基因检测(KRAS状态 )与HPD的发生不相关(表2)。
3 CA199对胰腺癌免疫治疗后发生HPD的预测价值 我们在随访中观察到发生HPD的胰腺癌患者免疫抑制剂治疗前后CA199上升幅度明显,HPD与非HPD胰腺癌患者CA199在1个月内上升的幅度(百分比)差异有统计学意义(P=0.006),见表3。进一步探讨其对HPD发生的预测诊断评估价值。以HPD组为阳性样本,以非HPD组为阴性样本,建立ROC诊断分析模型,再以软件拟合之ROC曲线读取约登指数最大值点,对应计算理论阈值、敏感度、特异性。经ROC曲线(图2)分析知:曲线下面积AUC (95% CI)为0.857(0.659~1.000),该指标具有较高的诊断价值(P=0.006),接受免疫治疗后1个月内(影像学检查前),当患者肿瘤标志物较基线上升超过166.84%,则提示患者发生超进展可能性大(敏感度85.70%,特 异性94.40%,见表4)。

表 1 PD-1抑制剂治疗的消化系统恶性肿瘤患者HPD与非HPD相关指标比较(n, %)Tab. 1 Comparisons of demographic and clinical characteristics between the HPD and the non-HPD patients with digestive system malignant tumors treated with PD-1 inhibitors (n, %)
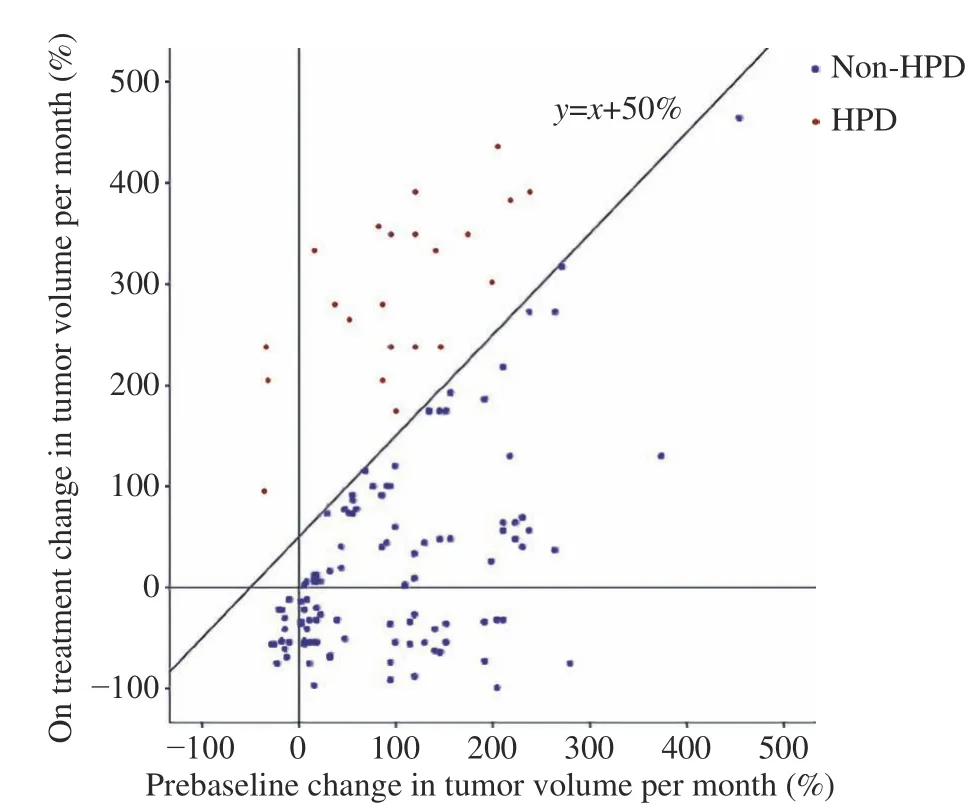
图 1 135例消化系统恶性肿瘤患者TGRPOST与TGRPRE的成对比较散点图。红点为HPD,蓝点为非HPDFig.1 Pairwise comparison of TGRPOST and TGR PRE in 135 patients with malignant tumors of digestive system. Blue spots indicate patients with non-HPD, and red spots indicate patients with HPD
4 生存分析 HPD组的OS显著低于非HPD的PD组 (中位OS:3.6个月 vs 6.2个月,P<0.01)。见图3。
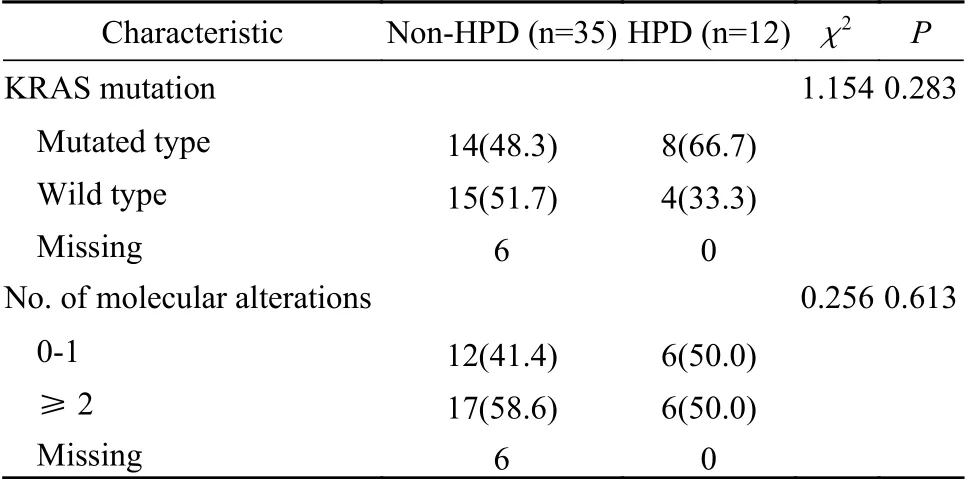
表 2 接受PD-1抑制剂治疗的胰腺癌及结直肠癌患者基因状态与超进展的关系(n, %)Tab. 2 Association between genetic status and HPD for immunotherapy-treated patients with pancreatic cancer and colorectal cancer (n, %)

表 3 胰腺癌患者免疫抑制剂治疗前后两组肿瘤标志物CA199水平比较(Md , IQR)Tab. 3 Comparison of levels of CA199 before and after immunotherapy in patients with pancreatic cancer (Md ,IQR)

表 4 CA199对接受免疫疗法的胰腺癌患者HPD发生的预测价值(%)Tab. 4 Value of CA199 in predicting HPD in patients with pancreatic cancer undergoing immunotherapy (%)
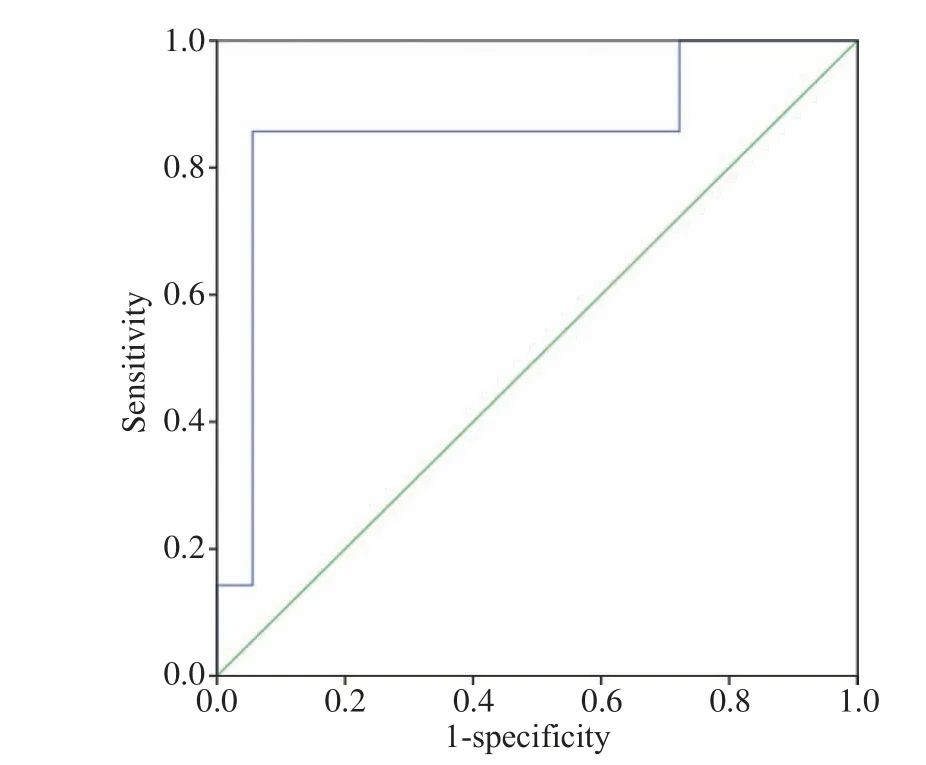
图 2 CA199预测HPD的ROC曲线(最佳阈值为166.84%)Fig.2 ROC curve of change in serum levels of CA199 to predict HPD (the optimal cut-off value is 166.84%)
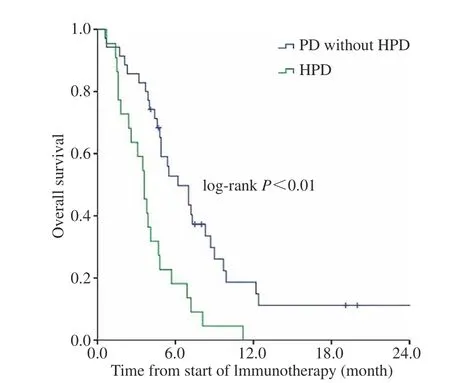
图 3 HPD组与非HPD的PD组OS曲线比较Fig.3 Overall survival for hyperprogressive disease (HPD) compared with progressive disease without hyperprogression
讨 论
本组使用PD-1抑制剂治疗消化系统恶性肿瘤患者,其中16.3%发生HPD。先前有关免疫治疗引起HPD的研究中,仅极少数研究如Champiat等[16]的研究涉及多癌种,大部分研究只涉及单一类型。Ferrara等[12]关于肺癌应用免疫治疗的研究中,13.8%的患者使用PD-1/PD-L1抑制剂后发生了HPD。而Kim等[17]报道的HPD发生率为19%。另一项34例复发或转移性头颈癌患者的研究显示使用PD-1抑制剂后超进展的发生率为29%[18]。以上发生率的差异可能是由于肿瘤类型或对HPD的定义的不同。Champiat等[16]将HPD定义为首次影像学检查根据RECIST 1.1评估为进展,并且使用PD-1抑制剂治疗期间的TGR为治疗前的2倍以上。Ferrara等[12]认为在首次评估为进展的基础上免疫治疗过程中的TGR减去治疗前的TGR(即TGR的绝对增长值,ΔTGR)超过50%/月,即属于HPD。而Sasaki等[19]将HPD描述为在接受PD-1抑制剂治疗期间,单位时间靶病灶最大直径总和的变化与治疗之前的肿瘤生长动力学(tumor growth kinetics,TGK)进行比较,TGK至少增加了2倍。我们的研究也是通过单位时间的靶病灶体积变化来评估HPD,如在免疫治疗之前每个月体积增加50%的肿瘤,在免疫治疗期间必须每个月增长至少达到100%,才能被判断为HPD。但在规定时间内需要至少连续3次的CT/MRI扫描,因此很多不符合此要求的患者会被排除,导致对HPD发生率估计不准。最近有研究显示衍生的的嗜中性粒细胞与淋巴细胞之比与HPD有关,并且是OS的独立预测因子[20]。但在我们的分析中未发现这一点,可能与样本量不足、HPD发生的例数较少有关。接受免疫治疗前转移器官数目≥2个或肝转移与接受PD-1抑制剂治疗后HPD的发生相关,两者都是反映患者肿瘤转移的指标。这让我们有理由认为肿瘤转移负荷重的患者采取免疫疗法更易发生HPD[12,17]。此前已有研究报道LDH水平与免疫治疗后的疾病进展相关[21],我们的研究也发现LDH水平高于正常值上限与HPD的发生关系密切。有报道认为KRAS驱动的肺癌经常使STK11/LKB1失活,对免疫治疗的反应较差[22]。近期有研究表明STK11和KRAS突变的同时发生可被用作HPD预测的潜在生物标志物[23]。我们的研究未发现这一现象,可能是由于一些患者没有做基因检测,导致结果误差。本研究发现,胰腺癌患者接受免疫治疗后,主要肿瘤标志物CA199在1个月内(影像学检查之前)上升的幅度超过166.84%可能对HPD的发生有预测价值。
本研究存在的局限:1)样本量有限;2)基因检测不是所有患者必须做的常规检查,导致相关数据的缺失;3)筛选条件要求至少在规定时间内有连续的3次CT/MRI扫描影像,所以很多患者被排除在外;4)本研究只关注靶病灶的变化,没有对非目标病变进行评估(如胸腔积液、腹水等),导致对HPD发生率的估算可能不准确。未来,对接受PD-1抑制剂的患者治疗前及治疗中的肿瘤组织或血液进行动态监测评估,这种前瞻性研究有助于确定HPD发生的机制及生物标志物。
综上,我们的研究表明,在一部分接受免疫治疗的消化系统恶性肿瘤患者中观察到了超进展的发生。超进展与患者的不良预后及一些临床病理特征相关,包括转移器官数目、肝转移、LDH水平升高等。胰腺癌患者接受免疫治疗后肿瘤标志物CA199在1个月内快速上升时要警惕HPD的发生。未来还需要扩大研究,进一步探索HPD发生的分子机制及其相关生物标志物。
