红芪多糖对糖尿病胃轻瘫大鼠胃肠动力及胃肠激素的影响
2021-04-21何蕴良万生芳郭倩马欣欣王同亮张磊舒畅李亚玲杨雅丽
何蕴良,万生芳,郭倩,马欣欣,王同亮,张磊,舒畅,李亚玲,杨雅丽
红芪多糖对糖尿病胃轻瘫大鼠胃肠动力及胃肠激素的影响
何蕴良,万生芳,郭倩,马欣欣,王同亮,张磊,舒畅,李亚玲,杨雅丽
甘肃中医药大学,甘肃 兰州 730000
观察红芪多糖(HPS)对糖尿病胃轻瘫(DGP)大鼠胃肠动力及胃肠激素的影响,探讨HPS改善胃肠动力障碍的作用机制。72只Wistar雄性大鼠随机选取12只为空白组,其余60只采用一次性大剂量腹腔注射链脲佐菌素联合高糖高脂饲料不规则喂养方式制备DGP模型,成模大鼠随机分为模型组、阳性药组和HPS高、中、低剂量组。阳性药组给予枸橼酸莫沙必利3.5 mg/(kg•d)灌胃,HPS高、中、低剂量组分别给予HPS 0.12、0.06、0.03 g/(kg•d)药液灌胃,空白组和模型组给予等体积纯净水灌胃,每日1次,连续8周。造模及给药期间观察大鼠一般状况、随机血糖及体质量。给药8周后,测定胃肌电慢波频率、振幅,计算胃排空率及小肠推进率,ELISA检测大鼠胃窦组织生长抑素(SS)、胃饥饿素(Ghrelin)和血清胰高血糖素样肽-1(GLP-1)含量,HE染色观察胃窦病理形态。与空白组比较,模型组大鼠一般情况变差,随机血糖显著升高(<0.01),体质量、胃排空率、小肠推进率、胃肌电慢波频率和振幅均显著降低(<0.01),SS含量显著增加(<0.01),Ghrelin及GLP-1含量显著减少(<0.01),胃黏膜出血、水肿,胃腺充血坏死,腺体排列不规则,胃小凹结构破坏;与模型组比较,各给药组一般状况好转,随机血糖显著降低(<0.01),阳性药组及HPS高剂量组大鼠体质量、胃排空率、小肠推进率、胃肌电慢波频率和振幅显著升高(<0.01,<0.05),SS含量显著减少(<0.01),Ghrelin和GLP-1含量显著增加(<0.01),胃黏膜损伤程度明显减轻,胃小凹结构较为完整。HPS通过控制血糖、促进胃排空、调节胃肠激素及修复胃黏膜损伤发挥改善胃肠动力障碍的作用。
糖尿病胃轻瘫;红芪多糖;胃肠动力;胃肠激素;大鼠
糖尿病胃轻瘫(diabetic gastroparesis,DGP)是继发于糖尿病的消化道慢性并发症之一,其主要表现为胃排空延迟及餐后饱胀、厌食、恶心、呕吐、腹胀等以胃动力障碍为特点的临床症候群,严重影响患者的生活质量。DGP发病机制十分复杂,多认为与自主神经病变、胃肠激素水平改变、胃肠功能紊乱、胃平滑肌细胞损伤、高血糖等密切相关[1]。研究发现,DGP胃肠动力障碍与胃肠激素水平异常相关[2]。红芪为甘肃道地药材,其重要组分红芪多糖(Hedysarum polybotrys polysaccharide,HPS)具有调节机体细胞免疫、抗氧化、抗衰老等作用。课题组前期研究表明,HPS对DGP大鼠胃排空及小肠动力有促进作用,其机制主要与调节DGP大鼠胃平滑肌收缩,加强肠神经-Cajal间质细胞-平滑肌信息和物质传递有关[3-4]。基于前期研究,本实验对DGP大鼠进行胃窦肌电活动检测,通过分析胃窦电活动频率、振幅,结合胃排空率、小肠推进率变化,观察大鼠胃肠运动变化,检测胃窦组织生长抑素(SS)、胃饥饿素(Ghrelin)和血清胰高血糖素样肽-1(GLP-1),进一步探讨HPS促进胃肠动力的机制与其调节胃肠激素的相关性,为HPS改善胃动力障碍治疗DGP提供依据。
1 实验材料
1.1 动物
SPF级Wistar大鼠72只,雄性,8周龄,体质量(180±20)g,甘肃中医药大学实验动物中心提供,动物许可证号SCXK(甘)2015-0002。饲养于甘肃中医药大学SPF级实验室,温度22~25℃,相对湿度5%~55%,自由摄食饮水。
1.2 药物
HPS,宝鸡市方晟生物开发公司,纯度72.4%,批号20200315;枸橼酸莫沙必利分散片,成都康弘药业集团股份有限公司,批号190614。
1.3 主要试剂与仪器
SS、Ghrelin、GLP-1 ELISA试剂盒(上海酶联生物科技有限公司,批号202009),血糖试纸(罗氏血糖健康医护公司,批号478151),链脲佐菌素(STZ,VETEC公司,批号WXBD0304V),水合氯醛(天津市大茂化学试剂厂,批号20190504),酚红(上海中泰化学试剂有限公司,批号2020414),氢氧化钠(天津市大茂化学试剂厂,批号20171101),三氯乙酸(天津市大茂化学试剂厂,批号20200706)。生物电放大器(ML408,ADInstruments Dual Bio Amp/Stimulator),血糖仪(罗氏卓越金采,Accu-Chek Performa型),生理信号采集系统PowerLab 8/35(PL3508,ADInstruments PowerLab),XYJ80-2电动离心机(常州市金坛恒丰仪器厂),多功能酶标仪(Tecan,Infinite M200 Pro)。
2 实验方法
2.1 分组及造模
72只实验大鼠随机分为空白组12只和造模组60只,适应性饲养1周后,禁食不禁水12 h,将STZ溶于0.1 mmol/L柠檬酸钠缓冲液(pH 4.2~4.5),配制成1%溶液。造模组大鼠称重后,按55 mg/kg一次性腹腔注射STZ,空白组大鼠注射等体积0.1 mmol/L柠檬酸钠缓冲液。72 h后尾静脉采血,测定随机血糖≥16.7 mmol/L为糖尿病大鼠;造模大鼠以高糖高脂饲料不规则喂养(单日上午进食,双日下午进食),连续4周,测定血糖≥16.7 mmol/L,并伴有饮水量增加、腹部胀大、体质量明显减轻等表现,随机抽取空白组与造模组大鼠各2只检测胃肌电活动,造模组大鼠与空白组大鼠比较存在胃平滑肌自主收缩频率显著降低,提示DGP大鼠造模成功。根据实际成模大鼠数量并综合考虑模型大鼠死亡率,最终随机分为空白组10只,模型组11只,阳性药组和HPS高、中、低剂量组各10只,空白组大鼠给予普通饲料喂养,其余各组大鼠给予高糖高脂饲料喂养。
2.2 给药
阳性药组按3.5 mg/(kg•d)剂量给予枸橼酸莫沙必利混悬液灌胃,根据等效剂量系数折算法并综合考虑临床等效剂量及HPS纯度,确定HPS高、中、低剂量组分别予HPS 0.12、0.06、0.03 g/(kg•d)药液灌胃,枸橼酸莫沙必利分散片和HPS分别溶于2 mL纯净水,空白组和模型组予2 mL纯净水灌胃,每日1次,连续8周。
2.3 一般观察
①体征:每日观察大鼠精神状态、活动状况、粪便排泄状况、毛色等,造模和灌胃给药期间每日观察大鼠食量、饮水量变化,每2周测体质量1次。②血糖:造模后每2周使用末梢采血针尾静脉采血1次,测随机血糖并记录。
2.4 胃肌电检测
实验前禁食24 h,禁水2 h。腹腔注射10%水合氯醛(0.33 mL/100 g)麻醉,有齿镊子刺激大鼠四肢,无疼痛反射,且角膜反射存在时开始实验。大鼠仰卧位固定于恒温解剖台,腹部备皮,常规消毒。剑突下沿上腹正中线剖开,切口2~4 cm,暴露胃体。自幽门向上2 cm将针状电极在胃窦处垂直于纵行肌走向斜刺入浆膜下2 mm肌层固定(电极直径0.3 mm,胃窦胃体交界处接正极,向左旁开约0.3 cm处胃体接负极),参考电极夹于大鼠皮下,电极输入端与生物机能实验系统相连接。实验参数:采样率1 k/s,量程20 mV,低通20 Hz,高通0.3 Hz,50 Hz陷波为开,电源滤波器为开,进行信号采集。记录过程中肠管上方覆盖温生理盐水纱布以减少动物体温丧失,并关注大鼠麻醉状态,若出现头部等活动或收缩,则适量追加麻醉,使大鼠处于平稳麻醉状态,便于观察。波形平稳后,连续记录60~80 min,以5 min为一个时间段,每个数据样本剪接基线平稳的波形,随机截取6个时间段,计算每只大鼠每个时间段胃肌电慢波频率和振幅,取其平均值。数据文件通过Lab Chart8 Reader软件读取分析。
2.5 胃排空率检测
实验前大鼠禁食24 h,禁水2 h。给予酚红溶液(50 mg/dL)2 mL灌胃,20 min后处死,剖腹结扎贲门和幽门,取出整胃,沿胃大弯剪开,生理盐水冲洗胃内容物,定容至20 mL;加入氢氧化钠(0.5 mol/L)20 mL搅拌均匀,室温静置1 h后取5 mL上清液;加入20%三氯乙酸溶液0.5 mL去蛋白,3500 r/min离心15 min,取上清液。另取酚红溶液2 mL,依次加入生理盐水18 mL、20%氢氧化钠20 mL、三氯乙酸溶液4 mL,搅拌均匀,作为标准品。于多功能酶标仪560 nm波长处测定吸光度(OD值),计算胃排空率。胃排空率(%)=(酚红标准品OD值-酚红实测OD值)÷酚红标准品OD值×100%。
2.6 小肠推进率检测
取出全胃后,从结扎的幽门处将全部小肠分离,直铺于冰面,观察被酚红溶液染红小肠,于染色末端剪一小口,滴加少量氢氧化钠,若变紫蓝色则为酚红到达部位,并在此区域前后分别滴加氢氧化钠以判断酚红实际到达的部位,测量幽门至染色末端小肠的长度及幽门至回盲瓣的长度,计算小肠推进率。小肠推进率(%)=幽门至酚红染色末端小肠距离÷幽门至回盲瓣距离×100%。
2.7 胃肠激素含量测定
完成上述相关数据测量后,立即取清洁干燥胃窦组织放置冻存管中,置于-80 ℃环境保存备用;大鼠心脏取血,置于清洁干燥离心管,常温静置2 h,4 ℃、3000 r/min离心15 min,取上层血清分装于EP管,置于-80 ℃环境保存备用。测定大鼠胃窦组织SS、Ghrelin及血清GLP-1含量,严格按照ELISA试剂盒说明书进行操作。
2.8 胃窦病理形态观察
取材后胃窦组织置于4%多聚甲醛中固定24 h,梯度乙醇脱水,二甲苯透明,浸蜡,石蜡包埋,常规病理切片(厚度4 μm)。严格按标准步骤HE染色,中性树胶封片,光学显微镜下观察。
3 统计学方法
4 结果
4.1 一般状况
空白组大鼠饮食正常,营养状况良好,毛色有光泽,反应敏捷,体质量渐增。模型组大鼠造模72 h后出现多饮、多食、多尿,随机血糖升高;造模第2周,开始出现懒动扎堆、反应迟缓、毛色黯淡、多饮多尿;造模第3周,精神萎靡,活动量减少,蜷曲抱团,进食量减少,体质量下降,大便性状改变;造模第4周,体质量明显下降,腹部胀大,食量显著减少,毛色无光泽,大便溏稀不成形,多饮,小便量多。造模全程死亡3只,4只随机血糖<16.7 mmol/L,前期评价模型检测胃肌电后处死2只,后期给药过程中模型组和HPS高、中、低剂量组分别死亡4、1、1、1只,干预8周后阳性药组和HPS高、中、低剂量组一般状况较模型组明显改善。
4.2 红芪多糖对模型大鼠随机血糖的影响
与空白组比较,模型组大鼠血糖显著升高(<0.01);给药4周后,阳性药组和HPS高、中、低剂量组大鼠血糖较模型组降低,阳性药组差异有统计学意义(<0.05);给药6、8周后,阳性药组和HPS高、中、低剂量组大鼠血糖较模型组明显降低(<0.01)。见表1。
4.3 红芪多糖对模型大鼠体质量的影响
与空白组比较,模型组大鼠体质量显著降低(<0.01);与模型组比较,给药4周后阳性药组和HPS高剂量组大鼠体质量明显升高(<0.05,<0.01);给药6、8周后,阳性药组和HPS中、高剂量组大鼠体质量显著升高(<0.05,<0.01)。见表2。

表1 各组大鼠不同时间点血糖比较(±s,mmol/L)
注:与空白组比较,**<0.01;与模型组比较,#<0.05,##<0.01

表2 各组大鼠不同时间点体质量比较(±s,g)
注:与空白组比较,**<0.01;与模型组比较,#<0.05,##<0.01
4.4 红芪多糖对模型大鼠胃窦平滑肌肌电慢波频率和振幅的影响
与空白组比较,模型组大鼠胃肌电频率和振幅显著降低(<0.01);与模型组比较,阳性药组和HPS高剂量组胃肌电频率和振幅明显升高(<0.01,<0.05),HPS中剂量组胃肌电频率明显升高(<0.05)。见表3。
4.5 红芪多糖对模型大鼠胃排空率和小肠推进率的影响
与空白组比较,模型组大鼠胃排空率和小肠推进率显著降低(<0.01);与模型组比较,阳性药组和HPS高、中剂量组大鼠胃排空率和小肠推进率显著升高(<0.01)。见表4。

表3 各组大鼠胃窦平滑肌肌电慢波频率和振幅比较(±s)
注:与空白组比较,**<0.01;与模型组比较,#<0.05,##<0.01

表4 各组大鼠胃排空率、小肠推进率比较(±s,%)
注:与空白组比较,**<0.01;与模型组比较,##<0.01
4.6 红芪多糖对模型大鼠胃窦组织生长抑素、胃饥饿素和血清胰高血糖素样肽-1的影响
与空白组比较,模型组大鼠胃窦组织SS含量显著增加(<0.01),Ghrelin及血清GLP-1含量显著减少(<0.01);与模型组比较,阳性药组和HPS高剂量组大鼠胃窦组织SS含量显著减少(<0.01),阳性药组和HPS高剂量组Ghrelin、GLP-1含量显著增加(<0.01,<0.05)。见表5。

表5 各组大鼠胃窦组织SS、Ghrelin和血清GLP-1含量比较(±s,pg/mL)
注:与空白组比较,**<0.01;与模型组比较,#<0.05,##<0.01
4.7 HE染色结果
空白组大鼠胃黏膜组织未见明显损伤,上皮细胞排列紧密有序,固有层腺体排列整齐,黏膜层组织结构层次清晰;模型组胃窦黏膜组织可见明显出血、黏膜下水肿,上皮细胞坏死脱落,胃腺充血坏死,腺体排列不规则,胃小凹结构破坏;阳性药组和HPS各剂量组情况好转,胃黏膜损伤程度明显减轻,光镜下可见胃黏膜有少量充血,胃小凹结构较为完整。见图1。
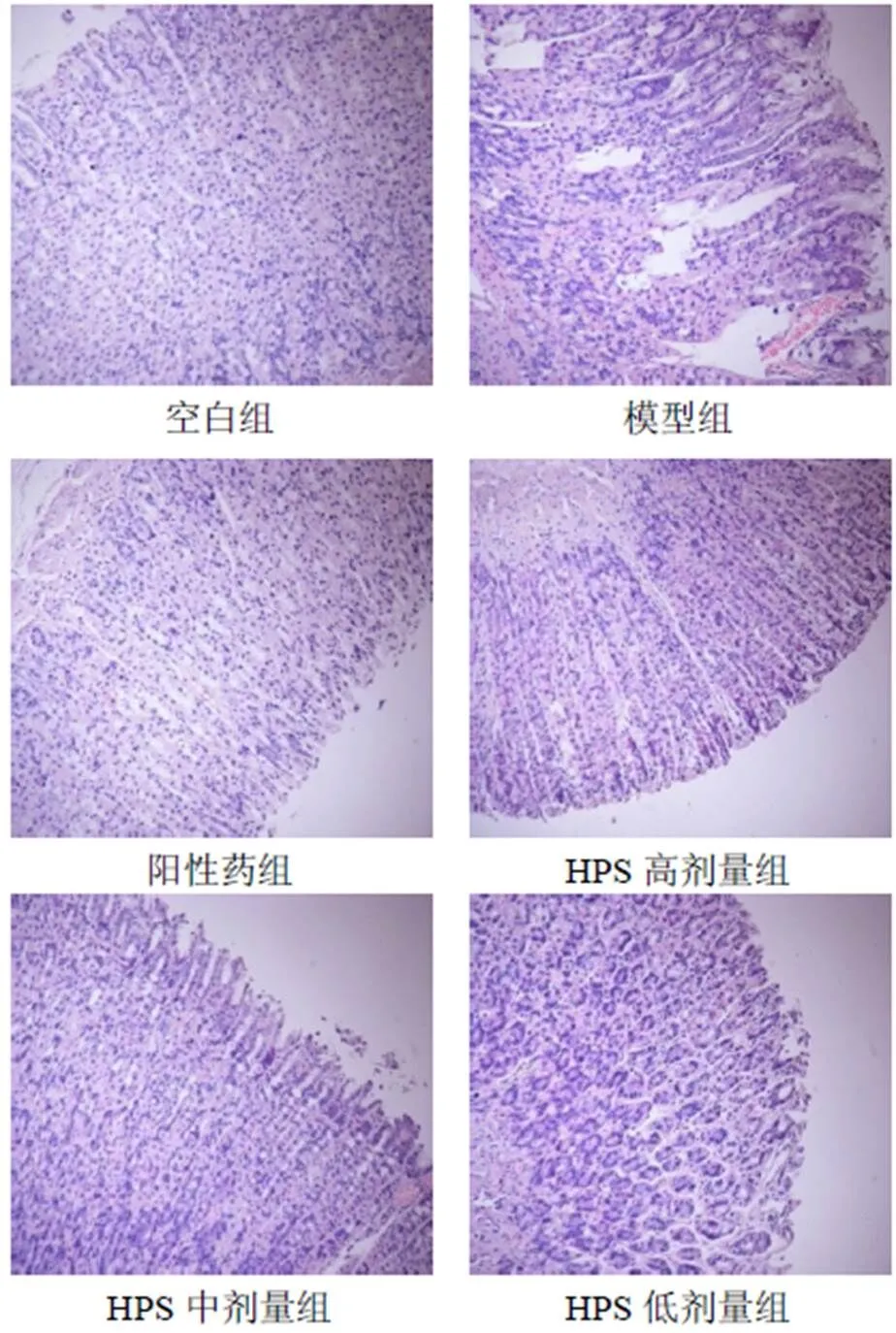
图1 各组大鼠胃窦组织形态(HE染色,×100)
5 讨论
DGP致胃肠动力障碍不仅导致患者腹胀、呕恶等,还造成降糖药吸收迟滞引起血糖不稳定,进而加重其他糖尿病并发症,严重影响患者病情转归和生活质量。DGP属中医学“消渴”范畴,消渴日久累及脾胃之气虚弱,导致胃肠动力减弱,其根本病机为脾气虚弱,失于健运,治当补气健脾。红芪为甘肃道地药材,具有补气升阳、健脾升清之功,为补气之要药,符合DGP病机。
胃的运动是平滑肌产生周期性电活动和机械活动并相互协调实现的,与胃电节律密切相关,胃电慢波频率和振幅反映了胃平滑肌蠕动节律和收缩强度[5]。胃电慢波节律紊乱时不能产生有效机械收缩,胃窦动力指数下降,胃窦、幽门及十二指肠收缩不协调,胃排空延迟,甚者出现胃运动消失[6]。
SS、Ghrelin和GLP-1为常见的胃肠激素,对调节胃肠功能及血糖代谢有重要作用。高血糖可刺激SS分泌增多,抑制胃肠道激素分泌及运动功能,导致胃排空障碍[7]。Ghrelin可诱发移行性复合运动Ⅲ相,对胃肠动力调节起促进作用[8],还可促进摄食、调节能量代谢,血糖变化是影响其分泌的重要因素[9]。GLP-1能与胰岛β细胞上GLP-1受体结合,以葡萄糖依赖方式调节胰岛素的合成与分泌,并能抑制胰高血糖素分泌[10-11],对葡萄糖代谢有重要调节作用。
本实验中,模型组大鼠血糖显著升高,胃窦黏膜损伤、结构破坏,SS含量显著增加,Ghrelin和GLP-1含量显著减少,这可能是导致胃肌电活动频率与振幅降低,胃排空率、小肠推进率下降,出现胃肠运动障碍的原因之一。经药物干预后,阳性药组和HPS高剂量组大鼠血糖显著降低,胃黏膜损伤程度明显减轻、结构趋于完整,SS含量显著减少,Ghrelin和GLP-1含量显著增加,胃电活动频率与振幅明显升高,胃排空率、小肠推进率显著升高,提示胃肠动力增强。
综上,HPS能改善DGP大鼠一般状况,降低血糖水平,改善胃肠动力,一定程度上修复胃黏膜损伤,其机制可能与HPS提高胃肠激素Ghrelin、GLP-1及降低SS水平有关。本研究结果为课题组进一步研究HPS治疗DGP胃肠动力障碍更深层次机制提供了实验依据,也为中医治疗DGP提供了新思路。
[1] KOCH K L. Diabetic gastroparesis[J]. Gastroenterol Clin NA, 2015,44(1):39-57.
[2] 万生芳,李雅琪,王晓丽,等.金芪枳术汤对糖尿病胃轻瘫GK大鼠胃动力的影响[J].中国中医药信息杂志,2018,25(9):56-60.
[3] 魏昭晖,万生芳,舒畅,等.红芪多糖对糖尿病胃轻瘫大鼠小肠组织c-kit、Cx43基因和蛋白表达的影响[J].中国中医药信息杂志,2020, 27(8):46-50.
[4] 万生芳,李雅琪,舒畅,等.红芪多糖对GK糖尿病胃轻瘫大鼠胃窦组织MYPT1/p-MYPT1蛋白表达的影响[J].时珍国医国药,2019,30(1):33-36.
[5] CHEN J D, LIN Z, MCCALLUM R W. Noninvasive feature-based detection of delayed gastric emptying in humans using neural networks[J]. IEEE Transactions on Biomedical Engineering,2000, 47(3):409-412.
[6] 李宇航,王庆国,陈萌,等.半夏泻心汤及其拆方对胃电节律失常大鼠胃电慢波频率变异系数的影响[J].中国中西医结合杂志,2006,26(S1):53-55.
[7] 李秀红.电针对糖尿病大鼠胃窦部MOT及SS调控作用的研究[D].广州:广州中医药大学,2010.
[8] 郭军鹏,李予煊,周庆莹,等.附子理中汤对脾虚小鼠胃肠动力和激素水平的影响[J].中国老年学杂志,2019,39(22):5605-5606.
[9] MURRAY C D, MARTIN N M, PATTERSON M, et al. Ghrelin enhances gastric emptying in diabetic gastroparesis:a double blind, placebo controlled, crossover study[J]. Gut,2005,54(12):1693- 1698.
[10] CHEANG J Y, MOYLE P M. Glucagon-like peptide-1 (GLP-1)-based therapeutics:current status and future opportunities beyond type 2 diabetes[J]. Chem Med Chem,2018,13(7):662-671.
[11] NOHR M K, PEDERSEN M H, GILLE A, et al. GPR41/FFAR3 and GPR43/FFAR2 as cosensors for short-chain fatty acids in enteroendocrine cells vs FFAR3 in enteric neurons and FFAR2 in enteric leukocytes[J]. Endocrinology,2013,154(10):3552-3564.
Effects of Hedysarum Polybotrys Polysacchcaide on Gastric Motility and Gastrointestinal Hormone of Diabetic Gastroparesis Rats
HE Yunliang, WAN Shengfang, GUO Qian, MA Xinxin, WANG Tongliang, ZHANG Lei, SHU Chang, LI Yaling, YANG Yali
To investigate the effects of Hedysarum polybotrys polysacchcaide (HPS) on gastric motility and gastrointestinal hormone of diabetic gastroparesis (DGP) rats; To explore the mechanism of HPS in improving gastrointestinal motility disorders.12 out of 72 male Wistar rats were randomly selected as blank group, and others were duplicated as DGP model by a single high-dosage intraperitoneal injection of STZ combined with high-sugar and high-fat diets. The model rats were randomly divided into model group, positive medicine group, HPS high-, medium-, and low-dosage groups. The positive medicine group was administrated with 3.5 mg/(kg•d) of Mosabilli, and HPS high-, medium-, and low-dosage groups were administered with HPS at 0.12, 0.06, 0.03 g/(kg•d) respectively, and blank group and model group were given equal volume of pure water for gavage. All rats were given continuous intragastric administration for 8 weeks. During the model-making and medicine-giving, the general conditions, the changes in blood glucose and weight were recorded. After administration for 8 weeks, the slow wave frequency and amplitude of gastric electromyography, gastric emptying rate and intestinal propulsion rate were detected and calculated. The concentration of SS and Ghrelin in gastric antrum, GLP-1 in serum were detected by ELISA. The morphological changes of gastric antrum were observed by HE staining.Compared with the blank group, the general condition of rats in the model group got worse, the blood glucose levels increased significantly (<0.01), the body weight, gastric emptying rate, small intestinal propulsion rate, and the slow wave frequency and amplitude of gastric electromyography decreased significantly (<0.01), SS contents increased significantly (<0.01), Ghrelin and GLP-1 contents were reduced significantly (<0.01). Gastric mucosa was bleeding and edema, and gastric pit wasdamaged. Compared with the model group, the general condition of each treatment group was improved, random blood glucose was reduced significantly (<0.01); the body weight slow wave frequency and amplitude of gastric electromyography, gastric emptying rate and small intestinal advancement rate in positive medicine group and HPS high-dosage group increased significantly (<0.01,<0.05), SS contents significantly reduced (<0.01), the contents of Ghrelin and GLP-1 significantly increased (<0.01), the degree of gastric mucosal damage was significantly reduced, and the structure of the gastric pit was gradually intact.HPS can control blood glucose level, promote gastric emptying, regulate gastrointestinal hormones and repair gastric mucosal damage to improve gastrointestinal motility disorders.
diabetic gastroparesis; Hedysarum polybotrys polysacchcaide; gastriointestinal motility; gastrointestinal hormone; rats
R285.5
A
1005-5304(2021)04-0088-06
10.19879/j.cnki.1005-5304.202010071

国家自然科学基金(82060914、81560718);甘肃中医药大学研究生创新基金(2020CX35);甘肃省中医药管理局科研课题(GZK-2017-3)
万生芳,E-mail:wanshengfang@163.com
(收稿日期:2020-10-09)
(修回日期:2020-11-13;编辑:华强)
