基于调节肠道菌群失衡的四君子汤干预心力衰竭大鼠机制研究
2021-04-21卢永康陈窕圆庄贤勉李健姜小艳徐思思黄彦子黄彬
卢永康,陈窕圆,庄贤勉,李健,姜小艳,徐思思,黄彦子,黄彬
基于调节肠道菌群失衡的四君子汤干预心力衰竭大鼠机制研究
卢永康1,陈窕圆2,庄贤勉1,李健2,姜小艳2,徐思思2,黄彦子2,黄彬2
1.中国医学科学院阜外医院深圳医院,广东 深圳 518000;2.深圳市中医院,广东 深圳 518000
从调节肠道菌群角度探讨四君子汤对心力衰竭大鼠的作用机制。40只雄性Wistar大鼠分为假手术组、模型组、四君子汤组及益生菌组,每组10只。采用冠状动脉左前降支结扎法制备心力衰竭大鼠模型,心电图及TTC、HE染色确定心肌梗死情况,HE染色检测肠黏膜结构变化,治疗前后超声评估心功能,并于治疗后行高通量测序检测肠道菌群的变化。心肌HE染色显示,模型组心肌细胞较假手术组数量减少,细胞形态萎缩,肌纤维疏松;结肠HE染色显示,模型组大鼠肠黏膜结构破坏,细胞排列紊乱,绒毛萎缩、粘连,隐窝减少、排列不规则,腺体正常结构消失、呈空泡状。超声结果显示,治疗前与假手术组比较,模型组大鼠心肌明显变薄,心腔增大,左心室舒张末期内径(LVEDd)、左心室收缩末期内径(LVESd)显著增加,左心室射血分数(LVEF)显著减少(<0.001);治疗后与模型组比较,四君子汤组大鼠LVEDd、LVESd显著减少(<0.001),LVEF显著增加(<0.001)。测序结果显示,与假手术组比较,模型组大鼠出现肠道菌群失衡:在门分类水平,表现为厚壁菌门丰度显著减少(<0.001),拟杆菌门及疣微菌门丰度显著增加(<0.001,<0.05);在属分类水平,表现为乳杆菌属、厌氧芽孢杆菌属丰度显著减少(<0.001,<0.05),菌属、艾克曼菌属丰度显著增加(<0.001,<0.05)。与模型组比较,四君子汤组大鼠肠道菌群失衡显著改善:在门分类水平,厚壁菌门丰度显著增加,拟杆菌门丰度显著减少(<0.05);在属分类水平,乳杆菌属、厌氧芽孢杆菌属丰度显著增加,菌属丰度显著减少(<0.05)。四君子汤通过调节肠道菌群失衡,对大鼠心肌梗死后心力衰竭有一定的治疗作用。
心力衰竭;肠道菌群;四君子汤;中药;大鼠
心力衰竭是心脏结构或功能异常导致心室充盈或射血功能受损的复杂临床综合征,其病因分为缺血性和非缺血性两大类,缺血性心脏病目前是心力衰竭的主要病因之一。近年来,关于肠道菌群与心力衰竭相关性研究受到重视,调节肠道菌群有望成为治疗心力衰竭的新疗法[1-2]。四君子汤出自《太平惠民和剂局方》,由人参、白术、茯苓、甘草组成,具有益气健脾功效,常用于治疗慢性胃炎、消化性溃疡等。研究表明,四君子汤可通过改善肠屏障功能[3]、调节肠道免疫系统[4-5]发挥调节肠道菌群的作用。临床研究表明,四君子汤加减对心力衰竭有一定的疗效[6-7]。四君子汤能否通过调节肠道菌群发挥治疗心力衰竭的作用,目前尚无明确动物实验依据。本研究通过建立心力衰竭大鼠模型,研究四君子汤对肠道菌群的调节作用,探讨其治疗心力衰竭的作用机制。
1 材料与方法
1.1 动物
SPF级Wistar大鼠40只,雄性,体质量(200±20)g,由广州中医药大学实验动物中心提供,动物合格证号SYXK(粤)2018-0002。饲养于温度25 ℃、相对湿度40%~60%环境,12 h光暗循环,常规饲养7 d后进行实验。本实验经广州中医药大学附属深圳市中医院动物实验伦理委员会审批,按照实验动物伦理学标准执行。
1.2 药物及制备
四君子汤(人参、白术、茯苓各9 g,甘草6 g), 饮片购自广州中医药大学附属深圳市中医院,常规煎煮2次,合并煎液并浓缩至含原药材0.3 g/mL。复方乳酸杆菌片,通化金马药业集团股份有限公司,批号20190810,配制成0.14 g/mL复方乳酸杆菌溶液。
1.3 主要试剂与仪器
TTC染色液(武汉博士德生物工程有限公司),苏木素-伊红染色液(武汉博士德生物工程有限公司)。Sonix TOUCH超声诊断系统(加拿大超声医疗技术有限公司),RM6240E/EC多道生理信号采集处理系统(成都仪器厂),DW-3000B小动物人工呼吸机(广州必特生物科技有限公司)。
1.4 分组及造模
40只大鼠随机分为假手术组、模型组、四君子汤组、益生菌组,每组10只。按照文献[8]方法,采用冠状动脉左前降支结扎法制备心肌梗死后心力衰竭模型。大鼠腹腔注射3%戊巴比妥(45 mL/kg)麻醉,仰卧位固定并行气管插管,连接小动物呼吸机,潮气量6 mL,频率80次/min。于左胸第3肋间沿肋骨走向开胸,暴露心脏,以左冠状静脉为标志,找到冠状动脉前降支并以5-0缝线结扎,结扎位置以下心室前壁变白,收缩力减弱,心电图见ST段抬高,表明出现心肌梗死,随后关胸并继续饲养2周,以超声检测其心功能可见明显下降,表示心力衰竭模型制备成功。假手术组除不结扎前降支外,其余处理同模型组。
1.5 给药
给药剂量按照人和大鼠体表面积进行等效剂量折算,四君子汤组予0.693 g/(kg•d)四君子汤煎液,益生菌组予0.32 g/(kg•d)复方乳酸杆菌溶液,假手术组及模型组予等量生理盐水,连续14 d。
1.6 TTC染色
冠状动脉前降支结扎后24 h,各组随机抽取1只大鼠处死,取左心室,切片(2 mm),以TTC染色液浸泡,37 ℃避光15 min,观察心肌梗死情况。
1.7 HE染色
模型制备成功后,各组随机抽取1只大鼠处死,取左心室,距肛门约5 cm处取约0.5 cm结肠组织,4 ℃、4%多聚甲醛溶液固定,常规石蜡切片,HE染色观察左心室及结肠黏膜病理形态。
1.8 超声心动图
治疗前后大鼠进行超声检查。大鼠麻醉后仰卧位固定,将超声探头置于大鼠心前区,选取胸骨旁左室长轴切面及腹主动脉长轴切面,探头频率5 MHz,以M型超声测量左心室舒张末期内径(LVEDd)和左心室收缩末期内径(LVESd),系统自动计算左心室射血分数(LVEF)。
1.9 生物信息学分析
治疗结束后处死剩余大鼠,距肛门约5 cm处结肠内取粪便1粒置于冻存管,-80 ℃冰箱保存,随后进行测序(委托上海市凌恩生物科技有限公司代为进行)。测序技术:Illumina 250 MiSeq高通量测序平台;测序模式:微生物组细菌16S rRNA基因V3~V4区测序。使用QIIME程序对测序得到的序列进行生物信息学分析,包括对序列质量进行质控和过滤,然后用uParse软件对有效数据在97%水平进行操作分类单元聚类分析(分类水平包括域、界、门、纲、目、科、属、种),本文主要在门、属2个分类水平统计分析菌群结构。
1.10 统计学方法
2 结果
2.1 急性心肌梗死评价
冠状动脉前降支结扎前大鼠心电图正常,ST段未见明显抬高,结扎后可见ST段明显抬高,见图1。术中肉眼可见其所支配范围的心肌由红色变为白色,室壁运动减弱。
TTC染色结果显示,大鼠正常心肌组织染成红色,梗死区呈白色,见图2。提示前降支结扎后发生急性心肌梗死。
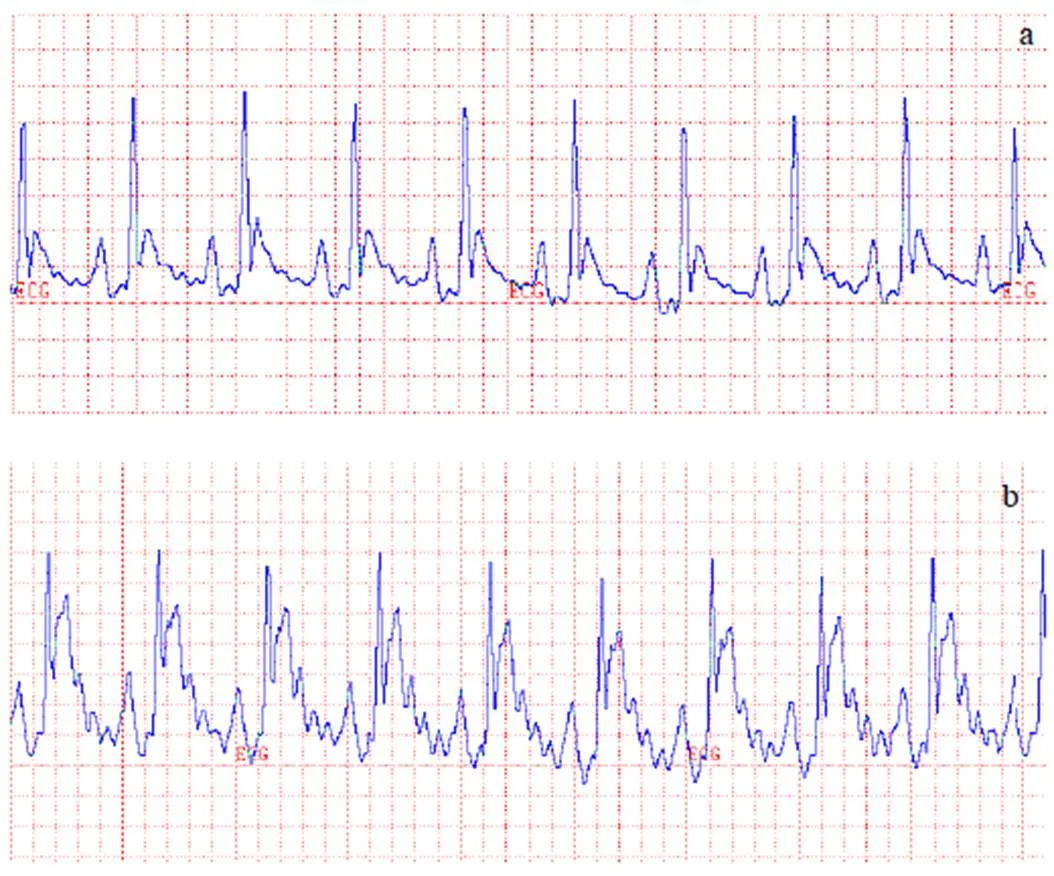
注:a.结扎前;b.结扎后即刻

注:a.正常大鼠;b.心肌梗死大鼠
2.2 HE染色结果
心肌HE染色结果显示,模型组心肌细胞较假手术组数量减少,细胞形态萎缩,肌纤维疏松,见图3。结肠HE染色结果显示,假手术组肠黏膜结构完整,绒毛排列整齐、致密,模型组大鼠肠黏膜结构被破坏,细胞排列紊乱,绒毛萎缩、粘连,隐窝减少、排列不规则,腺体正常结构消失、呈空泡状,提示心肌梗死发生后,其肠道内环境明显改变,见图4。

图3 大鼠心肌组织形态(HE染色)
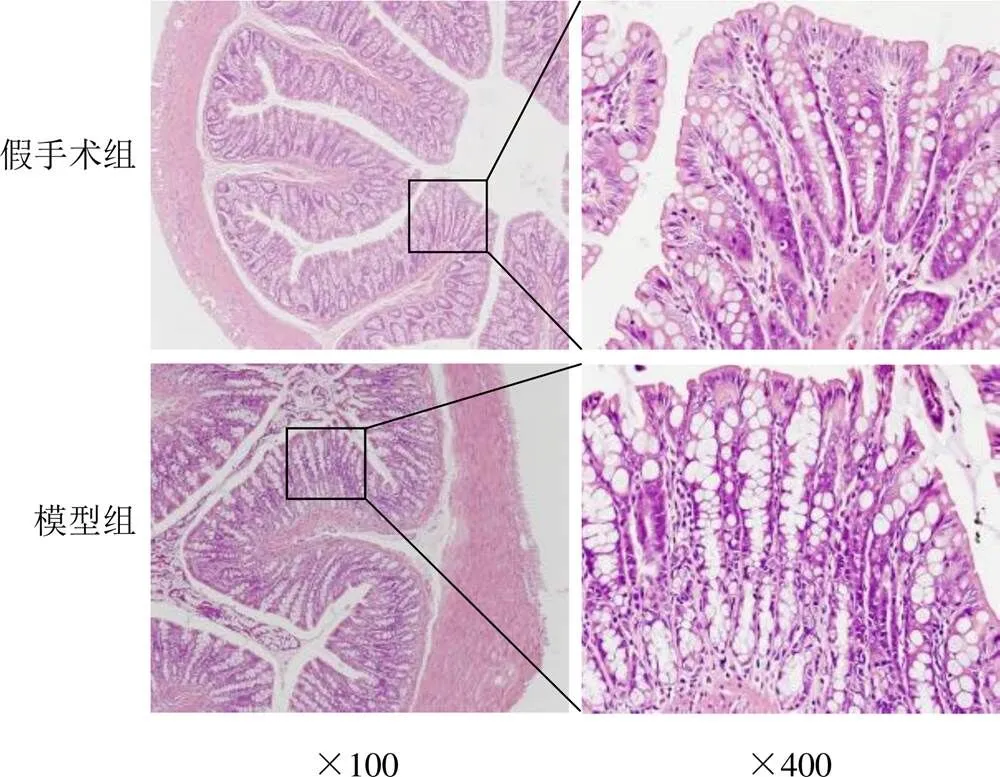
图4 大鼠结肠组织形态(HE染色)
2.3 心功能变化
二维超声及M型超声显示,模型组大鼠心肌明显变薄,心腔明显增大,见图5。各组大鼠治疗前后心功能指标结果显示:与假手术组比较,治疗前模型组、四君子汤组及益生菌组LVEDd、LVESd明显增加,LVEF明显减少(<0.001);治疗后四君子汤组和益生菌组LVEDd、LVESd、LVEF与假手术组比较差异虽有统计学意义(<0.001),但可见四君子汤组LVEDd、LVESd、LVEF呈改善趋势;与模型组治疗后比较,四君子汤组LVEDd、LVESd均明显减少,LVEF明显增加(<0.001),益生菌组各指标差异均无统计学意义(>0.05)。见表1。

图5 大鼠超声心动图

表1 各组大鼠治疗前后心功能指标比较(±s)
注:与假手术组治疗前比较,**<0.001;与假手术组治疗后比较,△△<0.001;与模型组治疗后比较,##<0.001
2.4 肠道菌群多样性分析
在门分类水平,各组大鼠肠道菌群相对丰度较高的5个菌门依次为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria),见图6。假手术组肠道优势菌群主要为厚壁菌门及拟杆菌门,以厚壁菌门为主,约为拟杆菌门5倍。与假手术组比较,其余3组厚壁菌门丰度减少(<0.001),拟杆菌门和疣微菌门丰度增加(<0.001,<0.05);与模型组比较,四君子汤组厚壁菌门丰度增加,拟杆菌门丰度减少(<0.05),见表2。提示心力衰竭大鼠存在肠道菌群失衡,在门分类水平,主要表现为厚壁菌门丰度显著减少,拟杆菌门及疣微菌门丰度显著增加,经四君子汤治疗后,菌群失衡情况有所改善。

注:sham-1~sham-8.假手术组;model-1~model-8.模型组;SJZT-1~SJZT-8.四君子汤组;YSJ-1~YSJ-8.益生菌组

表2 各组大鼠肠道菌群门水平丰度比较(±s,%)
注:与假手术组比较,*<0.05,**<0.001;与模型组比较,#<0.05
在属分类水平,所有大鼠肠道菌群相对丰度前5位分别为乳杆菌属(,属厚壁菌门)、菌属(属拟杆菌门)、艾克曼菌属(,属疣微菌门)、厌氧芽孢杆菌属(,属厚壁菌门)、普雷沃氏菌属(,属拟杆菌门),见图7、图8。与假手术组比较,其余3组大鼠乳杆菌属丰度减少,菌属、艾克曼菌属丰度增加(<0.05,<0.001),四君子汤组厌氧芽孢杆菌属丰度与假手术组相比无明显差异(>0.05),而模型组及益生菌组该菌属丰度明显减少(<0.05);与模型组比较,四君子汤组大鼠乳杆菌属、厌氧芽孢杆菌属丰度增加,菌属丰度减少(<0.05),艾克曼菌属丰度虽较模型组减少,但差异无统计学意义(>0.05);益生菌组与模型组比较,各菌属丰度差异均无统计学意义(>0.05)。见表3。提示心力衰竭大鼠存在肠道菌群失衡,在属分类学水平主要表现为乳杆菌属、厌氧芽孢杆菌属丰度减少,菌属、艾克曼菌属丰度增加,经四君子汤治疗后,菌群失衡有所改善,乳杆菌属及厌氧芽孢杆菌属丰度较模型组增加,厌氧芽孢杆菌属丰度恢复至正常水平,菌属丰度减少,乳杆菌属及菌属丰度与假手术组比较仍存在差异,但较模型组改善。

图7 各组大鼠肠道菌群属水平主要构成分析

图8 各组大鼠肠道菌群属水平构成

表3 各组大鼠肠道菌群属水平丰度比较(±s,%)
注:与假手术组比较,*<0.05,**<0.001;与模型组比较,#<0.05
3 讨论
肠道菌群对心力衰竭的影响已有一定的研究基础,经典的“心-肠”理论认为心力衰竭导致肠道灌注不足、肠道屏障功能受损、细菌及内毒素移位、肠道代谢失衡等,最终引起肠道菌群失衡[1]。对心力衰竭患者行结肠镜检查发现,其肠黏膜形态与结构较正常人群不同,肠壁增厚、水肿明显,肠黏膜通透性增加[9]。本研究发现,心力衰竭大鼠肠黏膜细胞排列紊乱,绒毛萎缩、粘连,隐窝减少、排列不规则,腺体正常结构消失、呈空泡化,这可能是导致肠道菌群失衡的关键原因。正常情况下,在门分类水平,大鼠肠道优势菌群为厚壁菌门及拟杆菌门,两者比例约为5∶1,当心力衰竭发生后,厚壁菌门比例明显下降,拟杆菌门、疣微菌门等比例明显增加。这与临床上对心力衰竭患者肠道菌群的分析结果一致[10-12]。
目前认为,肠道菌群主要从炎症及代谢失衡方面参与并影响心力衰竭的发生发展。前者由于菌群失衡引起条件致病菌增加,肠道黏膜屏障破坏,循环中脂多糖、肽聚糖等促炎介质增加[13],引起全身性炎症反应,对心肌细胞产生抑制作用[14];后者则因为正常菌群产生大量有助于人体消化、吸收营养物质的酶系,也能产生如短链脂肪酸、胆汁酸及多种维生素等,在肠道细胞营养支持、维持肠道黏膜屏障功能、局部抗炎、调节免疫等方面起重要作用[15-16]。
以调节肠道菌群为靶点治疗各种心血管疾病,如高血压、血脂异常及心力衰竭等,受到广泛关注。常见的治疗手段包括饮食调节、粪菌移植、益生菌/益生元及抗生素等。补充外源性益生菌/益生元作为治疗手段,目前仍存在争议。有动物实验显示,益生菌治疗心力衰竭大鼠,具有改善心室重构和心功能的作用[17],但也有临床研究表明,服用益生菌/益生元后并无相应效果[18]。在本研究中,益生菌组大鼠肠道菌群失衡及心功能未见改善,这可能与胃酸对外源性活菌杀灭作用及外源性活菌在肠道定植力不足等因素相关。本研究发现,四君子汤能增加大鼠肠道厚壁菌门丰度,降低拟杆菌门丰度,增加乳杆菌属、厌氧芽孢杆菌属丰度,降低菌属丰度,调节大鼠肠道菌群失衡。同时,经四君子汤治疗后,大鼠心功能较模型组明显改善,推测其机制之一可能为肠道中厚壁菌将食物中纤维转化为短链脂肪酸,这是肠黏膜细胞能量来源之一。厚壁菌丰度增加,有助于改善肠黏膜细胞能量供应,增强其屏障功能,同时抑制肠道及机体炎症反应[15];心力衰竭患者体内氧化三甲胺水平明显升高并与不良预后相关[19],而乳杆菌可通过促进胆汁酸生成进而减少氧化三甲胺生成[20]。
本研究表明,四君子汤可通过调节大鼠肠道菌群失衡,改善心功能,治疗心力衰竭。经四君子汤治疗后,模型大鼠心功能较正常情况下虽仍存在一定差距,但也提示肠道菌群可能为治疗心力衰竭的靶点。
[1] ROGLER G, ROSANO G. The heart and the gut[J]. Eur Heart J, 2014,35(7):426-430.
[2] TANG W H, KITAI T, HAZEN S L. Gut microbiota in cardiovascular health and disease[J]. Circ Res,2017,120(7):1183-1196.
[3] 杨春佳,苏德望,杨龙友,等.四君子汤改善辐射小鼠肠道菌群失调的研究[J].黑龙江医药科学,2006,29(6):49-50.
[4] 张大鹏,周联,张志敏,等.四君子汤总多糖对免疫抑制小鼠肠道sIgA的影响及其机制研究[J].中药新药与临床药理,2010,21(1):11-14.
[5] 吴秀,周联,罗霞,等.四君子汤多糖对脾虚小鼠肠道菌群及免疫功能的影响[J].中药药理与临床,2014,30(2):12-14.
[6] 于冬梅,任国峰.四君子汤合生脉饮加减方治疗慢性心力衰竭疗效观察[J].中西医结合心血管病电子杂志,2017,5(1):180.
[7] 顾广富,卞震炯,陈旭.四君子汤合真武汤加味对慢性心力衰竭患者ET、CGRP的影响[J].贵阳中医学院学报,2014,36(4):77-79.
[8] HOUSER S R, MARGULIES K B, MURPHY A M, et al. Animal models of heart failure:a scientific statement from the American Heart Association[J]. Circ Res,2012,111(1):131-150.
[9] SANDEK A, SWIDSINSKI A, SCHROEDL W, et al. Intestinal blood flow in patients with chronic heart failure:a link with bacterial growth, gastrointestinal symptoms, and cachexia[J]. J Am Coll Cardiol,2014,64(11):1092-1102.
[10] MAYERHOFER C, KUMMEN M, HOLM K, et al. Low fibre intake is associated with gut microbiota alterations in chronic heart failure[J]. ESC Heart Fail,2020,7(2):456-466.
[11] SANDEK A, BAUDITZ J, SWIDSINSKI A, et al. Altered intestinal function in patients with chronic heart failure[J]. J Am Coll Cardiol,2007,50(16):1561-1569.
[12] PASINI E, AQUILANI R, TESTA C, et al. Pathogenic gut flora in patients with chronic heart failure[J]. JACC Heart Fail,2016, 4(3):220-227.
[13] ANKER S D, EGERER K R, VOLK H D, et al. Elevated soluble CD14 receptors and altered cytokines in chronic heart failure[J]. Am J Cardiol,1997,79(10):1426-1430.
[14] AVLAS O, FALLACH R, SHAINBERG A, et al. Toll-like receptor 4 stimulation initiates an inflammatory response that decreases cardiomyocyte contractility[J]. Antioxid Redox Signal,2011, 15(7):1895-1909.
[15] CHEN L, SUN M, WU W, et al. Microbiota metabolite butyrate differentially regulates Th1 and Th17 cells’differentiation and function in induction of colitis[J]. Inflamm Bowel Dis,2019, 25(9):1450-1461.
[16] RUSSELL D W. The enzymes, regulation, and genetics of bile acid synthesis[J]. Annu Rev Biochem,2003,72:137-174.
[17] GAN X T, ETTINGER G, HUANG C X, et al. Probiotic administration attenuates myocardial hypertrophy and heart failure after myocardial infarction in the rat[J]. Circ Heart Fail,2014,7(3):491-499.
[18] DEWULF E M, CANI P D, CLAUS S P, et al. Insight into the prebiotic concept:lessons from an exploratory, double blind intervention study with inulin-type fructans in obese women[J]. Gut,2013, 62(8):1112-1121.
[19] TANG W H, WANG Z, FAN Y, et al. Prognostic value of elevated levels of intestinal microbe-generated metabolite trimethylamine-N-oxide in patients with heart failure:refining the gut hypothesis[J]. J Am Coll Cardiol,2014,64(18):1908-1914.
[20] CHEN M L, YI L, ZHANG Y, et al. Resveratrol attenuates trimethylamine-N-oxide (TMAO)-induced atherosclerosis by regulating TMAO synthesis and bile acid metabolism via remodeling of the gut microbiota[J]. mBio,2016,7(2):e2210-e2215.
Mechanism Study ofDecoction on Rats with Heart Failure Through Regulating the Imbalance of Intestinal Flora
LU Yongkang1, CHEN Tiaoyuan2, ZHUANG Xianmian1, LI Jian2, JIANG Xiaoyan2, XU Sisi2, HUANG Yanzi2, HUANG Bin2
To explore the mechanism ofDecoction on rat model with heart failure from the perspective of regulating intestinal flora.Totally 40male Wistar rats were divided into sham group, model group,Decoction group and probiotics group. Heart failure model was prepared by myocardial infarction induced by ligation of left anterior descending coronary artery, and myocardial infarction was confirmed by ECG, myocardium TTC and HE staining. Colon HE staining was performed for evaluation of intestinal mucosa structure under heart failure. Echocardiography was performed to evaluate cardiac function before and after treatment. The bacterial 16S rRNA sequencing was executed to detect intestinal flora.Myocardium HE staining showed that amount of cardiomyocytes of model group was less than that of the sham group, cell morphologic changes was atrophied, and myofiber was loose. Colon HE staining showed that damaged intestinal mucosal structure of the model group, disordered cell arrangement, atrophied and adhesive villi, irregularly arranged and reduced intestinal crypts, as well as the normal structure of the glands disappeared and becamed vacuolated. Echocardiography showed that myocardium of model group was significantly thinner than that of sham group before treatment, and heart chambers were enlarged, LVEDd and LVESd significantly increased, LVEF was significantly reduced (<0.001); after treatment, compared with model group, LVEDd and LVESd were markedly reduced (<0.001), as well as LVEF was markedly increased (<0.001) inDecoction group. The sequencing results showed that compared with sham group, imbalance of intestinal flora was observed in model group: at the phylum level, the abundance of Firmicutes was significantly reduced (<0.001), while the abundance of Bacteroidetes and Verrucomicrobia were significantly increased (<0.001,<0.05); at the genus level, the abundance ofandwas significantly reduced (<0.001,<0.05), while the abundance ofandsignificantly increased (<0.001,<0.05). Compared with model group, imbalance of intestinal flora inDecoction group was obviously improved: at the phylum level, the abundance of Firmicutes increased and the abundance of Bacteroidetes decreased, both with statistical significance (<0.05); at the genus level, the abundance ofandincreased, and the abundance ofdecreased, all with statistical significance (<0.05).Decoction can play a certain therapeutic effect on rat model with heart failure after myocardial infarction by regulating the imbalance of intestinal flora.
heart failure; intestinal flora;Decoction; Chinese herb; rats
R285.5
A
1005-5304(2021)04-0081-07
10.19879/j.cnki.1005-5304.202008395

深圳市科技计划项目(JCYJ20170307155824718)
黄彬,E-mail:677825889@qq.com
(收稿日期:2020-08-25)
(修回日期:2020-09-18;编辑:华强)
