基于NF-κB信号通路的溃结宁膏穴位敷贴对溃疡性结肠炎大鼠结肠黏膜炎症反应的影响
2021-04-21娄余肖运婷朱莹王燚霈谢超群
娄余,肖运婷,朱莹,王燚霈,谢超群
基于NF-κB信号通路的溃结宁膏穴位敷贴对溃疡性结肠炎大鼠结肠黏膜炎症反应的影响
娄余1,肖运婷1,朱莹2,王燚霈1,谢超群1
1.湖南中医药大学第二附属医院,湖南 长沙 410005; 2.湖南中医药大学第一附属医院,湖南 长沙 410007
观察溃结宁膏穴位敷贴对溃疡性结肠炎(UC)大鼠结肠黏膜炎症反应的影响,从NF-κB信号通路角度探讨其作用机制。SD大鼠随机分为正常组、模型组、非穴位敷贴组、穴位敷贴组及柳氮磺吡啶(SASP)组。采用番泻叶、腺嘌呤分阶段灌胃结合外因干预,并予2,4,6-三硝基苯磺酸与乙醇复合物灌肠制备UC病证结合动物模型。穴位敷贴组予溃结宁膏穴位敷贴“足三里”“天枢”“肾俞”“脾俞”“大肠俞”“膈俞”,非穴位敷贴组予溃结宁膏敷贴臀部肌肉丰厚处,SASP组予SASP溶液灌胃,正常组和模型组予等体积生理盐水灌胃,每日1次,干预28 d。观察大鼠一般情况、结肠黏膜损伤指数(CMDI)评分、结肠组织病理变化;ELISA检测血清白细胞介素(IL)-1β、IL-6及肿瘤坏死因子-α(TNF-α)含量,Western blot检测结肠组织IκB激酶-α(IKKα)、核因子-κB p65(NF-κB p65)、NF-κB抑制蛋白α(IκBα)蛋白表达。与正常组比较,模型组大鼠CMDI评分明显升高(<0.01),血清IL-1β、IL-6和TNF-α含量显著增加(<0.01,<0.05),结肠组织NF-κB p65和IKKα蛋白表达显著升高(<0.01),IκBα蛋白表达显著降低(<0.01);与模型组比较,穴位敷贴组和SASP组大鼠CMDI评分明显降低(<0.05,<0.01),血清IL-1β、IL-6及TNF-α含量明显降低(<0.01,<0.05),结肠组织NF-κB p65和IKKα蛋白表达明显降低(<0.01),IκBα蛋白表达明显升高(<0.01,<0.05)。溃结宁膏穴位敷贴通过调控NF-κB信号通路IKKα、NF-κB p65和IκBα蛋白的表达,降低血清IL-1β、IL-6及TNF-α的含量,抑制结肠黏膜炎症反应,进而控制UC病情发展。
溃疡性结肠炎;溃结宁膏;穴位敷贴;NF-κB信号通路;肿瘤坏死因子-α;白细胞介素-6;白细胞介素-1β;大鼠
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性非特异性炎症性肠病,临床表现为腹痛、腹泻及黏液脓血便,呈长期迁延、反复发作的慢性过程,难治愈,复发率高。目前,临床上主要采取对症治疗缓解症状,且需长期服药。UC发病机制涉及多因素,一般认为与遗传易感性、上皮屏障缺陷、免疫紊乱、环境因素等有关[1-2],其中肠道免疫功能紊乱是主要原因[3]。NF-κB信号通路是UC炎症反应的重要信号转导通路,核因子-κB(NF-κB)是通路中重要的调控因子,可促进多种炎症因子的转录,是治疗UC的关键靶点[4-5]。
根据临床症状,UC属中医学“肠澼”“泄泻”“痢疾”等范畴,《景岳全书》有“凡病里急后重者,病在广肠最下之处,而其病本则不在广肠,而在脾肾”。脾主一身之运化,肾寓一身之真阳,泄泻日久,脾阳不振,累及肾阳,不能温煦脾土,运化失常,脾虚湿盛,湿邪壅滞肠络,气血瘀滞,血败肉腐,内溃成疡,属本虚标实,即脾肾阳虚为本,血瘀为标,基本病机可用“脾肾阳虚夹瘀”概括。因此,针对“虚、瘀”状态下UC的病机,立“温阳化瘀”之法,以达温肾暖脾治其本、活血化瘀治其标的目的,自制溃结宁膏。在中医辨证和经穴-脏腑相关理论指导下,通过穴位刺激使药性贯经络传至脏腑以治疗本病,患者依从性好,操作简单方便,疗效确切。溃结宁膏穴位敷贴为本课题组多年的经验治法,前期研究发现,其可通过下调Toll样受体4(toll-like receptor 4,TLR4)、髓样分化因子88(myeloid differentiation factor 88,MyD88)的表达,抑制NF-κB活化,减轻肠道炎症反应[6]。本实验在前期研究基础上,观察溃结宁膏穴位敷贴对UC大鼠结肠黏膜IκB激酶-α(IκB kinase,IKKα)、NF-κB p65和NF-κB抑制蛋白α(NF-κB inhibitor-α,IκBα)表达的调控,进一步探讨溃结宁膏穴位敷贴对UC“虚、瘀”状态下结肠黏膜的免疫调节作用,以期为临床应用提供实验依据。
1 材料与方法
1.1 动物
SPF级雄性SD大鼠50只,体质量180~220 g,湖南斯莱克景达实验动物有限公司提供,动物许可证号SCXK(湘)2016-0002。饲养于湖南中医药大学SPF级实验室,室温20~25 ℃,自然昼夜节律光照,自由摄食饮水,适应性喂养1周。
1.2 药物
溃结宁膏(炮附子、细辛、延胡索、赤芍、丁香、芥子、生姜)、无药物巴布剂基质敷贴(聚丙烯酸钠、明胶、高岭土、甘羟铝、蓖麻油、甘油、聚乙烯醇),均由湖南中医药大学第二附属医院药剂科制备。柳氮磺吡啶片(SASP),上海信谊天平药业有限公司,批号09190501。
1.3 主要试剂与仪器
2,4,6-三硝基苯磺酸(TNBS),美国Sigma公司,货号P2297;腺嘌呤,美国Sigma公司,货号A8626;白细胞介素(IL)-6、IL-1β、肿瘤坏死因子-α(TNF-α)试剂盒,上海酶联生物科技有限公司,货号分别为ml102828、ml1002859、ml037361;NF-κB p65、IKKα及IκBα抗体,英国Abcam公司,货号分别为ab16502、ab32041、ab32518;β-actin抗体,美国Proteintech公司,货号66009-1-Ig。生物样品均质仪(杭州奥盛仪器有限公司,BioPrep-24),台式高速冷冻离心机(湖南湘仪动力测试仪器有限公司,H1650R),DYCZ-24DN型电泳槽、DYCZ-40D转膜仪(北京六一仪器厂),多功能酶标分析仪(深圳市汇松科技发展有限公司,MB-530)。
1.4 分组及造模
SD大鼠50只随机分为正常组(10只)和造模组(40只)。参照课题组前期方法进行模型制备与评价[7]。每日给予大鼠番泻叶、腺嘌呤分阶段灌胃,连续4周。于第29日禁食不禁水24 h,大鼠腹腔注射10%水合氯醛(4 mL/kg)麻醉。在液体石蜡油润滑下,将16号灌胃针头轻柔插入距肛门约8 cm处,将TNBS按100 mg/kg(约TNBS原液0.2 mL/100 g)加入50%乙醇(0.25 mL)制成混合试剂,充分混匀后注入大鼠肠腔,结束后推入0.3 mL空气,再将灌胃针头缓慢拔出,轻揉大鼠腹部1 min,捏紧大鼠肛门并提尾倒置2 min后将大鼠平放在鼠笼中,自然清醒后常规饮食。造模过程中观察大鼠一般活动状态,造模结束后,于造模组随机抽取4只、正常组1只处死,取结肠组织,观察其形态学改变。成模后可见大鼠毛发稀疏少泽,神态萎靡,嗜睡懒动,饮食明显减少,小便清长,大便溏泄且/或伴有黏液脓血便;结肠组织可见局部溃疡灶、糜烂、充血、水肿等改变;光学显微镜下可见炎性细胞浸润、黏膜层缺损、腺体减少及排列紊乱等病理改变。将成模大鼠随机分为模型组、非穴位敷贴组、穴位敷贴组及SASP组,每组9只。
1.5 干预
取穴参考《实验针灸学》[8],“足三里”位于膝关节下侧、腓骨小头下缘5 mm处,“天枢”位于脐中旁开5 mm,“脾俞”位于第12胸椎棘突下旁开5 mm,“肾俞”位于第2腰椎棘突下旁开5 mm,“大肠俞”位于第4腰椎棘突下旁开5 mm,“膈俞”位于第7胸椎棘突下旁开5 mm。大鼠选穴定位后进行备皮,贴药后予鼠夹固定。正常组和模型组给予巴布剂基质穴位敷贴加生理盐水(5 mL/kg)灌胃,穴位敷贴组给予溃结宁膏穴位敷贴加生理盐水(5 mL/kg)灌胃,非穴位敷贴组给予溃结宁膏敷贴臀部肌肉丰厚处加生理盐水(5 mL/kg)灌胃,SASP组巴布剂基质穴位敷贴加SASP溶液(用生理盐水配成10 mg/mL溶液)50 mg/kg灌胃。造模成功后3 d开始干预。每日1次,每次2 h,每次贴一侧,左右交替,给药疗程均为28 d。
1.6 标本采集
给药结束后,大鼠禁食12 h,行腹腔麻醉,下腹主动脉采血,3000 r/min离心15 min,吸取上清液,置于-20 ℃保存备用。距肛门6~10 cm取肠段,冰生理盐水清洗,滤纸吸干,一部分置于4%多聚甲醛中密封避光4 ℃保存,用于HE染色,另一部分置冻存管-80 ℃保存,用于Western blot检测。
1.7 一般观察
实验期间每日观察大鼠精神活动状态、体质量、进食量、毛发光泽度、大便性状及便血情况等。
1.8 大鼠结肠黏膜损伤指数评分
采集结肠组织标本,进行结肠黏膜损伤指数(CMDI)评分[9]:黏膜无损伤,0分;黏膜充血、水肿,无溃疡,1分;黏膜充血、水肿、轻度糜烂及无溃疡,2分;黏膜充血、水肿、中度糜烂及有单个溃疡,3分;黏膜充血、水肿、高度糜烂及有多处溃疡,4分;黏膜充血、水肿、重度糜烂及有>1 cm溃疡,5分。
1.9 HE染色
取大鼠部分结肠组织置于4%多聚甲醛中固定,常规脱水、石蜡包埋、切片,染色,中性树胶封片,光学显微镜下观察结肠黏膜组织形态。
1.10 血清炎症因子含量检测
取大鼠血清,采用ELISA测定血清IL-1β、IL-6及TNF-α水平,严格按照试剂盒说明书进行操作,最后将孔板置于多功能酶标仪,测定波长450 nm处各孔吸光度(OD值)。
1.11 Western blot检测大鼠结肠组织IκB激酶-α、NF-κB抑制蛋白α、核因子-κB p65蛋白表达
采用RIPA裂解液提取结肠组织蛋白,用BCA法检测蛋白浓度,将制备好的样品和Marker加入上样孔,电泳分离后转膜,封闭。加入IKKα、NF-κB p65及IκBα一抗(1∶20 000、1∶2000、1∶5000)及内参β-actin(1∶5000),室温孵育90 min。PBST缓冲液洗膜,加入HRP标记的二抗(1∶5000),室温共同孵育60 min。ECL显色曝光,采用Quantity One灰度分析软件进行分析,以目的蛋白灰度值与内参蛋白灰度值比值作为目的蛋白的相对表达量。
1.12 统计学方法
2 结果
2.1 一般状况
干预过程中模型组大鼠死亡2只,非穴位敷贴组、穴位敷贴组及SASP组各死亡1只。正常组大鼠饮食、活动正常,精神状态良好,毛发光泽,大便成形,肛周未见异常分泌物;模型组大鼠从造模第2周开始直至造模结束,饮食减少,相继出现神态萎靡,嗜睡懒动,毛发稀疏少泽,甚则弓背蜷缩聚堆,小便清长,大便质软,甚者稀溏,肛周见黏液脓血分泌物,部分大鼠出现腹部胀满;穴位敷贴组及SASP组大鼠症状、体征均有不同程度改善,体质量增加,饮食量增加,基本接近正常组;非穴位敷贴组大鼠症状、体征、体质量等较模型组有所改善,但明显低于穴位敷贴组和SASP组。
2.2 溃结宁膏穴位敷贴对模型大鼠结肠黏膜损伤指数评分的影响
治疗结束后,采集大鼠结肠组织标本进行CMDI评分。与正常组比较,模型组大鼠结肠黏膜可见充血、水肿、糜烂明显,有多处溃疡病灶,CMDI评分显著升高,差异有统计学意义(<0.01);与模型组比较,穴位敷贴组、SASP组大鼠结肠黏膜充血、水肿程度明显减轻,少数有糜烂及小溃疡灶,CMDI评分明显下降,差异有统计学意义(<0.05,<0.01)。结果见图1、表1。
2.3 溃结宁膏穴位敷贴对模型大鼠结肠组织病理形态的影响
正常组大鼠结肠组织结构完整,腺体排列规整,无炎性细胞浸润,未见水肿、充血、糜烂、溃疡等情况;模型组大鼠结肠黏膜上皮部分缺损,腺体减少,且排列紊乱,黏膜水肿、充血明显,大量炎性细胞浸润,杯状细胞减少,形成溃疡灶;非穴位敷贴组结肠黏膜缺损,腺体排列紊乱,黏膜水肿,可见炎性细胞浸润;穴位敷贴组及SASP组结肠组织损伤均有改善,黏膜溃疡减少,腺体结构排列尚规则,充血、水肿明显减轻,伴有少量炎性细胞浸润。见图2。

注:A.正常组;B.模型组;C.非穴位敷贴组;D.穴位敷贴组;E. SASP组
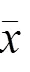
表1 各组大鼠CMDI评分比较(±s)
注:与正常组比较,**<0.01;与模型组比较,#<0.05,##<0.01

注:A.正常组;B.模型组;C.非穴位敷贴组;D.穴位敷贴组;E. SASP组
2.4 溃结宁膏穴位敷贴对模型大鼠血清白细胞介素-1β、白细胞介素-6和肿瘤坏死因子-α含量的影响
与正常组比较,模型组大鼠血清IL-1β、IL-6和TNF-α含量明显增加,差异均有统计学意义(<0.01);与模型组比较,穴位敷贴组、SASP组大鼠血清IL-1β、IL-6和TNF-α含量明显减少,差异均有统计学意义(<0.01,<0.05);与非穴位敷贴组比较,穴位敷贴组大鼠血清IL-1β、IL-6和TNF-α含量明显减少,差异均有统计学意义(<0.05,<0.01)。结果见表2。
2.5 溃结宁膏穴位敷贴对模型大鼠结肠组织IκB激酶-α、NF-κB抑制蛋白α、核因子-κB p65表达的影响
与正常组比较,模型组大鼠结肠组织IKKα和NF-κB p65蛋白表达明显升高,IκBα蛋白表达明显降低,差异均有统计学意义(<0.01);与模型组比较,非穴位敷贴组、穴位敷贴组、SASP组大鼠结肠组织IKKα和NF-κB p65蛋白表达明显降低,穴位敷贴组、SASP组大鼠结肠组织IκBα蛋白表达明显升高,差异均有统计学意义(<0.01,<0.05);与非穴位敷贴组比较,穴位敷贴组大鼠结肠组织NF-κB p65和IKKα蛋白表达明显降低,IκBα蛋白表达明显升高,差异有统计学意义(<0.01)。结果见图3、表3。
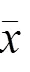
表2 各组大鼠血清IL-1β、IL-6和TNF-α含量比较(±s,pg/mL)
注:与正常组比较,**<0.01;与模型组比较,#<0.05,##<0.01;与非穴位敷贴组比较,&<0.05,&&<0.01

注:A.正常组;B.模型组;C.穴位敷贴组;D.非穴位敷贴组;E. SASP组
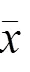
表3 各组大鼠结肠组织IKKα、NF-κB p65、IκBα蛋白表达比较(±s)
注:与正常组比较,**<0.01;与模型组比较,#<0.05,##<0.01;与非穴位敷贴组比较,&&<0.01
3 讨论
临床上UC患者病情迁延难愈、病程长,常出现不同程度的阳虚表现。研究发现,慢性缓解期UC以脾肾阳虚型为主[10],因阳虚失于温煦,血行滞缓,加之病情迁延难愈,“久病必瘀”,故其病理性质为本虚标实,即脾肾阳虚为本,血瘀为标。溃结宁膏方君以附子温肾暖脾以散寒凝;臣以细辛温脾散寒,丁香温补脾肾;佐以赤芍散瘀止痛,延胡索活血行气止痛,寓“行血则便脓自愈,调气则后重自除”之意;芥子行气机、通经络,长于治寒疾凝结之证,本方取其行散之性,助诸药之性达病所,为佐药;生姜温脾散寒,调和药性,为使。诸药制成膏剂贴敷于穴位表面,共奏温肾暖脾、活血化瘀之效。课题组前期体外透皮实验证实溃结宁膏透皮效果较好[11]。在经穴-脏腑相关理论指导下,取穴“足三里”“天枢”“肾俞”“膈俞”“脾俞”“大肠俞”进行溃结宁膏敷贴,依据经络“联系上下,沟通表里”,使药性贯经络传至脏腑,发挥治疗作用。本研究中,模型组大鼠结肠黏膜糜烂、充血、水肿明显,有多处溃疡灶;HE染色结果显示,大鼠结肠黏膜上皮缺损严重,分布有浅表性溃疡,腺体减少,腺腔不规则,排列紊乱,黏膜水肿、充血明显,伴有大量炎性细胞浸润。经溃结宁膏穴位敷贴后,大鼠结肠黏膜损伤明显减轻,黏膜上皮较完整,糜烂、充血、水肿明显改善,伴少量炎性细胞浸润,表明溃结宁膏穴位敷贴能有效抑制UC炎症反应,修复结肠黏膜损伤。
炎症是UC发病过程中的重要病理反应,细胞因子是炎症反应的主要参与者,促炎与抗炎因子失衡是导致肠道炎症的病理基础[12]。IL-1β、IL-6、TNF-α是重要的促炎因子,IL-1β由单核巨噬细胞产生,炎症性肠病患者中存在IL-1β高表达,提示其在肠道炎症中发挥重要作用[13]。研究表明,IL-1β已成为治疗全身和局部炎症性疾病的靶标,可通过降低IL-1β活性达到治疗效果[14]。IL-6具有较广泛的生物学活性,一方面参与肠黏膜炎症的激活并起到级联放大作用,另一方面参与肠黏膜免疫应答紊乱[15-16]。研究表明,UC大鼠肠黏膜组织IL-6含量明显增加,并与UC疾病活动呈正相关[17]。TNF-α在UC患者中呈高表达,且与UC病情的严重程度呈正相关[18]。本实验中模型组大鼠血清IL-1β、IL-6、TNF-α含量较正常组明显增加,经溃结宁膏穴位敷贴治疗后三者含量明显减少,提示溃结宁膏穴位敷贴具有抑制肠道炎症反应、修复炎症损伤的确切疗效。
NF-κB信号通路是调控炎症反应重要通路之一,NF-κB作为该通路中的关键因子,其亚基NF-κB p65在UC患者结肠黏膜中高表达,并破坏黏膜生理性屏障,导致结肠通透性增高,促进UC病变进展[19]。一般情况下,NF-κB在真核生物结肠上皮细胞中以p65/p50二聚体形式存在,其中p65主要发挥转录激活功能。在静息状态下,NF-κB二聚体与IκB结合形成三聚体复合物存在于细胞质中[20]。当炎症刺激时,IKK能使IκB蛋白磷酸化,导致IκB从三聚体中解离出来,NF-κB二聚体能暴露出核定位序列,迅速从细胞质移至细胞核,与核内DNA上的特异序列相结合,可上调TNF-α、IL-6和IL-1β mRNA表达,导致IL-1β、TNF-α等促炎因子释放增加,进一步激活NF-κB信号通路,引起炎症瀑布反应,导致肠道炎症反应,致使肠道黏膜损伤[19,21]。王怡薇等[22]发现,黄芩汤可能通过抑制NF-κB p65通路活化,下调一氧化氮、IL-6及TNF-α等表达,从而达到治疗UC的效果。吴玉泓等[23]研究表明,久泻灵颗粒可通过降低脾肾阳虚型UC大鼠结肠组织TLR4、NF-κB p65基因和蛋白的表达,发挥抑制结肠黏膜炎症、修复黏膜损伤的作用。本实验结果显示,模型组大鼠IKKα、NF-κB p65蛋白高表达,IκBα蛋白低表达,溃结宁膏穴位敷贴治疗能显著下调IKKα、NF-κB p65蛋白表达,上调IκBα蛋白表达。提示溃结宁膏穴位敷贴可能通过抑制NF-κB信号通路的激活,减少炎症因子的释放,从而减轻肠黏膜炎症,修复肠黏膜损伤。
综上,溃结宁膏穴位敷贴可明显改善“虚、瘀”状态下UC大鼠一般情况及结肠组织病理损伤,降低IKKα、NF-κB p65蛋白表达,升高IκBα蛋白表达,抑制NF-κB信号通路的过度激活,纠正免疫炎症紊乱,从而达到控制UC病情进展和改善症状的作用,为临床应用提供依据。
[1] 王玉芳,欧阳钦,胡仁伟,等.炎症性肠病流行病学研究进展[J].胃肠病学,2013,18(1):48-51.
[2] KAPLAN G G, NG S C. Understanding and preventing the global increase of inflammatory bowel disease[J]. Gastroenterology, 2017,152(2):313-321.
[3] UNGARO R, MEHANDRU S, ALLEN P B, et al. Ulcerative colitis[J]. Lancet,2017,389(10080):1756-1770.
[4] PEDERSEN J, COSKUN M, SOENDERGAARD C, et al. Inflammatory pathways of importance for management of inflammatory bowel disease[J]. World J Gastroenterol,2014,20(1):64-77.
[5] HAYDEN M S, GHOSH S. Shared principles in NF-kappaB signaling[J]. Cell,2008,132(3):344-362.
[6] 郑洁,朱莹,高昂.溃结宁膏穴位敷贴对溃疡性结肠炎(脾肾阳虚证)大鼠TLR4/MyD88/NF-κB信号通路的影响[J].广州中医药大学学报,2019, 36(10):1593-1598.
[7] 郑洁,朱莹,高昂,等.脾肾阳虚型溃疡性结肠炎大鼠模型的研制[J].中国中西医结合消化杂志,2016,24(3):182-187.
[8] 郭义.实验针灸学[M].北京:中国中医药出版社,2008.
[9] 王彤,王骁,范焕芳,等.白头翁汤对溃疡性结肠炎模型小鼠结肠黏膜及血清TNF-α、IL-6影响[J].辽宁中医药大学学报,2017,19(2):32-35.
[10] 李毅,樊新荣,刘力,等.基于因子分析与聚类分析对溃疡性结肠炎中医证候规律的研究[J].中国中西医结合杂志,2017,37(10):1191-1195.
[11] 朱莹,王燚霈,张水寒.溃结宁膏的体外透皮实验研究[J].湖南中医杂志,2013,29(8):119-120.
[12] 郝彦伟,张怡,周雪雷,等.基于mTOR/p-S6K1探讨加味附子理中汤干预UC大鼠肠黏膜炎症反应的效应机制[J].中国实验方剂学杂志,2020, 26(13):59-65.
[13] LAZARIDIS L D, PISTIKI A, GIAMARELLOS-BOURBOULIS E J, et al. Activation of NLRP3 inflammasome in inflammatory bowel disease:differences between Crohn’s disease and ulcerative colitis[J]. Dig Dis Sci,2017,62(9):2348-2356.
[14] DINARELLO C A. Interleukin-1 in the pathogenesis and treatment of inflammatory diseases[J]. Blood,2011,117(14):3720-3732.
[15] HERMANNS H M, WOHLFAHRT J, MAIS C, et al. Endocytosis of pro-inflammatory cytokine receptors and its relevance for signal transduction[J]. Biol Chem,2016,397(8):695-708.
[16] NIKOLAUS S, WAETZIG G H, BUTZIN S, et al. Evaluation of interleukin-6 and its soluble receptor components sIL-6R and sgp130 as markers of inflammation in inflammatory bowel diseases[J]. Int J Colorectal Dis,2018,33(7):927-936.
[17] 徐敏,王凤仪,赵党生,等.芍药汤对湿热内蕴型溃疡性结肠炎大鼠TLR4,NF-κB p65和IL-6表达的调控作用[J].中国实验方剂学杂志, 2020,26(14):53-58.
[18] 张志军,刘懿,王磊,等.TLR4mAb对急性期溃疡性结肠炎小鼠结肠黏膜中促炎因子TNF-α、IFN-γ、IL-1β的影响[J].复旦学报(医学版), 2008,35(2):176-180.
[19] 黄循铷,王承党,王瑞幸,等.溃疡性结肠炎小鼠肠道通透性改变与TNF-α及NF-κB p65的关系[J].中国应用生理学杂志,2016,32(2):112-115,193.
[20] ZHANG Q, LENARDO M J, BALTIMORE D. 30 years of NF-κB:A blossoming of relevance to human pathobiology[J]. Cell,2017, 168(1/2):37-57.
[21] MOLYVDAS A, GEORGOPOULOU U, LAZARIDIS N, et al. The role of the NLRP3 inflammasome and the activation of IL-1β in the pathogenesis of chronic viral hepatic inflammation[J]. Cytokine, 2018,110:389-396.
[22] 王怡薇,张会会,王彦礼,等.黄芩汤对溃疡性结肠炎大鼠NF-κB p65调控作用研究[J].药学学报,2015,50(1):21-27.
[23] 吴玉泓,许雅清,李海龙,等.久泻灵颗粒对脾肾阳虚型溃疡性结肠炎大鼠TLR4及NF-κB p65表达的影响[J].中国实验动物学报,2016, 24(1):47-52.
Effects of Acupoint Application ofPlaster on Intervening Inflammatory Response of Colonic Mucosa in Rats with Ulcerative Colitis Based on NF-κB Signaling Pathway
LOU Yu1, XIAO Yunting1, ZHU Ying2, WANG Yipei1, XIE Chaoqun1
To explore the effects of acupoint application ofPlaster on inflammatory reaction of colonic mucosa in rats with ulcerative colitis (UC); To explore the mechanism of action from the perspective of NF-κB signaling pathway.SD rats were randomly divided into normal group, model group, non-acupoint application group, acupoint application group and sulfasalazine (SASP) group. The rat model was established by gavage of the decoction of Folium Sennae and adenine at different stages combined with external intervention as well as enema with the compound of 2,4,6-trinitrobenzene sulfonic acid and alcohol. The acupoint application group was givenPlaster on acupoint application (). Non-acupoint application group was givenPlaster non-acupoint application (gluteal muscles). SASP group was given intragastric administration of SASP. Normal group and model group were given the equal volume of normal saline, once a day, lasting for 28 d. The general condition, colonic mucosal damage index (CMDI) score and pathological changes of colon were observed; the contents of serum tumor necrosis factor-α (TNF-α), interleukin (IL)-1β and IL-6 were detected by ELISA, and the expressions of IKKα, NF-κB p65 and IκBα protein in colon tissues were detected by Western blot.Compared with the normal group, the CMDI score of the model group increased (<0.01), the levels of serum IL-1β, IL-6 and TNF-α significantly increased (<0.01,<0.05), the expressions of NF-κB p65 and IKKα protein in colon tissue significantly increased (<0.01), and the expression of IκBα protein significantly decreased (<0.01). Compared with the model group, the CMDI score of rats in acupoint application group and SASP group decreased (<0.05,<0.01), the contents of serum IL-1β, IL-6 and TNF-α significantly decreased (<0.01,<0.05), the expression of NF-κB p65 and IKKα protein in colon tissue significantly decreased (<0.01), and the expression of IκBα protein significantly increased (<0.01,<0.05).Plaster acupoint application can inhibit the inflammation reaction of colonic mucosa, and then control the development of UC by regulating the expressions of IKKα, NF-κB p65 and IκBα proteins in the NF-κB pathway and reducing the contents of IL-1β, IL-6, and TNF-α in serum.
ulcerative colitis;Plaster; acupoint application; NF-κB signaling pathway; TNF-α; IL-6; IL-1β; rats
R285.5
A
1005-5304(2021)04-0075-06
10.19879/j.cnki.1005-5304.202009275

国家自然科学基金(81874466);中医内科重大疾病防治研究与转化教育部重点实验室开放基金(ZYNK201705);湖南省研究生科研创新项目(CX20190546)
朱莹,E-mail:zhuying089@126.com
(收稿日期:2020-09-18)
(修回日期:2020-10-27;编辑:华强)
