TGF-β1联合Wnt3a促进子宫内膜纤维化的机制研究*
2021-04-20赵世云袁立薇张慧星元娟娟胡明月黄娅妮
赵世云,袁立薇,曹 佳,张慧星,元娟娟,胡明月,黄娅妮,刘 丹
(1.宁夏医科大学临床医学院,银川 750004;2.宁夏医科大学总医院北京国家生物芯片研究中心宁夏分中心,银川 750004;3.宁夏医科大学总医院妇科,银川 750004;4.宁夏医科大学生育力保持重点实验室,银川 750004)
宫腔粘连(intrauterine adhesions,IUA)是由创伤、感染等因素引起子宫内膜基底层受损、子宫内膜修复障碍,病理结局为子宫内膜纤维化及瘢痕化的妇科疾病[1]。目前在子宫内膜修复微环境的研究中,转化生长因子-β1(transforming growth factor-β1,TGF-β1)是公认的最主要的促纤维化形成因子[2]。TGF-β1高表达导致子宫内膜修复障碍,是IUA病理性纤维化形成的重要环节[3]。Wnt/β-catenin信号通路在调控细胞增殖分化、维持组织稳态等多种生物学过程中发挥重要作用,Wnt/β-catenin信号通路与子宫内膜增殖及生理调节密切相关[4]。该通路中重要调控蛋白的异常表达与多种器官纤维化密切相关[5]。目前,越来越多的研究表明Wnt/β-catenin信号通路与TGF-β/Smad信号通路间存在交互调节,这种调节机制存在于配体水平,胞浆水平及细胞核中转录因子的相互作用中。以往关于Wnt/β-catenin与TGF-β/Smad的串扰主要集中于细胞分化、皮肤、肝等组织器官纤维化领域[6]。两条通路在子宫内膜纤维化中的交互作用,目前尚不清楚。本实验以人子宫内膜基质细胞(human endometrial stromal cells,hESCs)作为研究对象,通过TGF-β1诱导使其发生纤维化,构建IUA细胞模型,在此基础上,验证Wnt3a联合TGF-β1促进IUA的发生,旨在探讨Wnt/β-catenin和TGF-β/Smad信号通路在IUA发病过程中的交互作用。
1 资料与方法
1.1 研究对象 选取2019年1月至2020年1月就诊于宁夏医科大学总医院宫腔镜中心,主因男方因素不孕的育龄健康妇女。于月经干净3~7天行宫腔镜检查时收取子宫内膜组织,离体1h内无菌条件下进行原代分离培养。患者均签署知情同意书,并通过医院伦理委员会审查。纳入标准:年龄<40岁育龄期妇女;月经规律;子宫内膜无病理性改变;宫腔镜下观察内膜腺管形态符合增生期改变。排除标准:合并宫内其他异常;其他原因的不孕;合并其他内科疾病。
1.2 主要试剂和仪器 DMEM/F12、胰蛋白酶购自美国Hyclone公司;胎牛血清购自美国Gibco公司;TRIzol购自美国Invitrogen公司;BCA蛋白检测试剂盒购自美国Thermo公司;ECL化学发光液购自美国Millipore公司;Wnt3a蛋白购自美国Biovision公司;TGF-β1蛋白购自美国PeproTech公司;荧光定量PCR仪购自美国OLYMPUS公司;二氧化碳恒温培养箱购自美国Thermo Scientific公司;蛋白凝胶成像系统购自美国Bio-Rad公司。
1.3 方法
1.3.1 原代培养hESCs 将收集的子宫内膜组织标本放入含青链霉素的PBS溶液中,于超净工作台充分剪碎组织呈糜状,将其放置于15mL离心管。加PBS溶液充分冲洗,室温静置,待组织块完全沉至管底,弃PBS,加3.0mg/mL Ⅳ型胶原酶6mL,置37℃培养箱中消化20min。待组织块呈拉丝状后加等体积Accumax消化液,继续消化15min,用移液枪吹打后400目尼龙筛网过滤,收集细胞悬液,1500r/min离心5min,DMEM高糖完全培养基重悬,置37℃、5%CO2培养箱孵育过夜。次日观察细胞形态,待细胞密度达到80%~90%进行传代培养,用于后续实验。
1.3.2 荧光定量PCR(RT-PCR) 用TRizol进行hESCs总RNA的提取,紫外分光光度仪测定RNA纯度及浓度,利用逆转录试剂盒(日本,Takara)按产品说明书合成cDNA。PCR反应液按TB Green 10μL、Primer pair 0.8μL、cDNA 2μL、ddH2O 6.4μL体系进行配制。反应条件:95℃ 30s,95℃ 5s,60℃ 30s,72℃延伸30s,共40个循环,扩增结束后通过查看熔解曲线和扩增曲线确定结果的准确性。分析结果以β-actin作为内参,利用2-△△Ct方法计算各基因的相对表达量。引物序列均在PrimerBank查阅获得,由上海生工生物工程股份有限公司合成。
1.3.3 Western blot 收集hESCs,加RIPA蛋白裂解液提取各组细胞总蛋白,BCA蛋白定量检测法测定蛋白质浓度,分别将待测样品与5×loading buffer蛋白上样缓冲液充分混合,100℃煮沸5min促使蛋白变性。将蛋白样品加入SDS-PAGE凝胶孔内,放入电泳槽进行电泳,电泳结束后将蛋白转移至PVDF膜,5%脱脂奶粉室温封闭1h。加兔抗人单克隆抗体(α-SMA、CollageⅠ、Fibronectin、GSK-3β、β-catenin、CyclinD1、MMP-9)溶液4℃孵育过夜。次日回收抗体,1×TBST溶液洗膜3次/10min,加抗兔IgG-HRP二抗室温孵育1h,1×TBST溶液洗膜3次/10min。采用ECL化学发光试剂盒显影后胶片曝光,使用Image J软件根据内参GAPDH灰度值计算蛋白的相对表达。
1.3.4 细胞免疫荧光染色 消化hESCs为单细胞悬液,将其接种至铺有盖玻片的12孔板中进行培养,镜下观察汇合成单细胞层后进行免疫荧光染色:弃培养基,PBS清洗后加4%多聚甲醛溶液固定30min,PBS清洗后加0.5% Trixon X-100溶液破膜处理15min。加5% BSA封闭液室温封闭1h,去除非特异性背景染色。PBS清洗后4℃避光摇床孵育一抗(Vimentin,abcam,ab92547)过夜,次日室温继续孵育1h。弃一抗,PBS清洗,加抗兔Alexa Fluor荧光二抗(Invitrogen,A21207),室温避光孵育2h,促使抗原抗体特异性结合。加提前配置的DAPI工作液(Solarbio,C0060),室温避光孵育20min促使细胞核着色。染色结束后,滴加抗荧光衰减淬灭剂(Solarbio,S2100)防止荧光淬灭。在荧光显微镜下观察细胞的染色情况。

2 结 果
2.1 hESCs培养及鉴定 普通倒置光学显微镜观察可见,细胞呈多角形或梭形,逐渐延伸成漩涡状平行排列(图1A);免疫荧光染色结果显示,基质细胞特异波形蛋白(Vimentin)染色呈阳性。表明分离获取的细胞为hESCs(图1B)。

图1 普通倒置光学显微镜观察和免疫荧光染色结果
2.2 不同浓度TGF-β1作用hESCs诱导纤维化的表达 RT-PCR和Western blot法结果显示,与正常对照组(Control)相比,不同浓度(5ng/mL、10ng/mL)TGF-β1作用hESCs 24h后,Collage Ⅰ、Collage Ⅳ、α-SMA、Fibronectin mRNA及蛋白表达均升高,其中10ng/mL TGF-β1诱导作用更显著。表明TGF-β1诱导hESCs发生纤维化,成功建构IUA细胞模型(图2)。

图2 纤维化标记物mRNA和蛋白的相对表达
2.3 不同浓度TGF-β1作用Wnt/β-catenin信号通路配体及核心分子表达 RT-PCR和Western blot法结果显示,与对照组相比,TGF-β1诱导组Wnt/β-catenin信号通路核心分子(Axin2、β-catenin、GSK-3β、CyclinD1、MMP-9)mRNA和蛋白表达均升高;同法检测配体(Wnt1、Wnt4、Wnt5b、Wnt3a、Wnt7a、Wnt9a)mRNA表达也升高,其中Wnt3a升高最显著。Western blot法检测TGF-β1诱导组Wnt3a蛋白表达,与RT-PCR结果一致。表明TGF-β1通过激活Wnt/β-catenin信号通路诱导hESCs纤维化的发生(图3)。

图3 Wnt信号通路配体及核心分子mRNA和蛋白的表达
2.4 Wnt3a联合TGF-β1检测纤维化及Wnt/β-catenin信号通路的表达 Wnt3a(100ng/mL)和TGF-β1(10ng/mL)联合作用hESCs 24h,RT-PCR及Western blot法结果显示,与Control组相比,Wnt3a组、TGF-β1组、Wnt3a与TGF-β1联合组Collage Ⅰ、CTGF、Collage Ⅳ、α-SMA mRNA和蛋白表达均升高,组间比较,联合组升高更明显(P<0.05)(图4)。同法检测Wnt/β-catenin信号通路中β-catenin、GSK-3β、MMP-9、CyclinD1、C-myc的表达,结果显示:Wnt3a与TGF-β1联合作用上述分子mRNA和蛋白表达升高更显著(图5)。证实Wnt3a联合TGF-β1通过激活Wnt/β-catenin信号通路促进hESCs纤维化。
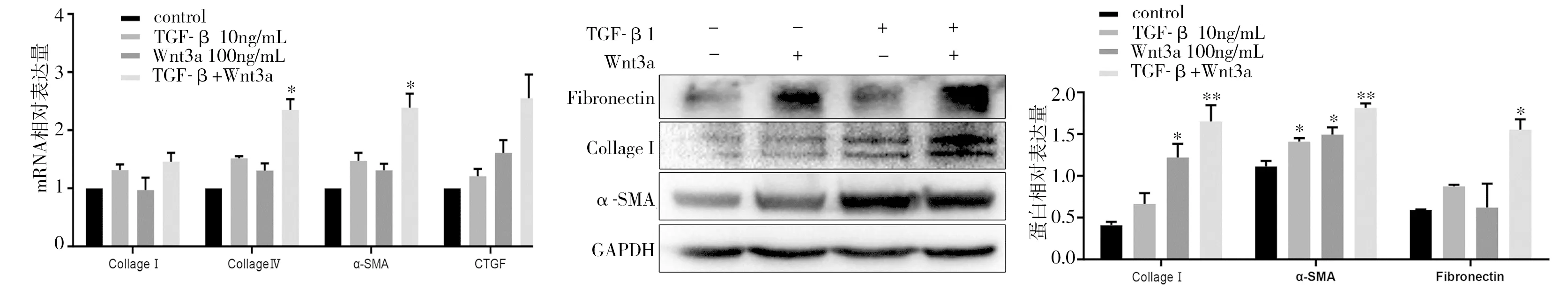
图4 Wnt3a联合TGF-β1作用纤维化标记物mRNA和蛋白相对表达

图5 Wnt3a联合TGF-β1作用Wnt信号通路核心分子的表达
3 讨 论
纤维化是IUA的主要发病机制,纤维化的发生可能与体内部分促进创面修复或抑制组织纤维化的细胞因子的异常表达相关[7]。因此,探究参与IUA病理过程的细胞因子以及微环境机制对于其治疗和预防至关重要。
TGF-β1是TGF-β家族中研究最广泛的因子,研究表明,其在纤维化过程中起着至关重要的作用。文献报道[7-8],TGF-β1表达于IUA患者的子宫内膜腺上皮细胞和间质细胞中,且其含量明显高于非IUA患者[9]。单铁英等[10]研究发现,TGF-β1可促使子宫内膜上皮细胞转化为肌成纤维细胞,促进子宫内膜纤维化的进程。本研究结果显示,在体外TGF-β1可促使hESCs合成α-SMA、Collage Ⅰ、Collage Ⅳ和Fibronectin显著增加,表明TGF-β1能刺激hESCs转分化为肌成纤维细胞,致胶原合成增加和细胞外基质沉积,与上述文献的研究结果一致。由此可知,TGF-β1可促进hESCs转化为肌成纤维细胞,促进子宫内膜纤维化的进程,促使组织纤维瘢痕形成[11]。
IUA发生的根本原因是子宫内膜增殖和修复障碍,Wnt/β-catenin信号通路在子宫内膜生理性调节中发挥关键作用,雌激素通过激活经典Wnt信号通路促进内膜细胞的增殖和再生[12]。Wnt3a是Wnt基因家族中的重要成员[13],Wnt3a能激活经典的Wnt/-catenin信号通路,促进β-catenin的积聚[14]。本研究中,Wnt3a诱导hESCs后,CollageⅠ、α-SMA、CTGF表达明显升高。表明Wnt3a对子宫内膜纤维化有重要的促进作用,推测子宫内膜纤维化的形成可能与Wnt3a的异常表达激活Wnt/β-catenin信号通路密切相关。
最新研究结果提示,Wnt/β-catenin信号与一些参与纤维化的信号通路之间存在串扰(crosstalk),其中研究较多的是与TGF-β/Smad信号之间的交互调节,在纤维化进程中,以上两条通路存在交互作用。Caraci等[15]认为,TGF-β1可通过ERK途径激活β-catenin,进而促进肺成纤维细胞的表型转化。Zhou等和Charbonney等[16-17]分别发现,TGF-β可能与β-catenin共同参与了上皮-间充质转化(epithelial-to-mesenchymal transition,EMT)这一纤维化疾病发生的过程。本研究中不同浓度TGF-β1作用正常hESCs后,CollageⅠ、α-SMA、CTGF及Wnt/β-catenin信号通路Wnt3a、β-catenin、GSK-3β、CyclinD1、MMP-9水平高表达,表明在体外实验中,TGF-β1可通过激活Wnt/β-catein途径来促使hESCs纤维化的发生。同时发现,Wnt3a联合TGF-β1进一步促进Wnt/β-catenin信号通路核心分子及下游靶基因表达升高。以上结果进一步证实,Wnt3a和TGF-β1协同激活Wnt/β-catenin通路促进hESCs纤维化。
综上所述,在hESCs纤维化中Wnt3a、TGF-β1高表达可能与宫腔粘连的发生密切相关,Wnt/β-catenin和TGF-β/Smad两条信号通路可能协同参与子宫内膜纤维化及促进IUA的形成。而这两个指标如何相互促进IUA发生发展仍有待进一步研究。因此,需进一步实验探索TGF-β/Smad信号和Wnt/β-catenin信号通路中各介质与IUA的关系。抑制Wnt3a表达或阻断两条通路的活化可能成为干预IUA的突破点。
