瘦素受体与高级别浆液性卵巢癌转移的生物信息学相关性*
2021-04-20周东晨马晶晶高庆蕾
楼 华,魏 晓,周东晨,马晶晶,徐 滔,高庆蕾
(华中科技大学同济医学院附属同济医院妇产科,武汉 430030)
卵巢癌的死亡率居妇科恶性肿瘤首位[1]。造成这一结果的因素很多,包括早期症状不明显、易于转移和复发以及缺乏长期有效的化疗[2]。高级别浆液性卵巢癌(high-grade serous ovarian cancer,HGSOC)在所有卵巢癌中恶性程度很高,易发生腹腔转移,常引起严重腹水和肠梗阻,造成患者死亡。越来越多的证据开始支持肥胖在卵巢癌发生中的作用:两项流行病学研究已建立了卵巢癌和体质量指数(body mass index,BMI)之间的联系[3-4]。瘦素(leptin)是肥胖女性体内异常分泌的脂肪因子,肥胖患者的血清瘦素水平升高。瘦素通过其受体起作用,该受体由LEPR基因编码。肿瘤转移是复杂的多步骤过程,上皮癌细胞为了迁移和侵袭,必须经历上皮-间充质转化(epithelial to mesenchymal transition,EMT)。瘦素受体(leptin receptor,LEPR)与一些细胞因子有结构上的同源性,包括已知参与卵巢癌细胞EMT的IL-6。LEPR已经在几种上皮性癌症中被发现,包括肝癌、前列腺癌、结肠癌和乳腺癌。在这些癌症中,瘦素与LEPR结合后,JAK/STAT、MAPK和PI3K/Akt信号通路随之激活,导致癌细胞增殖和迁移[5-8]。基于此,本研究采用免疫组化法和生物信息学分析原发病灶与转移病灶之间LEPR的表达差异,初步探讨LEPR介导肥胖HGSOC转移的机制,为LEPR可能成为新的治疗靶点提供依据。
1 资料与方法
1.1 临床资料 收集2017年9月至2019年10月10例卵巢癌病例的原位病灶和转移病灶。纳入标准:BMI≥25kg/m2,病理类型为HGSOC,用于免疫组化染色。收集2012年3月至2016年7月5例HGSOC病例的原位病灶、腹水和转移病灶,用于基因芯片表达谱分析。所有标本均在患者知情同意、经同济医院伦理委员会授权并经两名资深医学家评估的情况下在华中科技大学同济医院妇科肿瘤采集。
1.2 研究方法
1.2.1 免疫组化染色及评分 瘦素受体多克隆抗体(SC-1834)购自Santa Cruze公司;SP免疫组织化学试剂盒购自武汉大风;二胺基联苯氨(DAB)显色试剂盒购自北京中杉金桥。石蜡切片常规进行脱蜡、乙醇梯度水化、阻断内源性过氧化酶的活性、抗原修复和封闭、一抗4℃过夜。采用链霉菌抗生物素蛋白-过氧化物酶(SP法)进行免疫组化染色,光镜下控制DAB显色,苏木素复染、脱水、封片。采用磷酸盐缓冲液(PBS)代替一抗作为阴性对照,以脂肪组织的染色结果作为阳性对照。LEPR阳性细胞为胞膜和(或)胞浆染成棕黄色。染色结果为两位病理学家的平均得分。对组织中LEPR蛋白水平进行半定量评估:染色强度评分(0分,阴性;1分,弱阳性;2分,中等阳性;3分,强阳性);阳性染色细胞所占总肿瘤细胞百分比评分(0分,无阳性细胞;1分,≤10%;2分,11%~25%;3分,26%~50%;4分,≥51%)。每片选择5个不重复的高倍视野,染色强度与阳性细胞百分比积分乘积的均值为每例切片的组化评分(LEPR expression score)。
1.2.2 基因芯片数据来源及分析 本课题组在前期实验中已发表文章“Heterotypic CAF-tumor spheroids promote early peritoneal metastatis of ovarian cancer”并上传5例HGSOC患者相关基因表达数据集GSE73168(GPL570平台[HG-U133 Plus 2]Affymetrix Human Genome U133 Plus 2.0 Array),每例患者均配有原位病灶、腹水和转移病灶标本[9]。选择Gene Symbol为LEPR的相关数据进行统计分析。
1.2.3 String蛋白互作网络分析 String蛋白互作网络分析可搜索已知蛋白质之间和预测蛋白质之间相互作用,通过String数据库预测LEPR蛋白的上下游调控蛋白及蛋白间的相关调控关系。检索条件:(1)Protein Name:LEPR;(2)Organism:auto-detect。
1.2.4 基于GEPIA数据库基因相关性分析 通过基因表达谱数据动态分析数据库(Gene Expression Profiling Interactive Analysis,GEPIA)分析卵巢癌患者中LEPR与JAK、STAT3、Akt之间相关性。进入网站后选择Multiple Gene Analysis,Correlation Analysis,输入LEPR与JAK2,LEPR与STAT3,LEPR与Akt1,Correlation Coefficient选择Spearman,TCGA Tumor选择OV Tumor。

2 结 果
2.1 肥胖HGSOC患者原位病灶和转移病灶中LEPR表达 免疫组化结果显示,在HGSOC中LEPR以胞膜和胞浆表达为主(图1)。10例肥胖HGSOC患者的配对标本转移病灶中,LEPR表达明显强于原位病灶,组化评分的均数分别为11.60和7.60,差异有统计学意义(P<0.05)(图2)。
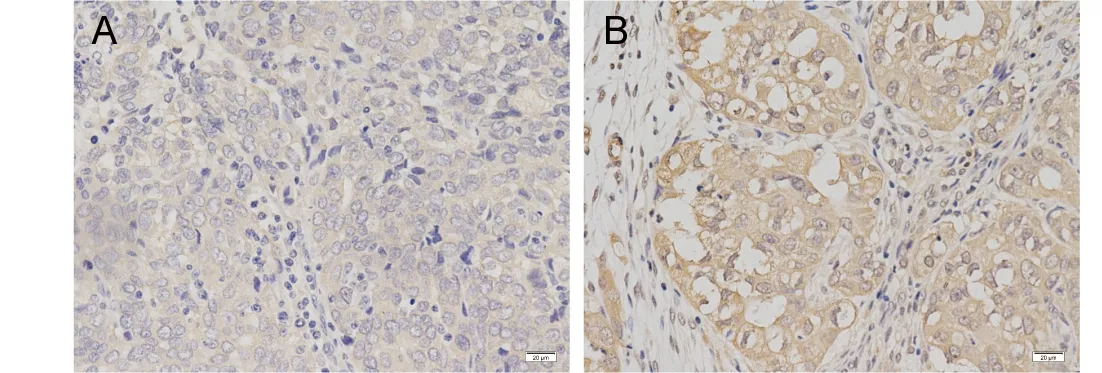
图1 肥胖HGSOC患者原位病灶和转移病灶中LEPR表达(IHC×200)

图2 肥胖HGSOC患者原位病灶和转移病灶中LEPR表达的免疫组化评分
2.2 基因芯片数据中LEPR表达 5例HGSOC配对原位病灶、腹水、转移病灶的LEPR表达在组间呈下降趋势,差异无统计学意义(P=0.71)(图3)。

图3 基因芯片数据中不同标本来源LEPR的表达(相对于原位病灶)
2.3 LEPR上下游关系预测 在String蛋白互作网络分析数据库中,分析LEPR上下游关系,得到关系网络图(图4),相互作用节点数共有31个。LEPR参与细胞因子、脂肪代谢、胰岛素抵抗和缺氧刺激的应答通路(如JAK2、STAT3、INS),以及调节细胞周期、细胞生长和分化、应激反应、凋亡、脂蛋白代谢和致癌转化的通路(如MAPK、Akt、PTPN、AMPK)。

图4 LEPR基因与上下游基因调控关系
2.4 LEPR与JAK2、STAT3、Akt1相关性分析 利用GEPIA数据库分析在卵巢癌中LEPR与JAK2、STAT3、Akt1的表达相关性,结果显示LEPR与JAK2呈正相关(R=0.31,P<0.05),LEPR与STAT3呈正相关(R=0.33,P<0.05),LEPR与Akt1呈正相关(R=0.21,P<0.05)(图5)。

图5 卵巢癌中LEPR与JAK2、STAT3、Akt1相关性分析
3 讨 论
有研究显示,肥胖女性患卵巢癌的风险更高,预后更差。Olsen等[9]通过综合分析来自卵巢癌协会联合会的15项病例对照研究,发现高BMI与I型卵巢癌的风险增加相关。Protani等[4]对14项研究进行了荟萃分析,结果显示肥胖卵巢癌患者的存活率略低于非肥胖卵巢癌患者,且与肥胖出现的时间无关。Bae等[11]汇集了17项队列研究,发现年轻时肥胖和(或)在卵巢癌确诊前5年肥胖与较差的预后相关。肥胖的特征是慢性低度炎症状态,与健康体重状态相比,不同的细胞因子,包括瘦素,以较高的血清水平循环。原发性肿瘤中循环瘦素水平或LEPR的高表达与卵巢癌较差的预后相关[12-13]。
卵巢癌预后较差的原因主要在于卵巢癌的转移和复发。在复发方面,肥胖患者体内高水平的瘦素,以及可能高水平的其他细胞因子(如IL-6),可能有助于术后仍处于休眠状态的癌细胞(如腹水或腹腔中的漂浮细胞)存活,并促进它们种植于新的位置(如脂肪组织或腹膜间皮),因此肥胖卵巢癌患者易于复发[14-15]。在转移方面,本研究发现,与原发病灶相比,LEPR在转移病灶中的表达显著升高。通过生物信息学分析,推测LEPR可能通过介导JAK/STAT3和PI3/Akt的活化,增加卵巢癌细胞的迁移与侵袭,促进卵巢癌的转移。JAK、STAT3、MAPK和Akt在其他上皮性癌症中已被证实直接参与瘦素诱导的肿瘤细胞迁移和侵袭[5-7]。
本研究得出的结论没有在5例HGSOC患者的基因芯片数据中被证实,其结果显示原位病灶、腹水、转移病灶的LEPR表达在组间呈下降趋势,且差异无统计学意义。原因可能是:(1)样本量少;(2)患者的纳入标准中没有BMI限制,患者的瘦素与LEPR表达水平均较低。目前,本课题组正在招募新的HGSOC患者,纳入标准限制BMI≥25kg/m2,并收集匹配的原发病灶、腹水和转移病灶样本,以进一步证实本研究结果。
综上所述,在肥胖HGSOC患者体内,LEPR可能通过JAK/STAT3和PI3/Akt通路,促进卵巢癌细胞的迁移和侵袭。LEPR可能成为肥胖HGSOC患者治疗和评估预后的潜在靶点和标记物。
