过氧化氢对W1118品系果蝇寿命、生育能力、运动能力及抗氧化能力的影响
2021-04-19漆辉洲王五洲肖方竹郭思思何淑雅
刘 波,漆辉洲,王五洲,马 云,肖方竹,郭思思,何淑雅
(南华大学公共卫生学院,湖南省衡阳市421001)
过氧化氢(hydrogen peroxide),俗称双氧水,分子式为H2O2,溶于水、醇、醚等[1],广泛应用于医用、食品及工业消毒等领域,易分解为水和氧气,无残留毒性,不会造成环境的再次污染[2-3]。过氧化氢作为一种强氧化剂,可破坏线粒体功能和损伤脱氧核糖核酸(deoxyribonucleic acid,DNA)诱导氧化应激,增加活性氧(reactive oxygen species,ROS)含量,进而启动由Caspase介导的细胞凋亡途径[4],且ROS在各种信号通路介导的细胞增殖和炎症反应中也起着重要作用[5-6];一旦过氧化氢作用于细胞浓度超过某个水平,细胞会发生氧化应激反应,可导致细胞内发生不可逆转的损伤[7]。
果蝇具有饲养简便、反应灵敏、75%的基因与人类疾病相关基因同源等优点[8],且其发育过程和代谢机制与哺乳动物类似,故较多地将其应用于衰老或寿命等方面的研究[9]。本研究以W1118品系果蝇为实验对象,通过喂食含过氧化氢的培养基,观察果蝇的生长情况,研究过氧化氢对果蝇的寿命、生育能力、运动能力及抗氧化能力的影响,以期为过氧化氢对果蝇生长发育影响的研究提供证据。
1 材料和方法
1.1 材料
W1118品系果蝇,由本实验室传代保存。过氧化氢(上海双俭);丙酸(巴斯夫);琼脂粉(康倍斯);酵母粉、蔗糖、黄豆粉及玉米粉(均购自沃尔玛超市);PBS缓冲液(赛默飞);谷胱甘肽(glutathione,GSH)和过氧化氢酶(catalase,CAT)试剂盒(默沙克);恒温箱(湖南中美)。
1.2 果蝇培养
玉米-酵母培养基,恒温25 ℃,相对湿度65%。基础培养基的配制:取130 g玉米粉、77 g蔗糖、30 g大豆粉、13 g琼脂粉以及900 mL蒸馏水倒入锅中,煮沸30 min,待温度降至55~60 ℃,加入6 mL丙酸和20 g酵母粉搅拌均匀后立即倒入培养管中,冷藏后使用[10-11]。过氧化氢培养基:在基础培养基中添加不同量的过氧化氢,搅拌均匀后倒入培养管中,配制成最终含400、800和1 200 mmol/L过氧化氢的培养基,0 mmol/L过氧化氢的基础培养基为对照组。
1.3 果蝇寿命测定
收集未交配的处女蝇和雄果蝇,随后随机挑取雌雄果蝇各50只放入基础培养基和含400、800、1 200 mmol/L过氧化氢的培养基中,每组设5个平行管。每日18:00对果蝇存活情况进行观察和记录,培养过程中每隔2天更换一次新鲜培养基,持续观察直至果蝇全部死亡。记录数据并计算最高寿命(最后10只死亡果蝇的平均寿命)、寿命和半数死亡时间。
1.4 果蝇生育能力测定
在准备好的基础培养基中放入果蝇,产卵12 h后移除亲本,然后根据实验要求采集1日龄幼虫,分别放入到基础培养基和含400、800、1 200 mmol/L过氧化氢的培养基内进行充分培养。各组培养基中均放置50只幼虫,每组设5个平行管,观察蛹化和羽化情况。蛹化率(%)=蛹化总数/卵总数×100%;羽化率(%)=羽化总数/卵总数×100%[12]。
1.5 果蝇羽化后48 h死亡率测定
在各浓度培养基羽化的成虫中,均随机挑选20只成虫,每组设5个平行管,每隔8 h观察成虫存活情况直至48 h,以确定幼虫羽化为成虫后48 h的死亡率。果蝇羽化后48 h死亡率(%)=羽化后48 h死亡果蝇总数/羽化果蝇总数×100%。
1.6 果蝇运动能力测定
收集3日龄果蝇,分别放入基础培养基和含400、800、1 200 mmol/L过氧化氢的培养基中,培养7天后,每组随机挑取50只果蝇且每组设5个平行管,轻晃果蝇至培养管底部并塞好瓶塞,记录5 s内果蝇到达培养管顶部的数量。攀爬指数(%)=5 s内到达顶部的果蝇数/果蝇总数×100%[13]。攀爬指数越高说明运动能力越强,反之越小。
1.7 果蝇抗氧化活性测定
收集3日龄果蝇,从基础培养基对照组和含400、800、1 200 mmol/L过氧化氢的培养基处理组中每组随机各挑取雌、雄果蝇20只于离心管中,每组设5个平行管,加入适量的PBS缓冲液,在液氮中充分研磨成10%组织匀浆[14],4 ℃ 2 500 r/min离心15 min,取上清,严格按照默沙克公司的试剂盒操作说明测定GSH含量和CAT活力。
1.8 统计分析
2 结 果
2.1 过氧化氢对果蝇寿命的影响
400 mmol/L过氧化氢处理组雌雄果蝇半数死亡时间、最高寿命及雌果蝇寿命与对照组相比均明显延长(P<0.05),1 200 mmol/L过氧化氢处理组雌雄果蝇半数死亡时间、寿命及最高寿命与对照组相比均明显缩短(P<0.05;图1);浓度为800 mmol/L条件下,雄果蝇平均寿命与对照组相比明显缩短。
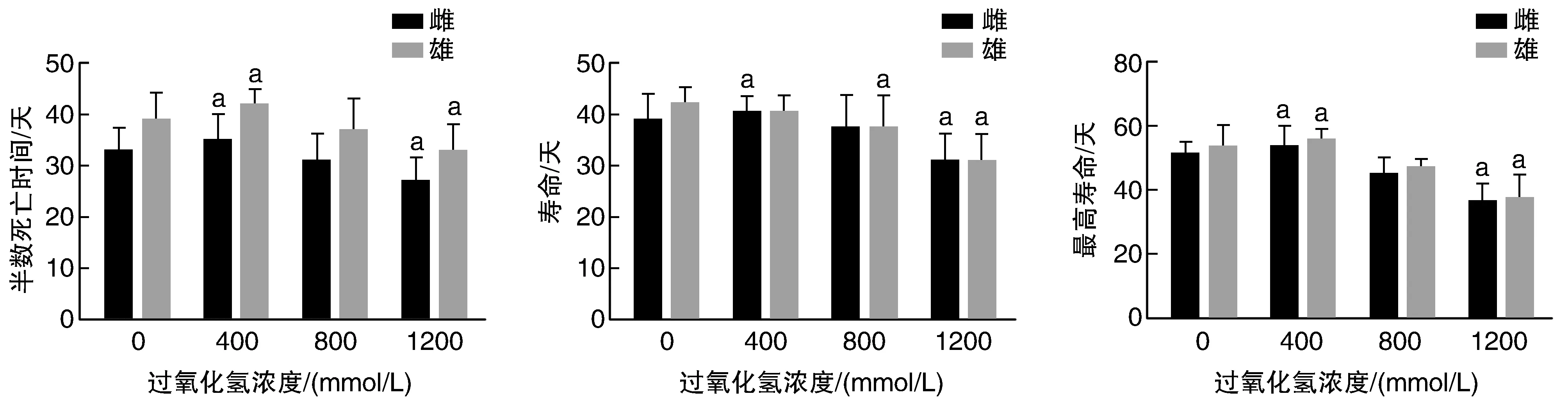
图1 过氧化氢对果蝇寿命的影响a为P<0.05,与0 mmol/L对照组比较。
2.2 过氧化氢对果蝇生育能力的影响
在800 mmol/L和1 200 mmol/L条件下,果蝇的蛹化率明显低于对照组(P<0.05;图2);不同浓度过氧化氢处理组果蝇的羽化率均明显低于对照组(P<0.05),且果蝇生育能力随着过氧化氢浓度的提高而逐渐减弱,呈剂量依赖性关系。

图2 过氧化氢对果蝇生育能力的影响a为P<0.05,与0 mmol/L对照组比较。
2.3 过氧化氢对果蝇羽化后48 h死亡率的影响
400、800、1 200 mmol/L过氧化氢处理组果蝇羽化后48 h死亡率明显高于对照组P<0.05;图3),且果蝇羽化后48 h死亡率随着过氧化氢浓度的提高而逐渐升高,呈剂量依赖性关系。

图3 过氧化氢对果蝇羽化后48 h死亡率的影响a为P<0.05,与0 mmol/L对照组比较。
2.4 过氧化氢对果蝇运动能力的影响
400、800 mmol/L、1 200 mmol/L过氧化氢处理组果蝇的运动能力与对照组相比均明显减弱(P<0.05;图4),且随着过氧化氢浓度的提高而逐渐减弱,呈剂量依赖性关系。
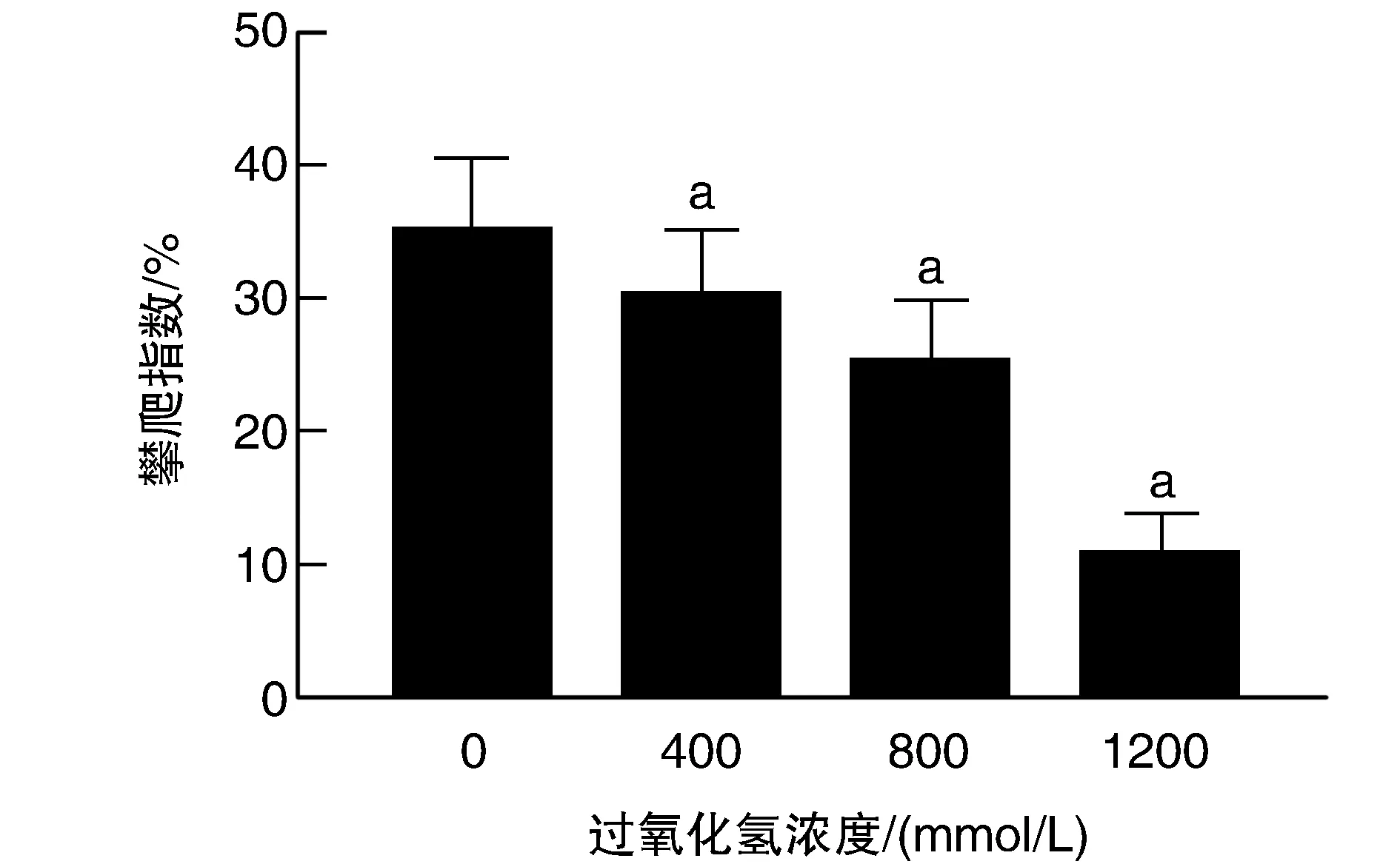
图4 过氧化氢对果蝇运动能力的影响a为P<0.05,与0 mmol/L对照组比较。
2.5 过氧化氢对果蝇抗氧化活性的影响
800、1 200 mmol/L过氧化氢处理组果蝇GSH含量和CAT活力与对照组相比均明显降低(P<0.05;图5)。

图5 过氧化氢对果蝇抗氧化活性的影响a为P<0.05,与0 mmol/L对照组比较。
3 讨 论
过氧化氢常用于医用、环境和食品等领域的消毒,其对革兰氏阳性菌、革兰氏阴性菌、细菌孢子和病毒等有抗菌效果,产生抗菌作用的机制可能是过氧化氢降解释放的ROS导致DNA链断裂[15];同时,过氧化氢可经皮肤、消化道及呼吸道等不同途径进入人体产生一定的毒性[16-17],产生毒性的机制主要有三种:腐蚀损伤、氧气生成和脂质过氧化[18]。果蝇易于操作,喂养简单,繁殖力高、染色体数目少,且其代谢途径、生理功能和发育阶段与哺乳动物类似等特性,故常被用作生物模型来研究动物行为、发育和抗衰老和抗氧化等[19-20]。本研究以W1118品系果蝇为研究对象,研究过氧化氢对果蝇寿命、生育能力以及运动能力的影响,并以GSH含量和CAT活力为指标评价了果蝇的抗氧化能力。结果表明:随着过氧化氢浓度的增加,果蝇蛹化率和羽化率降低、运动能力减弱、羽化后48 h死亡率升高;当过氧化氢为400 mmol/L时,果蝇体内GSH含量和CAT活力较对照组升高,可能是由于果蝇在低浓度过氧化氢刺激时,激活了果蝇体内的保护机制,诱导产生了GSH和CAT,进而及时清除自由基,避免自由基对果蝇的进一步损伤,而当过氧化氢浓度较高时,果蝇机体产生的自由基超过了机体的清除能力,即GSH和CAT产生的速度跟不上机体内自由基增加的速度,从而造成果蝇组织细胞的损伤,使GSH含量和CAT活力降低;当过氧化氢浓度为1 200 mmol/L时效果最为明显(P<0.05),这时果蝇体内GSH含量和CAT活性与对照组相比明显减少(P<0.05);当过氧化氢浓度较高时,果蝇可能因此提前衰老、死亡、运动能力减弱甚至丧失生育能力。
昆虫受到胁迫后会产生较多的ROS[21]。低水平的ROS对机体无害且在信号传输中起着很重要的作用[22]。当体内ROS水平超过一定浓度时可导致昆虫机体氧化损伤[7],为了有效防止ROS对机体的破坏,昆虫体内可形成一个包括酶和非酶组分的抗氧化系统网络[23]。过多的自由基细胞膜中的不饱和脂肪酸发生反应,可破坏生物大分子如DNA、蛋白质等的结构,进而导致机体疾病甚至死亡[24-25]。过氧化氢可通过破坏正常线粒体功能和损伤DNA诱导氧化应激,本研究果蝇GSH含量和CAT活性减少,说明过氧化氢降低了果蝇对自由基及其产物的清除能力,从而造成果蝇功能障碍。
本研究结果表明,果蝇寿命缩短、生育能力和运动能力下降的同时,其体内GSH含量和CAT活性也相应减少,说明过氧化氢对果蝇寿命、生育能力和运动能力的不利影响可能与其诱发的氧化损伤有关,机制可能是通过降低体内抗氧化组分含量从而减弱抗氧化损伤的能力,使得体内自由基积累导致损伤加剧,从而减弱了果蝇的生育能力和运动能力、加速了果蝇的死亡进程等。影响果蝇的生理生化功能的因素是多方面的,也是一个复杂且值得探讨的课题。本研究为过氧化氢对果蝇生长发育的危害提供了理论依据,可为农业园林害虫防治工作提供参考意见,一定程度上可促进农业园林业的发展,同时也可规范当下新冠肺炎疫情防控消杀用品等的正确使用。
