白藜芦醇激活SIRT1抑制高糖诱导的神经细胞凋亡
2021-04-19刘远波包太成李南京谭秋芬林小龙
刘远波,王 霞,包太成,李南京,谭秋芬,林小龙
(1. 惠州市第六人民医院神经内科,广东省惠州市516211;2.广州医科大学附属惠州医院惠州市第三人民医院病理科,广东省惠州市516002)
葡萄糖是中枢神经系统必需的能量底物,神经元需要大量的葡萄糖来满足其高能量的需求。与依赖胰岛素的肌肉细胞或脂肪细胞不同,神经元的葡萄糖摄取主要取决于其细胞外浓度。如神经元长期暴露于葡萄糖中会引起氧化应激,导致细胞损伤,并导致神经病理性并发症,如阿尔茨海默病(Alzheimer’s disease,AD)和帕金森病(Parkinson’s disease,PD)的发生[1-2]。最新的研究也显示PD的发生与2型糖尿病密切相关[3]。白藜芦醇(resveratrol,RESV)是一种多酚类天然化合物,其因强大的抗氧化、抗炎和心肌保护作用而备受关注[4]。近年来,大量研究证实RESV可以通过趋化因子受体4(CXC chemokine receptors 4,CXC4)、磷脂酰肌醇3激酶/丝氨酸-苏氨酸激酶(PI3K/Akt)等途径拮抗缺血再灌注所致的神经细胞损伤,进而保护神经细胞[5-6]。虽然白藜芦醇在神经退行性疾病中有较好的防御作用,但其在保护神经元免受高糖(high glucose,HG)损伤方面的作用及机制尚待阐明。沉默信息调节因子1(silence information regulator 1,SIRT1)是SIRT家族的重要成员,具有抗衰老的作用,研究显示,在脑缺血时SIRT1活性增强,细胞生命周期延长,抵抗应激能力增加,对致命性脑缺血起到神经保护作用[7]。此外,研究显示SIRT1在高糖诱导的神经细胞损伤时,具有拮抗氧化应激的能力[8],表明SIRT1可能是神经细胞拮抗应激损伤的重要靶标。因此,本研究拟以PC12细胞为研究对象,阐明RESV是否通过诱导SIRT1的活化抑制HG导致的PC12细胞凋亡。
1 材料和方法
1.1 材料
甲基噻唑基四唑仑(methyl thiazolyl tetrazolium,MTT)、Hoechst33258、20,70二氯荧光素二乙酸酯(DCFH-DA)、D-葡萄糖及白藜芦醇均购自美国Sigma公司;SIRT1、p-SIRT1、AMP活化蛋白激酶(adenosine 5′-monophosphate activated protein kinase,AMPK)、p-AMPK及SIRT1抑制剂均购自Abcam公司;PCR试剂盒购自北京康为世纪生物有限公司;所有细胞培养相关试剂均购自Thermo Fisher公司;增强化学发光(ECL)剂购自碧云天生物有限公司;其余试剂均购自国内外分析纯。
1.2 细胞培养及分组
PC12细胞用RPMI-1640培养基(含10%胎牛血清,100 kU/L青霉素及100 kU/L链霉素),在37 ℃5%CO2环境中培养。每2天传代1次。传代后,PC12细胞以2×106个/孔进行接种,接种条件为10%小牛血清孵育24 h,随后改为0.5%FBS RPMI-1640培养基饥饿24 h。
PC12细胞分为4组。对照组为5 mmol/L葡萄糖孵育24 h;高糖组(HG组)为50 mmol/L葡萄糖孵育24 h;白藜芦醇组为10 μmol/L白藜芦醇预处理2 h;高糖+白藜芦醇组为白藜芦醇组基础上用高糖处理24 h。
1.3 MTT检测
PC12细胞按5×103个/孔置于96孔板中,按照分组培养细胞。随后在每孔加入10 μL MTT溶液,于37 ℃孵育4 h。最后在光密度470 nm处进行测量,计算细胞存活率。
1.4 Hoechst33258核染色评估细胞凋亡
各组细胞处理后,用冰冻4%多聚甲醛固定30 min,随后浸泡于PBS溶液中20 min。PBS浸泡后用含5%山羊血清的0.3%TritonX-100封闭2 h。封闭完成后用PBS洗涤2次,每次20 s,最后加入10 mg/L Hoechst33258染液在常温暗室中孵育15 min。孵育完成后用荧光显微镜观察凋亡细胞情况。凋亡细胞表现出凝聚、断裂或扭曲的细胞核;活细胞表现出正常的核大小和均匀的荧光。
1.5 细胞内活性氧检测
通过测定DCFH-DA氧化形成的荧光产物,测定细胞内活性氧(reactive oxygen species, ROS)水平。去除培养瓶内培养基,随后PBS洗涤细胞3次。加入新鲜培养基后,用10 μmol/L DCFH-DA在37 ℃下孵育30 min。随后再用PBS再次洗涤细胞,荧光显微镜观察并采集图像。使用Image J 1.41软件测量5个随机场平均荧光强度,结果以各组荧光强度与试剂盒阳性试剂荧光强度的百分比表示。
1.6 蛋白印迹分析
收集各组细胞,提取各组细胞的总蛋白质,用BAC试剂盒(按说明书操作)测定各组蛋白质水平,按SDS-PAGE试剂盒操作说明,配置5%浓缩胶和10%分离胶进行电泳,电泳完毕后根据Marker显示的位置,切取各个目标蛋白所对应的相应胶带进行转膜,转膜条件为200 mA恒流2 h,随后用TBST配置5%牛奶封闭2 h。一抗过夜,兔抗SIRT1单克隆抗体(1∶2 000),兔抗p-SIRT1(Ser473)单克隆抗体(1∶2 000),兔抗AMPK多克隆抗体(1∶2 000),兔抗p-AMPK(Ser253)多克隆抗体(1∶1 000)。次日,将膜取出,在TBST中洗涤膜3次,随后加入二抗孵育2 h。然后在TBST洗涤3次,随后加入ECL发光试剂,并在天能5200SE凝胶系统中进行照片拍摄及分析。
1.7 实时荧光定量PCR
根据TRIZOL试剂说明书对相关的样本进行RNA提取。按照Taqman反转录试剂盒操作说明反转录1 μg RNA。根据试剂盒说明书中的方法,利用SIRT1和AMPK引物进行实时荧光定量PCR反应,并选择人GAPDH作为内参基因。引物序列如下:SIRT1前导链引物5′-TAG CCT TGT CAG ATA AGG AAG GA-3′,SIRT1后随链引物5′-ACA GCT TCA CAG TCA ACT TTG T-3′;AMPK前导链引物5′-TTG AAA CCT GAA AAT GTC CTG CT-3′,AMPK后随链引物5′-CAG GGA TGT GAT CGG CAC TT-3′。实时荧光定量PCR反应于实时荧光定量PCR仪(Roche)中,按程序进行。预温育50 ℃110 s,95 ℃120 s,1个循环;扩增60 ℃55 s,95 ℃15 s,55个循环;解链95 ℃15 s,65 ℃60 s,97 ℃3 s,1个循环;冷却37 ℃30 s,1个循环。
1.8 统计学方法
2 结 果
2.1 HG对PC12细胞SIRT1和AMPK表达及磷酸化的影响
与对照组比较,用50 mmol/L HG处理PC12细胞不同时间,SIRT1和AMPK RNA及总蛋白水平没有发生改变(图1),但磷酸化蛋白表达与对照组比较,磷酸化水平明显下调,并呈现出一定的时间依赖性。处理6 h后,p-SIRT1及p-AMPK的表达下降明显,在处理24 h时下降最为明显(P<0.05,P<0.01;图1)。
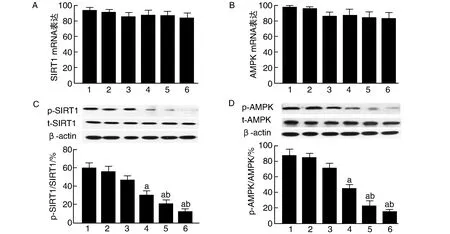
图1 HG对PC12细胞SIRT1和AMPK表达及磷酸化的影响A和B为RT-PCR检测结果;C和D为Western blot检测结果。1为对照组;2~6分别为HG 0、3、6、12和24 h组。a为P<0.05,b为P<0.01,与对照组比较。
2.2 RESV对HG处理PC12细胞SIRT1和AMPK表达及磷酸化的影响
RESV预处理30 min,随后HG处理细胞24 h,结果发现:与HG组比较,HG+RESV组可显著提高细胞内p-SIRT1的水平,但并不影响总SIRT1蛋白表达,对SIRT1下游分子AMPK蛋白进行检测,p-AMPK的表达水平与p-SIRT1表达相一致(P<0.05,P<0.01;图2)。
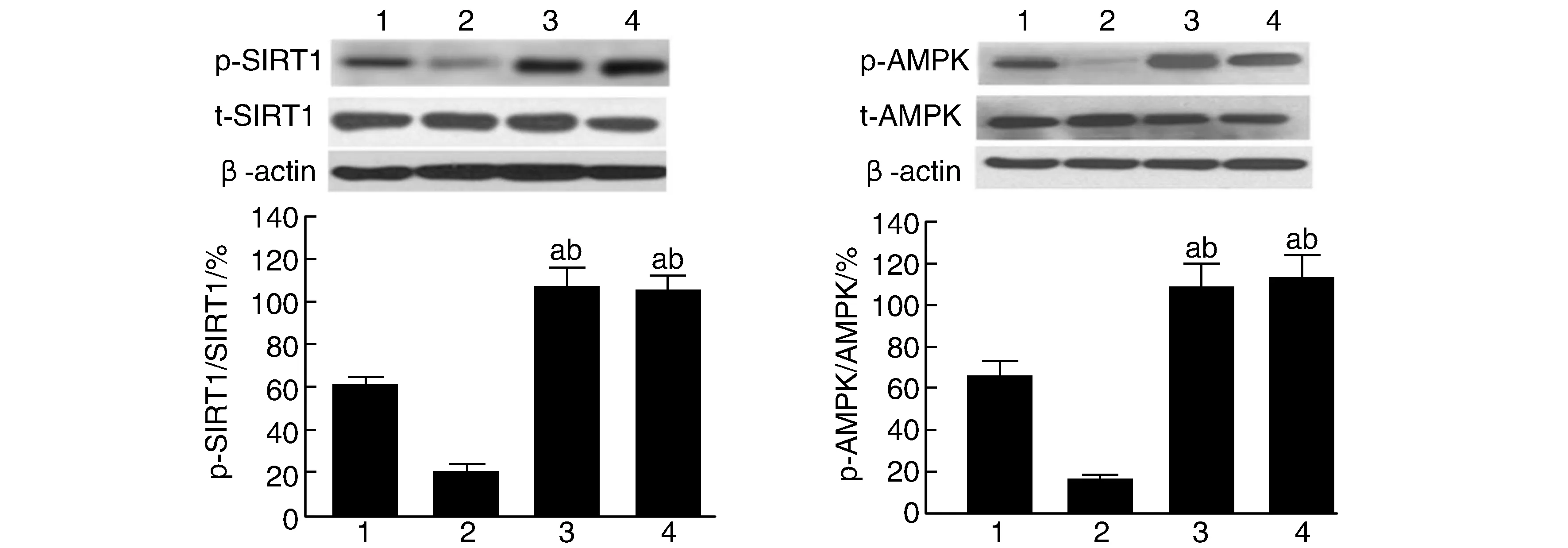
图2 RESV对HG处理的PC12细胞SIRT1和AMPK表达及磷酸化的影响1为对照组;2为高糖组;3为白藜芦醇组;4为高糖+白藜芦醇组。a为P<0.01,与对照组比较;b为P<0.01,与高糖组比较。
2.3 HG对PC12细胞ROS、凋亡率及存活率的影响
与对照组比较,HG处理6 h后PC12细胞ROS水平及凋亡率明显增加,细胞存活率明显降低,24 h时该作用更为显著(P<0.05,P<0.01;图3和表1)。
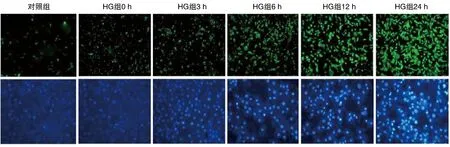
图3 HG对PC12细胞ROS水平及凋亡的影响上图为荧光光度法检测PC12细胞ROS水平(200×);下图为Hoechst33258核染色检测PC12细胞的凋亡情况(400×)。

表1 HG对PC12细胞ROS水平、凋亡率及存活率的影响 单位:%
2.4 RESV对HG诱导PC12细胞ROS、凋亡率及存活率的影响
RESV预处理30 min,随后HG处理细胞24 h,结果发现:与HG组比较,HG+RESV组细胞ROS水平和凋亡率明显下降,细胞存活率明显提升(P<0.05,P<0.01;表2和图4)。

表2 RESV对HG诱导PC12细胞ROS水平、凋亡率及存活率的影响 单位:%

图4 RESV对HG诱导PC12细胞ROS水平及凋亡的影响上图为荧光光度法检测细胞ROS水平(200×);下图为Hoechst33258核染色检测PC12细胞的凋亡情况(400×)。
3 讨 论
糖尿病患者血糖调节异常所导致高血糖状态是糖尿病神经病变的主要原因[9-10]。目前对于高血糖致神经病变的机制尚不清楚。越来越多的研究表明,氧化应激与代谢综合征、糖尿病、糖尿病神经病变和多种神经退行性疾病(如PD和AD)的进展有关[11-12]。而ROS的产生是氧化应激发生的基础。研究证实,高血糖持续存在可促进葡萄糖通过氧化作用形成晚期糖基化终产物产生ROS,进而对神经元产生直接毒性作用[13]。而持续的高糖刺激会上调神经细胞β-淀粉样前体蛋白裂解酶1表达及ROS的产生,进而活化低氧诱导因子-1α(hypoxia inducible factor-1,HIF-1α)及LXRα/ABCA1通路调节脂筏重组,最终导致细胞内β-淀粉样蛋白沉积及细胞的凋亡,进而促进AD的进展[14]。此外,高血糖会抑制天然抗氧化剂/活性氧清除机制,从而增加活性氧的累积,例如,高血糖会抑制硫氧还蛋白的ROS清除功能,硫氧还蛋白是一种通过p38 MAPK介导的硫醇还原酶[15]。而最新的研究发现,硫氧还蛋白互作蛋白(thioredoxin-interacting protein,TXNIP)在高血糖状态下神经细胞的表达明显提高,并抑制细胞内的线粒体自噬,增加细胞的ROS累积,促进神经细胞凋亡,进而加速PD的进展[16]。本文的结果同样显示,HG可促进胞内ROS产生并引起神经细胞的毒性作用,表明ROS产生可能是引起神经细胞损伤的重要基础。因此,抑制ROS的产生,对神经退行性病变的防治具有重要的意义。
白藜芦醇具有很强的抗炎、抗氧化及线粒体保护作用,并对神经退行性疾病具有一定的预防和治疗作用[17]。有研究证实,白藜芦醇可通过激活PI3K/Akt/Nrf2信号通路,上调血红素加氧酶-1的表达,抑制β淀粉样蛋白沉积诱导的氧化应激,有助于AD的治疗[18]。另有研究发现,白藜芦醇可通过激活AMPK/PI3K/Akt信号通路,上调Tau蛋白磷酸酶2的表达,下调Tau蛋白激酶糖原合成酶激酶-3β的表达,从而抑制Tau蛋白过度磷酸化,改善AD相关症状[19]。此外,通过研究鱼藤酮诱导的PD大鼠模型证实,白藜芦醇可通过激活谷胱甘肽过氧化物酶和Nrf2信号通路,显著下调CCAAT/增强子结合蛋白同源蛋白和葡萄糖调节蛋白78的表达,减弱Caspase-3和黄嘌呤氧化酶的活性,降低IL-1β水平,从而保护神经元免受内质网应激诱导的凋亡,恢复多巴胺水平,改善PD[20]。而课题组前期研究发现,白藜芦醇可以通过PI3K/Akt/Fox3a通路抑制HG诱导的神经细胞损伤[21],表明白藜芦醇具有拮抗HG诱导神经细胞凋亡的潜能,而这在本文中得到证实。SIRT1作为抗衰因子,其在脑缺血再灌注中的保护作用得到大量的研究证实,但在HG诱导的神经细胞损伤中是否也具有保护作用,尚未见过多的文献报道。本文在50 mmol/L HG诱导PC12细胞损伤模型中,白藜芦醇可以明显促进磷酸化SIRT1的表达,抑制HG所诱导的ROS产生,增强细胞存活率并抑制细胞凋亡,表明SIRT1可能是白藜芦醇保护神经细胞免受HG损伤的潜在靶标。课题组将会在将来的研究中进一步证实。
AMPK是调节细胞代谢、自噬等病理生理过程的重要因子,目前大量研究证实SIRT1可通过诱导AMPK的磷酸化参与保护缺血再灌注所致的心肌或者神经细胞的损伤[22]。而最新的研究显示,在HG诱导心肌细胞损伤中,白藜芦醇可以通过SIRT1/AMPK通路拮抗氧化应激所致的心肌损伤[23]。因此,本实验推测SIRT1/AMPK通路可能也参与白藜芦醇拮抗HG诱导神经细胞的损伤。故在本文中也对AMPK的表达以及磷酸化AMPK表达进行检测。结果显示,HG可抑制PC12细胞p-AMPK的表达,而白藜芦醇预处理后,HG的抑制作用被逆转,表明白藜芦醇可能是通过激活SIRT1/AMPK通路发挥神经保护作用,而这与以往文献的报道结果相似[24]。
综上,本研究结果提示HG可以抑制神经细胞SIRT1和AMPK的磷酸化,促进细胞内ROS的产生及细胞凋亡,而这种现象可被白藜芦醇所抑制。此外,SIRT1活化被抑制后,白藜芦醇的保护作用被逆转。表明白藜芦醇是通过激活SIRT1/AMPK通路抑制高糖诱导的神经细胞的凋亡。然而当前的研究仅限于体外实验,需要进一步体内实验进行验证,而这也是课题组将来实施的目标,而这可为白藜芦醇的神经保护作用提供新的理论依据,并为HG所致的神经退行性病变提供新的治疗靶标。
