一氧化氮参与盐胁迫下长春花酚类代谢的调控研究
2021-04-19赵晓菊张奕婷唐中华
赵晓菊 张奕婷 刘 佳 刘 洋 唐中华*
(1. 大庆师范学院生物工程学院,大庆 163712;2. 东北林业大学化学化工与资源利用学院,哈尔滨 150040)
目前,全球20%的灌溉土地受到土壤盐渍化的影响且范围不断扩大,严重影响农业生产和生态环境[1],盐胁迫除了影响植物生长发育外,对细胞膜脂质、蛋白质和核酸等细胞成分及次生代谢物的影响是及其复杂的[2]。一氧化氮(nitric oxide,NO)作为植物体内一种信号分子,在种子萌发、生长发育和衰老等过程中起到重要的调控作用,尤其是在逆境响应方面是国内外研究的热点,已有研究显示低浓度的NO 通过调节代谢过程提高植物耐盐性,但其调控机理尚不清晰[3-5]。药用植物长春花(Catharanthus roseus)因具有抗癌活性的生物碱(terpenoid indole alkaloids,TIAs)类,作为TIAs调控研究的模式植物而受到广泛关注[6~8],其次生代谢产物除TIAs外还含有大量的酚类化合物[9~10],酚类物质的积累,可能影响包括TIAs 在内的其他次生代谢途径[11]。外源施加氮素和盐胁迫下长春花体内TIAs 含量均有提升[12~13],对于同样条件下酚类化合物种类和含量变化鲜有报道,因此,对长春花酚类化合物代谢调控研究具有理论和实践意义。
酚类是苯环上至少含有一个酚羟基有机化合物的统称,在植物中含量极低但功效显著,具有显著的抗氧化活性[14]。根据酚类的化学结构主要分成3 类:①C6C1 碳骨架化合物,例如苯甲酸、对羟基苯甲酸和水杨酸(SA);②C6C3 碳骨架化合物,如对香豆酸、肉桂酸和阿魏酸;③C6C3C6 碳骨架化合物(黄酮类和异黄酮类化合物),如花青素、黄酮和黄酮醇等[11]。植物中酚类化合物有多种合成途径,主要有莽草酸途径和乙酸—丙二酸途径两种,高等植物大多通过莽草酸途径将初生物质转化为次生物质[15],苯丙氨酸作为莽草酸途径的枢纽物质,是大多数酚类化合物及其聚合物的合成前体[16]。
酚类化合物作为一种植物次生代谢产物,种类繁多,对外界环境响应变化迅速,代谢网络复杂,调控过程受到多种因素影响。目前,从代谢组水平进行测定和分析是研究酚类化合物重要且有效的手段。近年来,盐胁迫下酚类代谢物响应和调控在花生[17]、草莓[18]、鼠尾草[19]等经济作物中相继开展研究。在对长春花的研究中,有从代谢组和转录组水平联合分析乙烯和茉莉酸介导调控酚类代谢机制进行了探讨[20],对酚类化合物受光调控在光形态建成过程中发挥作用展开研究[21]。前期对外源NO 参与盐胁迫下长春花种子萌发和生理代谢研究表明,盐胁迫抑制长春花种子萌发和幼苗生长,0.1 mmol˙L-1SNP 有效缓解盐胁迫对长春花种子萌发和幼苗生长,大于0.5 mmol˙L-1SNP加重盐胁迫伤害[22],结合形态表型差异观察,本研究针对梯度浓度外源NO 供体SNP 处理盐胁迫下长春花植株不同部位,利用靶向代谢组学方法,采用高效液相色谱—四级杆—飞行时间质谱(LCESI-QTOF/MS)联用技术,综合分析酚类物质的组成和差异性变化,揭示NO 和盐胁迫下酚类物质代谢的响应,为酚类代谢调控和外源NO 提高植株耐盐机理研究提供参考,并对盐碱地开发利用具有实践意义。
1 材料与方法
1.1 材料培养
选取颗粒饱满的长春花种子(粉红花)用10%的NaClO 消毒后播种于湿润环境中,待长出真叶后移栽至装有蛭石的育苗盆中,定期浇灌1/2 的Hogland’s 营养液(pH=6.0),放置人工气候箱中培养,光照时间(日/夜12 h/12 h),温度(日/夜25℃/18℃),湿度为60%。
1.2 试验设计
随机选取长势相同的长春花幼苗,按试验编号0#、1#、2#、3#、4#、5#,依次为:CK、ST(50 mmol·L-1NaCl)、ST+50 µmol·L-1SNP、ST+75 µmol·L-1SNP、ST+100 µmol·L-1SNP、ST+125 µmol·L-1SNP,每隔3 d 浇灌处理1 次,连续3 次。于40 d 后分别取不同处理下长春花植株的根、茎、叶和花,-70℃冰冻保存待测。
1.3 试验方法
1.3.1 样品前处理与提取
长春花不同部位组织样品,加冷冻钢珠在30 Hz下研磨(MM400,Retsch)1 min。称取50 mg 的粉末,1 mL 70%甲醇(含0.1 mg·L-1利多卡因作为内标)4℃提取过夜,期间涡旋3 次。提取后,10 000 r·min-1离心10 min,吸取上清,用微孔滤膜(SCAA-104,0.22 µm pore size;ANPEL)过滤,保存在进样瓶中用于色谱质谱分析。
1.3.2 LC-MS分析[23]
色谱条件:流动相A 为水(含0.04%的乙酸),流动相B 为乙腈(0.04%的乙酸);梯度洗脱程序为:0~20 min,5%B~95%B;20~22.1 min:95%B~5%B;22.1~28 min:5%B~5%B;流速为0.5 mL·min-1;柱温保持40℃;进样量为5 µL。分离的样品接着进入ESI-QTOF/MS(Agilent 6520 QTOF/MS)进行质谱分析。
质谱条件:质谱采集数据时的参数设置为:氮气,40 psi;干燥器,10 L·min-1,350℃;毛细管电压,3500 V;碎裂电压,135 V。扫描范围为50~1 000 m·Z-1。ESI正离子模式下进行分析。
1.4 统计分析
每个样品3 次重复,得到绝对峰面积(peak ar⁃ea)数据归一化处理后,对样品进行主成分分析(Principal Component Analysis,PCA),采用SPSS 17.0 进行数据统计和显著性分析,应用HemI 软件和GraphPad Prism 5.0进行绘图。
2 结果与分析
2.1 NO处理盐胁迫下长春花中酚类化合物种类
针对长春花根、茎、花和叶不同部位组织材料,结合总离子流色谱图,检出L-苯丙氨酸(L-Phe⁃nylalanine)和18种酚类物质,其中,C6C1结构酚类化合物5 种,C6C3 结构酚类化合物5 种,C6C3C6结构酚类化合物8种,具体种类和化学结构式详见图1和表1。
2.2 NO处理盐胁迫下长春花中酚类化合物响应
对上述鉴定的酚类化合物和L-苯丙氨酸进行PCA 分析,借以反映在不同处理下长春花根、茎、花、叶4个部位整体变化水平。
通过对酚类主成分Q 值的分析可以看出,盐胁迫及施加外源NO 对长春花根、花和叶酚类物质无显著变化,但在长春花茎中酚类物质变化规律明显,即50 mmol˙L-1NaCl 胁迫(1#)下明显高于对照组(0#),随着在盐胁迫中加入50、75、100、125µmol˙L-1SNP(2#、3#、4#、5#),酚类物质随总SNP浓度的增大而上升,但相对总含量仍低于对照和盐胁迫下。
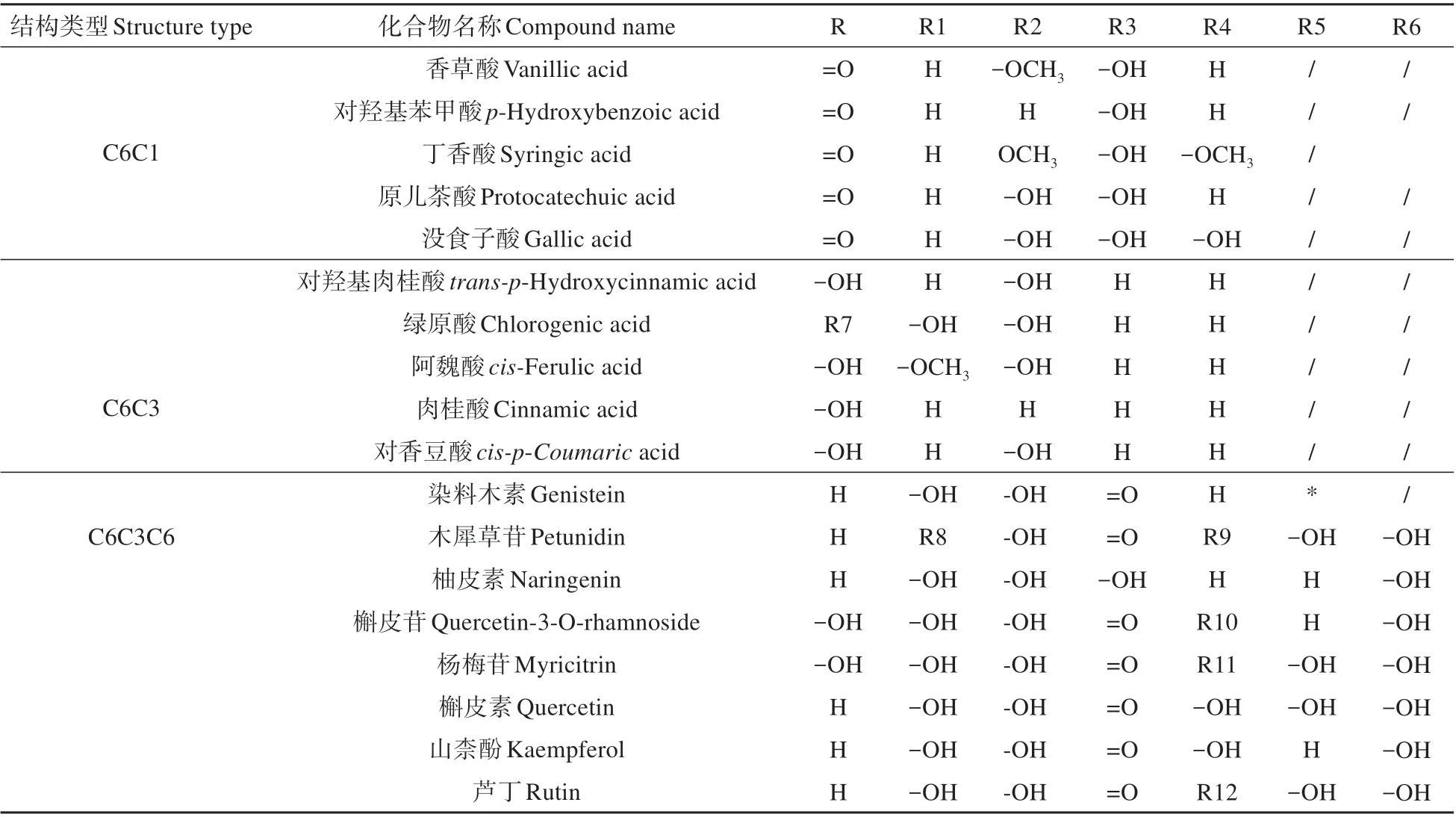
表1 长春花中酚类化合物的名称和结构类型Table 1 The Compound name and types of phenolic compounds in C.roseus
从图3A 长春花根部酚类化合物聚类分析可以看出,正常对照与盐胁迫归为一类,而盐胁迫基础上施加SNP 归为一类,由此说明外源NO 对盐胁迫下根部酚类化合物的积累有显著影响。根部富集C6C1 类化合物主要包括丁香酸、没食子酸和香草酸等,C6C3 类有对羟基苯甲酸和肉桂酸等,所以,从整体上看,根部酚类物质积累以小分子酚酸类化合物为主。随外源SNP 浓度增加(50~125µmol˙L-1),肉桂酸和没食子酸相对含量下降,对羟基苯甲酸、丁香酸和香草酸相对含量上升。C6C3C6 类槲皮素在盐胁迫和施加外源SNP 后均呈下降趋势,根中的槲皮素可能在NO 对盐胁迫的缓解效应中发挥一定作用。
茎和根中酚类化合物聚类分析表现一致(见图3A~B),即对照和盐胁迫归一类,施加SNP 归一类。茎中酚类化合物积累以小分子酚酸类化合物为主,如丁香酸、原儿茶酸、绿原酸等,也包含C3C6C3 类化合物柚皮素和染料木素。这些化合物在盐胁迫下施加低浓度NO(ST+50 µmol·L-1SNP,2#)积累显著,且随着NO 浓度增大呈下降趋势。在盐胁迫下茎中积累山奈酚、槲皮苷和木犀草苷C3C6C3黄酮类化合物,对抵御盐胁迫起到一定作用(见图3B)。
叶片中富集的酚类化合物有原儿茶酸、绿原酸、杨梅苷、芦丁等,这些化合物在盐胁迫下施加高浓度NO(ST+125 µmol·L-1SNP,5#)处理下,相对含量呈下降趋势。在盐胁迫下,叶片中阿魏酸和对香豆酸含量显著增加,可能与叶片中酚类对盐胁迫响应相关(见图3C)。
花中主要积累C3C6C3类化合物,如木犀草苷和槲皮苷,在高浓度NO(ST+125 µmol·L-1SNP,5#)处理下含量增加明显(见图3D)。结合本试验过程中对花的形态学变化初步观察,盐胁迫下花盘直径较正常对照小,盐胁迫会造成长春花的颜色变浅,试验选取的粉红色长春花有变为粉白色花,在外源SNP作用下更偏向白色。ST+75µmol·L-1SNP(3#)处理下,长春花植株未开花,在其叶片中出现了开花植株叶片中没有的丁香酸和香草酸,在未开花植株的根、茎、叶中绿原酸相对含量最高,Lavee 等报道了橄榄树结果的枝条在开花诱导期绿原酸水平较高,而没有结果的枝条绿原酸含量较低[24],酚类不仅影响花的颜色,与植物开花关系密切。
2.3 L-苯丙氨酸在长春花不同器官中的分布
本试验中,在茎(见图4B)和叶(见图4C)中酚类化合物合成前体L-苯丙氨酸的相对含量大于根(见图4A)和花(见图4D)中含量。而茎中L-苯丙氨酸的相对含量在盐胁迫下(1#)高于对照组(0#),且随外源NO浓度增高而下降(见图4),这与茎中的酚类相对总含量随NO 浓度增高而上升一致(见图2)。盐胁迫条件下,茎中酚类化合物和合成前体L-苯丙氨酸相对含量均增加,间接证明胁迫条件下,作为防御物质的酚类化合物生成主要依靠其合成前体L-苯丙氨酸的增加来促进。
图5 展示长春花不同部位L-苯丙氨酸相对总含量情况,可以看出在盐胁迫下施加50 µmol·L-1SNP(2#)处理下相对总含量最高,随着NO 浓度增加而下降。从酚类化合物和其前体L-苯丙氨酸相对含量来看,茎和叶中较高,同时酚类物质种类也较多,长春花茎和叶适合作为研究酚类化合物的选取材料。
3 讨论
本试验检测出长春花不同部位18种酚类化合物,其中C6C1 类5 种,C6C3 类5 种,C6C3C6 类8种,与前人对长春花酚类化合物综述和研究相比较[11,20],与本文检测主要酚类物质相似,主要相同的有C6C1 类的香草酸、丁香酸、没食子酸;C6C3类的绿原酸、阿魏酸、肉桂酸、对香豆酸;C6C3C6类中的木犀草苷、柚皮素、杨梅苷、槲皮素和山柰酚。本试验鉴定的酚类种类少于报道数量,主要由于本试验采用针对少数已知代谢物定性和定量的靶向分析技术,另外酚类化合物不仅在不同品种间存在差异,在不同植物组织之间代谢物含量也存在较大差异,代谢物对外界条件响应迅速,胁迫处理条件和时间的不同也是造成差异的原因。
运用PCA 方法,胁迫条件下长春花根、叶和花中酚类相对总含量差异并不显著,而茎中酚类化合物相对总含量在盐胁迫显著提升,茎是植物地下根部与叶片和花的连接部分,其中酚类物质大量积累,不仅提高植株整体酚类化合物来抵御不良环境侵害,也便于向根、叶等部位进行转运。逆境胁迫下酚类物质的积极响应是植物一种防御功能,盐胁迫会导致酚类合成途径中相应基因水平上调,对盐敏感品种上调幅度更大[25],NO 信号对酚类代谢物缓解胁迫伤害中起到一定作用[26]。
长春花在盐和SNP 协同处理下,地下根部和地上茎部中聚类分析相似,正常对照和盐胁迫归为一类,施加SNP 归为一类。SNP 作为外源NO 供体,其溶液释放NO 速度通常在6 h内完成,从根际浇灌处理可诱导植物组织内源NO 的积累[27],根和茎中酚类物质以小分子酚酸为主,对盐胁迫和施加SNP响应更为敏感。
苯丙氨酸被认为是植物酚类化合物代谢中的共同前体,通常用酚类化合物合成过程中的关键酶苯丙氨酸解氨酶(PLA)来间接反映酚类物质生成的速率[28]。在番茄(Solanum lycopersicum)[29~30]、白杨(Populus tremula)[31]等植物中,常利用综合组学的方法对苯丙氨酸通路展开研究。本试验茎中L-苯丙氨酸相对含量随着SNP 浓度的增大呈下降趋势,与茎中酚类相对总含量趋势相反,间接证明苯丙氨酸是酚类合成的前体。
4 结论
在盐胁迫和外源NO 双重作用下,长春花不同部位酚类代谢物的响应和积累不同,根和茎中以小分子酚酸类为主,花和叶中C3C6C3类为主。从聚类分析上看,根和茎对盐胁迫及NO 处理响应敏感,茎和叶中酚类物质种类和相对含量较高,适合作为代谢组分析材料。目前虽然对植物酚类物质代谢途径已取得较大进展,在不同处理条件和植物不同部位酚类代谢合成、转运途径网络复杂,需要进一步结合多组学分析方法,从多层次和多因素相互作用的全局角度进行整合研究,揭示和构建酚类代谢过程。
