下调Notch1基因促进人肝癌细胞系HepG2自噬
2021-04-16李长安刘春秀谢晓娟孙爱平
李长安,刘春秀,谢晓娟,孙爱平
(1.新乡医学院第三附属医院 感染科,河南 新乡 453000; 2 新乡医学院 免疫学教研室,河南 新乡 453000)
肝细胞癌(hepatocellular carcinoma,HCC)是临床最常见的原发恶性肿瘤之一,每年全球新增肝癌患者高达63万例,病死率居于各种恶性肿瘤的第二位。目前,HCC最重要的治疗方法仍是手术切除[1-2],但是外科手术切除具有严格的手术指征,且术后存在较高的复发率。部分肝癌患者在就诊时已属于肝癌晚期,就诊时已丧失了最佳手术时机,因此,寻找HCC发生发展的分子机制具有重要临床意义。Notch1信号通路是参与多种细胞的发育、增殖、分化和凋亡的重要通路[3]。而PI3K/Akt/mTOR信号途径在细胞增殖、分化等生理过程中发挥重要作用。Notch1蛋白的表达可能参与了Akt/mTOR信号通路的激活[4]。自噬是高度保守的生命现象,主要是指细胞内溶酶体降解细胞内物质转变成有用的物质供细胞利用,并排出废物的过程,其贯穿了细胞的增殖、分化及凋亡各个阶段。本研究观察了Notch1基因的表达对肝细胞癌的增殖、凋亡及细胞内自噬水平及Akt/mTOR信号通路相关蛋白的影响。
1 材料与方法
1.1 材料
1.1.1 临床资料:选择2017年1月至2019年12月于新乡医学院第三附属医院行肝癌手术治疗患者的肝癌组织32例作为肝癌组,同一部位的癌旁组织作为癌旁组。所有患者均于术后行病理检查,确诊为原发性肝细胞癌,并依据美国肿瘤联合会(AJCC)第七版TNM分期系统进行分期,所有患者术前均未给予放疗、化疗或者靶向治疗等抗肿瘤措施,且均未发现肿瘤远处转移。所有患者均知情同意,并签署知情同意书。且本研究已获得医院伦理委员会批准(伦理审批号:20170119)。
1.1.2 试剂:人肝癌细胞系HepG2(ATCC公司);RPMI1640培养液及胎牛血清(杭州四季青生物制品公司);LipofectamineTM2000转染试剂、RNA提取试剂盒、RT-PCR试剂盒(Invitrogen公司产品);AmiexinV/PI双染试剂盒(BD公司);Notch1、BCL-2、Bax、cleaved caspase-3、Akt、p-Akt、p-mTOR、p-P70S6K和β-actin鼠抗人一抗(均Santa Cruz公司)。
1.2 方法
1.2.1 细胞的培养及转染:用含20%胎牛血清的RPMI1640培养液培养人肝癌细胞系HepG2进行传代培养,培养条件:37 ℃、5% CO2、饱和湿度,当细胞呈对数增殖期时进行后续实验。以2×106个/孔接种于6孔培养板上,分别设置对照组、NC siRNA组及Notch1 siRNA组,每组均设3个复孔。将Opti-MEM 250 μL与LipofetamineTM2000 15 μL、NC siRNA对照1.0 μg、Notch1 siRNA1.0进行稀释,并于24 ℃下放置5 min后与NC siRNA及Notch1 shRNA混合,于24 ℃下放置20 min,并将转染复合物加入含有细胞的无抗培养液中,继续培养48 h后,检测Notch1 mRNA及蛋白的相对表达水平。
1.2.2 荧光定量PCR检测Notch1 mRNA的表达:RNA提取试剂盒提取肝癌组织及细胞的总RNA并合成cDNA。使用ABI 7500荧光定量PCR仪进行荧光定量PCR的检测。引物由Invitrogen公司设计并合成。引物序列:Notch1上游引物:5′-GCCTCAA CATCCCCTACAAGA-3′,下游引物:5′-CCACGAAG AACAGAAGCACAAA-3′;β-actin上游引物:5′-CG AGCGGGAAATCGTGCGTGACATTAAGGAGA-3′,下游引物:5′-CGTCATACTCCTGCTTGCTGATCCACA TCTGC-3′。PCR扩增步骤95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火/延伸60 s,共40个循环,并加测溶解曲线以验证扩增产物的特异性。数据以2-△△Ct法进行分析。
1.2.3 MTT法检测细胞的增殖:转染48 h后,在37 ℃、5% CO2、饱和湿度下继续培养细胞,分别于24、48、72和96 h收集细胞,将细胞置于96孔板中,每孔分别加入MTT 20 μL,继续培养4 h,离心后弃去上清,每孔加入DMSO 150 μL,避光条件下振荡混匀10 min,在492 nm和630 nm的波长上检测细胞的增殖率,实验重复3次。
1.2.4 流式细胞测量术检测细胞的凋亡:转染48 h后,在37 ℃、5% CO2、饱和湿度下继续培养细胞24 h,严格按照AnnexinV和PI双染试剂盒的说明书处理细胞,流式细胞测量术检测细胞的凋亡率。
1.2.5 蛋白免疫印迹法检测细胞凋亡相关蛋白、自噬相关蛋白及对Akt/mTOR信号通路相关蛋白的表达:转染48 h后,在37 ℃、5% CO2、饱和湿度下继续培养细胞24 h,离心收集细胞,加入含有磷酸酶抑制剂的细胞裂解液裂解细胞,提取细胞总蛋白,BCA法进行蛋白定量后,给予SDS-PAGE分离蛋白,转膜,5%脱脂牛奶封闭1 h,加入一抗,4 ℃过夜后,加入1∶5 000比例的二抗,24 ℃孵育1 h,ECL化学发光法显色,以β-actin为内参照,AlphaDigiDoc图像分析软件分析目的蛋白的相对表达量。
1.3 统计学分析
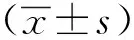
2 结果
2.1 Notch1基因在肝癌组织中的表达
Notch1基因在原发性肝细胞癌组织中的相对表达量为(1.865±0.791),显著高于癌旁组织的(0.709±0.414)(P<0.001)。
2.2 下调Notch1的表达可抑制肝癌细胞的增殖
Notch1 siRNA组中Notch 1 mRNA及蛋白的表达均显著低于NC siRNA组和对照组(P<0.001)(图1A~C)。提示Notch1 siRNA转染成功,Notch1的表达被成功抑制。 Notch1 siRNA组24、48、72及96 h的细胞增殖率显著低于阴性对照组及空白对照组(P<0.001)(图1D)。
2.3 下调Notch1的表达对肝癌细胞凋亡的影响
转染48 h后,Notch1 siRNA组细胞的凋亡率显著高于NC siRNA组和对照组(P<0.001)。且Notch1 siRNA组细胞的Bax水平显著高于NC siRNA组和对照组,Bcl-2、cleaved caspase-3的表达显著低于NC siRNA组和对照组(P<0.001)(图2)。
2.4 下调Notch1的表达对肝癌细胞自噬相关蛋白的影响
转染48 h后,Notch1 siRNA组细胞中自噬相关蛋白LC3B、Beelinl、ATG7和ATG5的表达量显著高于NC siRNA组和对照组(P<0.001)(图3)。
2.5 下调Notch1的表达对肝癌细胞中Akt/mTOR信号途径相关蛋白的影响
转染48 h后,Notch1 siRNA组的mTOR信号途径相关蛋白p-Akt、p-mTOR、p-P70S6K表达量显著低于NC siRNA组和对照组(P<0.001)(图4)。
3 讨论
恶性肿瘤的病理形成过程发生发展中伴随着Notch信号通路的异常活化[5-6]。Notch1是Notch受体中与肿瘤发生发展关系最为密切的基因。Notch1在肝细胞癌组织中的阳性表达率均高于癌旁肝硬化和癌旁正常组织,其对肝细胞癌的发生发展起促进作用[7]。干扰Notch1的表达能够抑制肝癌细胞的侵袭、转移[8]。因此,Notch1在肝癌的发生发展中发挥促癌基因的作用。本研究结果显示,Notch1在原发性肝细胞癌组织中的相对表达量显著高于癌旁组织。同时,下调Notch1的表达后,肝癌细胞HepG2 24、48、72及96 h的细胞增殖率显著降低,凋亡率显著增高,Bax水平显著增高,Bcl-2、cleaved caspase-3的表达显著降低,进一步证实了Notch1在肝癌组织中呈高表达,且其与肝癌细胞的增殖与凋亡密切相关。
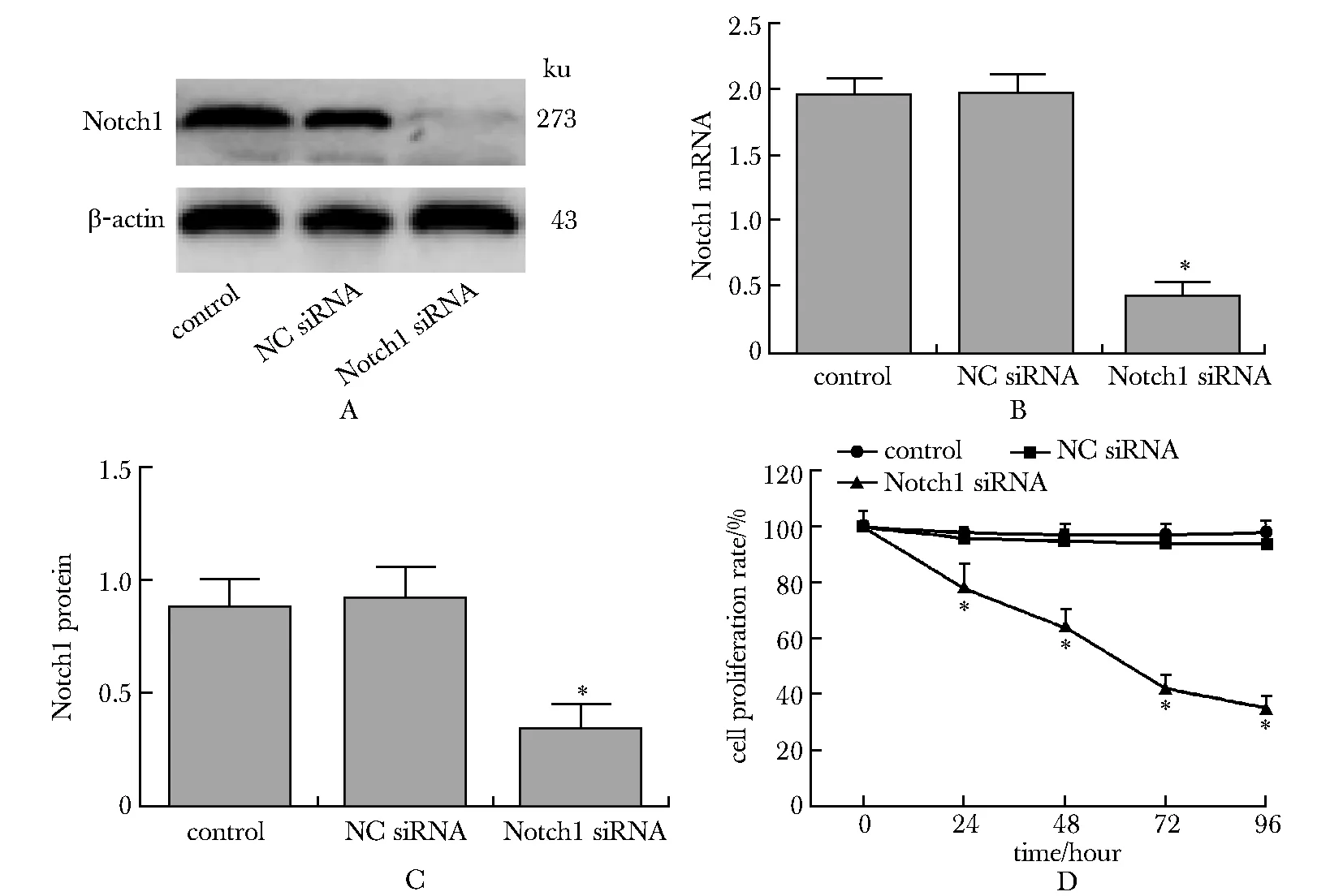
A.expression of Notch1 protein detected by Western blot; B.bar graph of Notch1 protein expression; C.expression of Notch1 mRNA detected by fluorescence quantitative PCR; D.cell protiferation detected by MTT method;*P<0.001 compared with control and NC group
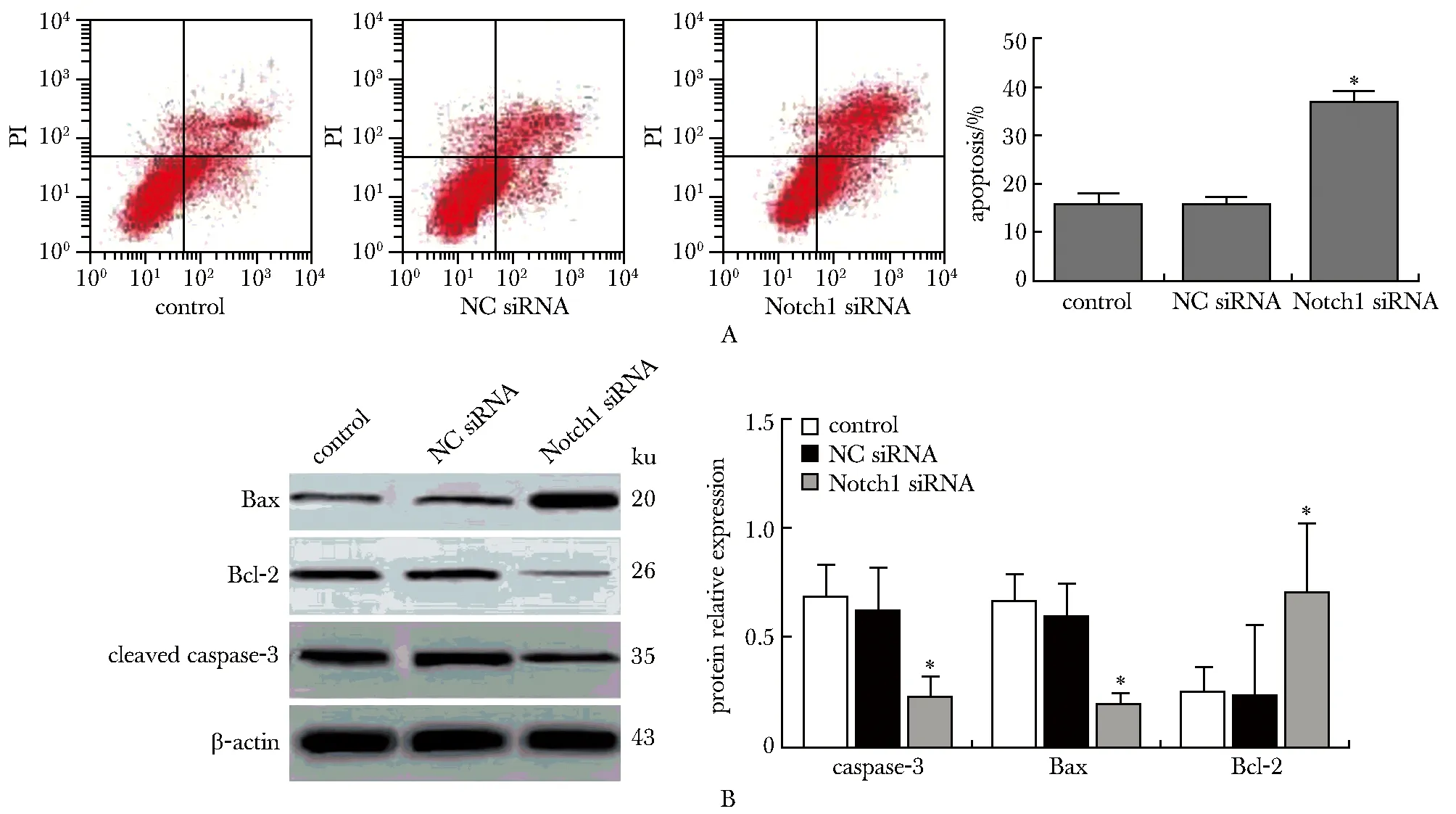
A: apoptosis of liver cancer cells by flow oytometry;B:expression of apoptosis-related proteins detected by Western blot; *P<0.001 compared with control and NC group
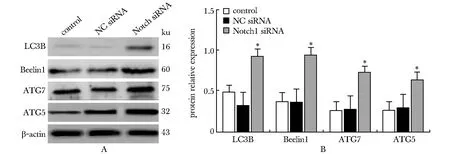
A.expression of autophagy-related proteins by Western blot; B.bar graph of autophagy-related protein expression;*P<0.001 compared with control group and NC group
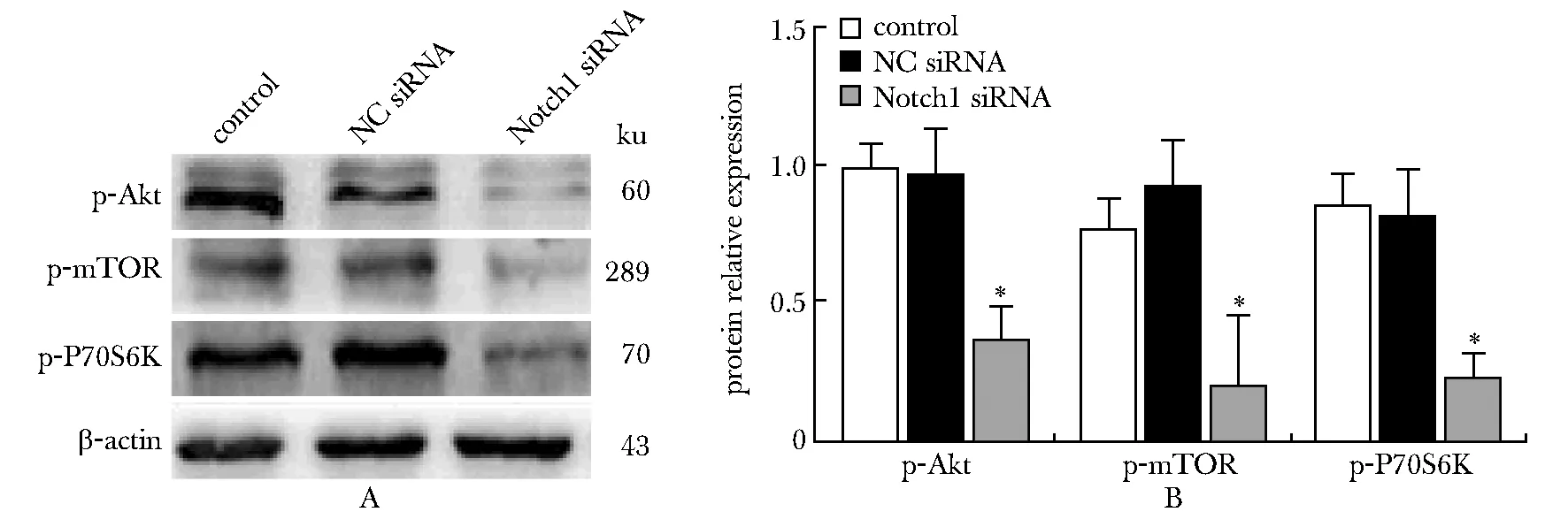
A.expression of Akt/mTOR signaling pathway related proteins by Western blot; B.bar graph of Akt/mTOR signaling pathway related proteins expression;*P<0.001 compared with control group and NC group
自噬是细胞代谢过程进行自我消化的正常生理过程,在此过程中细胞内的物质由溶酶体降解并重新利用,同时排出代谢废物,这一过程贯穿于细胞的全部生命活动过程中,对于维持细胞的内环境稳定、修复机体病理损伤发挥积极作用[9-10]。因此,在肿瘤细胞中提高细胞的自噬水平有利于抑制肿瘤细胞的增殖与发展。LC3B、Beelinl、ATG7和ATG5是机体自噬过程中重要的标志性蛋白[11-12]。本研究结果显示,转染48 h后,Notch1 siRNA组细胞中自噬相关蛋白LC3B、Beelinl、ATG7和ATG5的表达量显著高于NC siRNA和对照组,提示抑制Notch1的表达可有效促进肝癌细胞的自噬。
P13K-Akt-mTOR信号通路在多种恶性肿瘤中呈现激活状态,促进了肿瘤的发生发展[13-14]。在胶质瘤细胞中P13K-AKT-mTOR信号通路的表达上调,而给予mTOR抑制剂成功阻断该通路后,胶质瘤细胞的自噬水平显著升高,抑制肿瘤生长[15]。同时,Notch1基因与P13K-AKT-mTOR信号通路的激活密切相关。研究发现,在胶质瘤细胞中阻断Notchl后,P13K-AKT-mTOR信号通路的活性也被抑制,细胞内自噬水平升高,促进了细胞的凋亡。本研究结果显示,转染48 h后,Notch1 shRNA组的mTOR信号途径相关蛋白p-Akt、p-mTOR、p-P70S6K表达量显著低于NC siRNA和对照组,提示下调Notch1的表达能够降低Akt/mTOR信号通路相关蛋白的磷酸化水平,抑制该通路的激活,而其抑制Notch1的表达可有效促进肝癌细胞的自噬可能与此有关。
综上所述,Notch1在原发性肝细胞癌组织中呈高表达,而下调Notch1的表达可显著抑制肝癌HepG2细胞的增殖,诱导细胞的凋亡,提高细胞的自噬水平,其机制可能与抑制Akt/mTOR信号通路有关。
