低氧微环境促进人乳腺癌细胞系MCF-7的侵袭和增殖
2021-04-16王海燕黄明全潘广锐汪贵林
王海燕,黄明全,潘广锐,汪贵林,梁 斌,权 毅
(西南医科大学附属医院 乳腺外科,四川 泸州 646000)
女性恶性乳腺肿瘤现已成为世界公认的卫生问题,2型糖尿病(type 2 diabetes,T2D)是乳腺癌的独立危险因素,患2型糖尿病的女性患乳腺癌的风险较未合并糖尿病的女性提高了约17%[1]。合并2型糖尿病乳腺癌患者预后较差,促进乳腺癌转移的潜在机制仍未清晰。研究表明,肿瘤低氧微环境是恶性肿瘤的基本特征之一,局部微环境低氧对肿瘤细胞增殖、浸润和转移等恶性生物学行为的发生有显著影响[2]。低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)通过上调靶基因在促肿瘤发生中起重要作用,这些靶基因涉及能量代谢、血管生成、细胞存活、侵袭、转移和耐药[3]。蛋白酶激活受体(protease activated receptor,PAR)-1的异常表达与肿瘤的侵袭性以及癌细胞的存活率有关,缺氧增强了乳腺癌细胞中PAR-1的表达[4]。血管内皮生长因子(vascular endothelial growth factor,VEGF)可由多种细胞分泌,包括癌细胞和外周血单个核细胞,在低氧环境中受HIF-1α调控[5]。研究发现乳腺癌中HIF-1α、PAR-1、VEGF表达异常,但其在低氧微环境下对乳腺癌生物学行为的影响尚缺乏深入的研究[3-5]。因此,本研究分析合并2型糖尿病乳腺癌组织中HIF-1α、PAR-1、VEGF表达及低氧微环境对MCF-7细胞侵袭和增殖及HIF-1α、PAR-1、VEGF表达的影响,对指导此类乳腺癌患者的个性化治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 标本来源:选择2016年1月至2019年6月在西南医科大学附属医院合并2型糖尿病乳腺癌手术切除送检的标本37份,同期手术切除的乳腺癌癌旁组织作为对照。其中乳腺癌组织标本来源患者年龄31~69岁,平均(46.9±11.2)岁。所有患者均经组织病理和影像学检查确诊;手术治疗前均未行放化疗治疗,均为首次确诊,入院前无恶性肿瘤病史及慢性传染性疾病史。标本来源患者年龄无显著差异。所有样本已获得西南医科大学附属医院伦理委员会的审查批准及受试者知情同意。
1.1.2 主要试剂:人源性乳腺癌细胞系MCF-7(中科院上海细胞生物所细胞库),细胞计数试剂盒-8(CCK-8)和BCA蛋白检测试剂盒(上海碧云天生物技术有限公司),胎牛血清(Hyclon公司),青霉素、链霉素(杭州四季青生物工程材料有限公司),RNA提取试剂盒(北京宝日医生物技术有限公司),反转录试剂盒(大连宝生物工程有限公司),SYBR Green荧光染料试剂盒(Roche公司),引物序列(上海生工生物技术有限公司),抗-HIF-1α、-PAR-1、-VEGF、-β-catin抗体(一抗)和抗IgG抗体(二抗)(Abcam公司)。
1.2 方法
1.2.1 免疫组化检测HIF-1α、PAR-1、VEG表达:固定的组织经脱蜡、水合、热诱导抗原修复后,加入HIF-1α、PAR-1、VEGF一抗,室温培养1 h。使用生物素标记的二抗,新鲜配置的DAB溶液显色,苏木精复染,脱水,二甲苯透明,中性树胶封片,用奥林巴斯-Bx41显微镜观察,并用Image-Pro Plus软件进行分析。
1.2.2 计数微血管密度(microvessel density,MVD):切片通过低倍光镜视野下选取血管分布最为集中的高血管密度区域,在高倍镜视野下观察CD34呈棕黄色的血管数量,随机选取5个视野进行计数,以5个视野血管数的平均值计为该例肿瘤的MVD值,排除存在炎性反应、坏死的血管。
1.2.3 乳腺癌MCF-7细胞的培养:将MCF-7置于10%小牛血清、1%青链霉素混合液的DMEM培养基传代培养,取对数增殖期细胞,制成细胞悬液,调整浓度为2×107个/L,把细胞悬液按每孔150 μL接种于96孔板,分为对照组(5.6 mmol/L葡萄糖)、高糖组(30 mmol/L葡萄糖)、低氧组(1% O2,5% CO2,94% N2)、高糖低氧组(30 mmol/L葡萄糖+1% O2,5% CO2,94% N2),每组设置6个复孔,低氧组设置参数于三气培养箱进行培养,于培养24及48 h后在倒置相差显微镜下观察细胞形态、拍照。
1.2.4 CCK-8检测细胞增殖:将细胞接种于96孔板中,培养结束前每孔加入10 μL CCK-8溶液,37 ℃培养4 h,肉眼观察细胞孔中颜色由黄色变成深橙色,通过酶标仪在450 nm处测定吸光度。
1.2.5 Transwell小室法检测细胞侵袭:细胞经胰蛋白酶消化后,用不含血清的细胞培养液把细胞调整为1×104个/mL,在实验前3 h,取基质胶加入到Transwell小室中,于37 ℃孵育湿化3 h,待基质胶凝固后,在小室中加入不含胎牛血清的细胞培养液继续孵育40 min,取适量的细胞悬浮液加入Transwell小室中,放在24孔板中,小室外侧加入细胞培养液,37 ℃孵育48 h后,用PBS洗涤Transwell小室,把没有穿膜的细胞用棉签擦掉,4%多聚甲醛固定,结晶紫染色30 min,随机选取每孔6个视野,并通过显微镜观察侵袭细胞数。
1.2.6 RT-qPCR检测HIF-1α、PAR-1、VEGF mRNA:RNA提取试剂盒提取各组细胞中总RNA,反转录试剂盒合成cDNA,荧光定量PCR仪进行RT-qPCR。引物序列:HIF-1α:上游5′-CATCCAAGAAGCCCTA ACGTGT-3′,下游5′-TTAACTTGATCCAAAGCTCTG AG-3′;PAR-1:上游5′-GCCTGCTTCAGTCTGTGCG-3′,下游5′-CAATCACTGCCGGAAAAGTA-3′;VEGF:上游5′-ATGGCAGAAGGAGGAGGGCAGAATCA-3′,下游5′-GGGCACACAGGATAACTTGAAGATGT-3′;GADPH:上游5′-ATCCCATCACCATCTTCCCA G-3′,下游5′-CCATCACGCCAGTTTTCC-3′,以GAPDH内参。反应参数为95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火20 s,70 ℃延伸20 s,40个循环,2-△△CT用于定量比较。
1.2.7 Western blot检测HIF-1α、PAR-1、VEGF蛋白表达:RIPA裂解液提取细胞总蛋白,在冰上裂解细胞,使用BCA蛋白浓度测定试剂盒检测蛋白浓度,加热使蛋白样品变性,SDS-PAGE分离,转至PVDF膜上,封闭1 h。一抗HIF-1α、PAR-1、VEGF均1∶500稀释和β-catin在4 ℃过夜,二抗室温孵育1 h。以β-actin为内参,ECL化学发光试剂盒暗室显色,通过Image-ProPlus软件分析吸光度值。
1.3 统计学分析
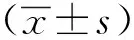
2 结果
2.1 乳腺癌及癌旁组织中HIF-1α、PAR-1、VEGF表达及MVD计数
乳腺癌组织HIF-1α、PAR-1、VEGF表达及MVD计数均明显高于癌旁组织(P<0.05)(图1A~H)。
2.2 低氧、高糖对MCF-7细胞形态的影响
与培养24 h相比,48 h各组细胞的数量明显增多(P<0.01)(图2)。
2.3 低氧、高糖对MCF-7细胞侵袭和增殖的影响
与对照组比较,低氧高糖组MCF-7穿过基膜的细胞数及细胞存活率明显升高(图3A~C)。
2.4 低氧、高糖对MCF-7细胞HIF-1α、PAR-1、VEGF表达的影响
低氧组、低氧高糖组HIF-1α、PAR-1、VEGF mRNA及蛋白表达较对照组明显升高(P<0.05)(图4A,B)。
3 讨论
乳腺癌是女性癌死亡的主要原因之一,严重威胁着女性健康[1]。随着肿瘤细胞的不断增殖,细胞的耗氧量随之不断增加,使得肿瘤局部微环境低氧。由于合并2型糖尿病乳腺癌患者长期处于高糖微环境,从而加深组织缺氧,促进肿瘤细胞增殖,诱导肿瘤细胞的浸润和转移[6]。因此,探讨相关因子在低氧、高糖微环境下与乳腺癌的相关性对指导乳腺癌个性化治疗具有重要意义。
HIF-1通过上调靶基因参与能量代谢、血管生成、细胞存活、侵袭、转移和耐药,HIF-1α已被确定为癌治疗的重要分子靶点,可通过诱导肿瘤细胞低氧激活VEGF的表达促进血管生成[7]。在胰腺癌中HIF-1α呈高表达并抑制其表达后可延缓胰腺癌的发展[8]。HIF-1α在胃癌病灶中的表达明显高于癌旁组织,且在胃癌复发转移中发挥作用[9]。
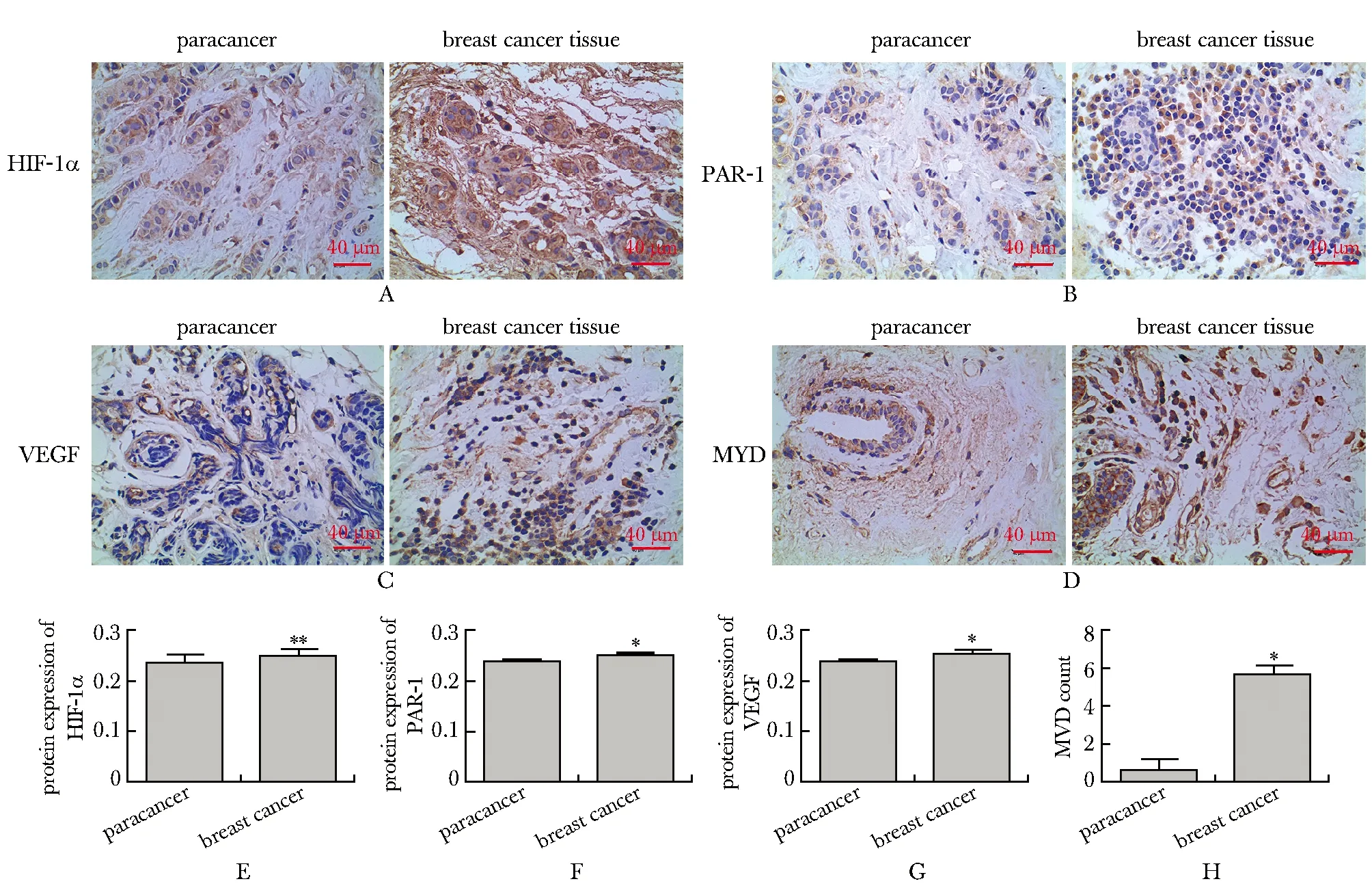
A.expression of HIF-1α in breast cancer and paracancer tissues; B.expression of PAR-1 in breast cancer and paracancer tissues; C.expression of VEGF in breast cancer and paracancer tissues; D.MVD count in breast cancer tissues and paracancerous; E.protein expression of HIF-1α in breast cancer and paracancer tissues; F.protein expression of PAR-1 in breast cancer and paracancer tissues; G.protein expression of VEGF in breast cancer and paracancer tissues; H.MVD count in breast cancer tissues and paracancerous; *P<0.05, **P<0.01 compared with paracancerous

图2 低氧、高糖对MCF-7细胞形态和侵袭的影响Fig 2 Effect of hypoxia and high glucose on morphology and invasion of MCF-7 cells

A.cell invasion; B.number of migrated cells; C.cell proliferation; *P<0.05, **P<0.01 compared with control group
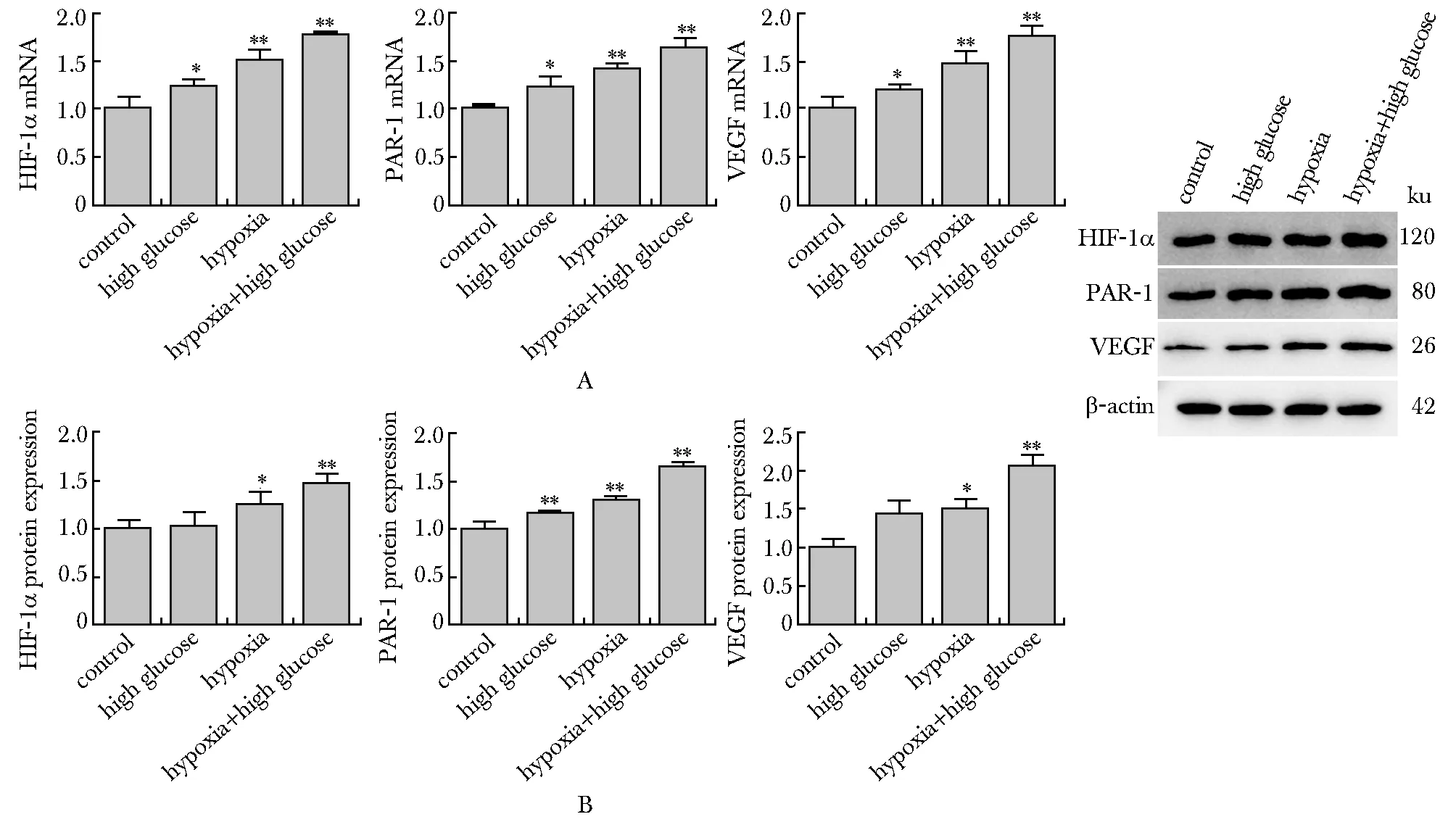
A.expression of HIF-1α, PAR-1 and VEGF mRNA in MCF-7 cells; B.protein expression of HIF-1α, PAR-1 and VEGF in MCF-7 cells; *P<0.05, **P<0.01 compared with control group
此外,HIF-1α在乳腺癌组织中广泛表达,且与乳腺癌病理分期、淋巴结转移相关[10]。本研究显示,乳腺癌组织中HIF-1α呈高表达,提示其参与乳腺癌的发展。PARs可介导凝血酶的许多细胞效应,在多种细胞中促进增殖、存活,PAR-1是主要的受体,已证明PAR-1与细胞存活有关[11]。低氧微环境下PAR-1可能是黑色素瘤细胞的生存因子,通过siRNA-PAR-1转染黑色素瘤裸鼠发现肿瘤缩小、肺转移灶减少[12]。本研究显示,乳腺癌组织中PAR-1高表达,提示其与肿瘤进展相关。VEGF是血小板衍生生长因子家族的一员,参与肿瘤血管生成的发生和发展,VEGF水平升高是肿瘤细胞侵袭性的征兆,并且与相对较差的预后相关[13]。本研究显示,乳腺癌组织中VEGF呈高表达,提示其参与乳腺癌的进展。研究显示HIF-1α与VEGF在肿瘤中的表达呈正相关,阻断癌细胞HIF-1α表达可降低VEGF表达并抑制移植肿瘤的生长[14]。抑制HIF-1α可导致乳腺癌MDA-MB-231细胞PAR-1表达显著降低[15]。提示HIF-1α、PAR-1、VEGF能够通过相互调控参与肿瘤进展。尽管低氧代表微环境压力,但肿瘤细胞在低氧微环境中存活和增殖。本结果显示,HIF-1α、PAR-1、VEGF在低氧、高糖MCF-7细胞中过表达,由于细胞迁移的调节是肿瘤侵袭性的关键步骤,结果表明在低氧、高糖微环境下细胞增殖、侵袭明显增强。因此,低氧、高糖条件下HIF-1α、PAR-1、VEGF的激活可以保护乳腺癌细胞免于死亡。
综上所述,合并2型糖尿病乳腺癌组织中HIF-1α、PAR-1、VEGF存在过度表达现象,参与其发病过程,MCF-7细胞学实验证明低氧、高糖环境能够使HIF-1α、PAR-1、VEGF激活并促进MCF-7细胞的增殖和侵袭。
