Met-tRNAiMet载体蛋白在急性髓系白血病(AML)中的表达及功能
2021-04-16苏鹏忠何家驩王小爽
苏鹏忠,何家驩,于 姗,王小爽,余 佳
(中国医学科学院基础医学研究所 北京协和医学院基础学院 生物化学与分子生物学系医学分子生物学国家重点实验室,北京 100005)
mRNA的翻译起始于核糖体小亚基(真核生物中的30S核糖体或原核生物中的40S核糖体)正确识别mRNA上的起始密码子,核糖体小亚基P位点上起始tRNA(Met-tRNAiMet)的出现对于起始密码子的识别至关重要。一类被称为起始tRNA载体的翻译起始因子促进Met-tRNAiMet向核糖体P位点的转移[1]。真核生物中,eIF2是最主要的起始tRNA载体蛋白。现已发现,在多种应激状态下,4种蛋白激酶可磷酸化eIF2的α亚基,通过隔离eIF2B而抑制eIF2正常结合起始tRNA并启动翻译的功能,从而导致大多数真核生物mRNA的翻译受阻[2]。
研究发现,一些mRNA的翻译不受到应激条件下eIF2α磷酸化造成的翻译抑制调控。具体而言,eIF2A、eIF2D和MCTS1等蛋白能够在丙型肝炎病毒(HCV) mRNA的内部核糖体位点(IRES)介导的翻译中运输tRNA。此外,eIF2α不依赖的翻译起始能够通过促进肿瘤相关mRNA的翻译,帮助肿瘤细胞获得选择性生长优势并逃避凋亡。例如,eIF2A在鳞状细胞癌的发生过程中发挥重要的癌基因功能,eIF2A选择性地调控癌基因的翻译,从而促进了鳞状细胞癌的发生[2]。MCTS1也是调控细胞周期和凋亡的重要原癌基因,其在83.9%的肺癌中表达上调,并在乳腺癌和淋巴瘤模型中促进恶性生长、血管形成、组织侵袭和抑制凋亡[3-4]。eIF2D在肿瘤发生中的功能还未见报道。除了上述在实体肿瘤中的研究报道,目前这些Met-tRNAiMet载体蛋白在成体造血分化和急性髓系白血病(acute myeloid leukemia, AML)细胞中的功能尚不明确。
本研究旨在分析3个Met-tRNAiMet载体蛋白eIF2A、eIF2D和MCTS1在成体造血分化不同阶段和AML细胞中的表达情况,并在AML细胞系MOLM13中初步研究这些蛋白对于AML发生发展的调控功能。
1 材料与方法
1.1 材料
高效RIPA裂解液(组织/细胞)(碧云天生物技术公司);PG113 PAGE凝胶快速制备试剂盒、PS119 通用型抗体稀释液、SQ101L Omni-ECLTM增强型化学发光检测试剂盒(上海雅酶生物技术有限公司);BCA蛋白浓度测定试剂盒(北京索莱宝生物技术有限公司);PVDF膜(Millipore公司);293T和MOLM13细胞系(中国医学科学院基础医学研究所细胞资源中心);兔源eIF2A、eIF2D、β-actin抗体(Proteintech公司);山羊抗兔IgG(北京中杉金桥生物技术有限公司);Neofect转染试剂(北京码音科技有限公司);RPMI 1640 (#61870036)、DMEM(#11965092)和胎牛血清(Thermo Fisher公司);细胞增殖检测试剂盒和细胞周期检测试剂盒(东仁化学科技有限公司)。
1.2 方法
1.2.1 shRNA干扰片段设计和载体构建:通过https://rnaidesigner.thermofisher.com/rnaiexpress/网站设计针对eIF2A和eIF2D的干扰序列,eIF2A shRNA:5′-GCTACTGCTGTGTTGGTAATA-3′,eIF2D shRNA:5′-CGTCATTAACTACGCCAAGAA-3′。根据序列合成shRNA引物,将退火得到的片段构建进入plko.1载体,测序验证shRNA序列的准确性。
1.2.2 AML细胞系培养:细胞系293T培养于DMEM,AML细胞系MOLM13培养于RPMI 1640,均加入10%胎牛血清。培养条件为5% CO2、37 ℃和饱和湿度。
1.2.3 慢病毒介导的质粒表达:在293T细胞中使用Neofect转染试剂转染shRNA载体,观察细胞状态,48~72 h后收集培养液上清。过滤上清后20 000 r/min离心3 h,收集病毒颗粒。离心得到的病毒颗粒用RPMI 1640基础培养基重悬。为了在MOLM13细胞中感染shRNA载体,以浓度1×106/mL接种MOLM13细胞,每2×106/mL细胞加入100 μL慢病毒重悬液,同时加入polybrene以增加感染效率。感染14~16 h后收集细胞悬液,800 r/min离心5min,去上清后更换含有10%血清的RPMI 1640完全培养基。
1.2.4 免疫印迹法(Western blot)检测蛋白表达:在处理后的相应时间点收集细胞,使用细胞裂解液提取总蛋白并测定蛋白浓度(BCA法)。每孔上样20~30 μg总蛋白,SDS-PAGE电泳分离蛋白样品。利用电转仪将蛋白转印到PVDF膜上,5%脱脂牛奶室温封闭1 h。分别加入eIF2A、eIF2D一抗(1∶1 000稀释),β-actin一抗(1∶10 000稀释)4 ℃孵育12~16 h后,加入山羊抗兔IgG室温孵育1 h。使用化学发光检测试剂盒显影,分析蛋白表达。
1.2.5 细胞增殖和周期检测:采用CCK8试剂盒以及酶标仪检测细胞增殖,具体方法参考试剂盒说明。以5 000个细胞/100 μL完全培养基的浓度,将慢病毒感染的MOLM13细胞接种至96孔板中。将96孔板在培养箱中常规培养24、48、72和96 h后,向每个孔中加入10 μL CCK8试剂,孵育2 h。利用酶标仪测定450 nm处的吸光度值,观察统计细胞的增殖水平。
采用细胞周期检测试剂盒以及流式细胞仪检测细胞周期情况,具体方法参考试剂盒说明。收集慢病毒感染的MOLM13细胞,调整浓度为1×106/mL,并用PBS洗涤2次,之后用100 μL PBS重悬,并加入5 μL PI试剂,混匀后4 ℃染色30 min,补充PBS至总体积500 μL。使用流式细胞仪进行PI信号的检测。得到的流式结果使用modfit软件进行周期分析,记录G1、S和G2/M期细胞所占的比例。
1.3 统计学分析
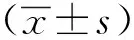
2 结果
2.1 Met-tRNAiMet载体蛋白在小鼠造血干细胞分化不同阶段的表达
首先检测了Met-tRNAiMet蛋白在小鼠造血分化不同阶段的表达变化(GSE142216)[5]。其中髓系分化包含12种类型的细胞,淋系分化包含8种类型的细胞。在髓系和淋系不同分化阶段分别对3个替代蛋白的表达水平进行统计,并按照分化的过程进行排序,发现在髓系和淋系分化过程中eIF2A和eIF2D的表达水平在干细胞和祖细胞阶段较高,而在成熟血液细胞中均呈降低趋势(P<0.01)(图1A~B, D~E),而MCTS1在干祖细胞和成熟细胞中的表达没有明显的变化趋势(P<0.05)(图1C, F)。综上,eIF2A和eIF2D在小鼠造血干祖细胞(HSPCs)中表达水平较高。
2.2 Met-tRNAiMet载体蛋白在健康人造血干细胞分化不同阶段的表达
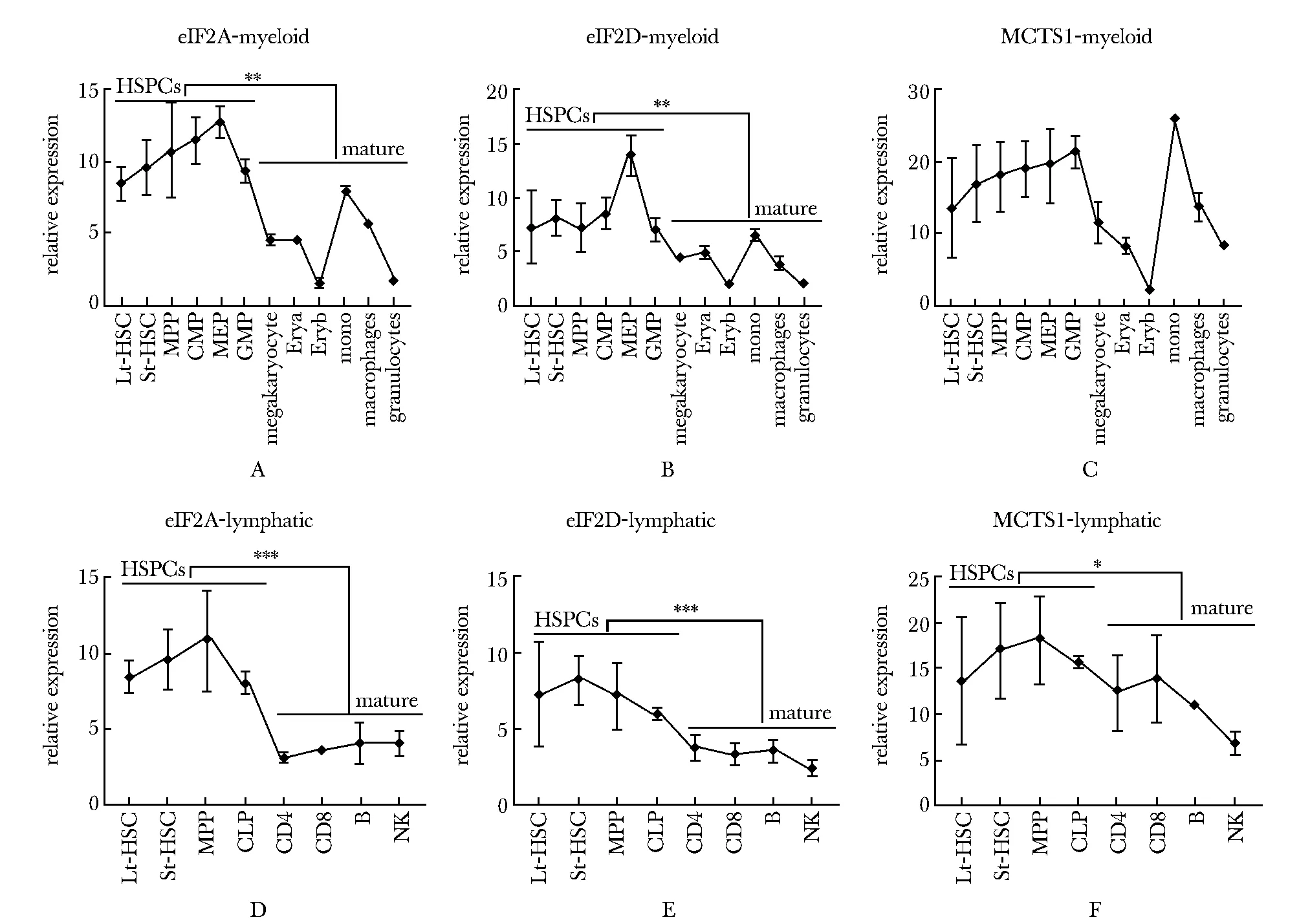
进一步利用健康人造血细胞的单细胞测序数据(GSE139369)[6],分析不同阶段造血细胞中Met-tRNAiMet载体蛋白的表达变化。用LSI(latent semantic indexing)[7]及UMAP(uniform manifold approximation and projection)[8]方法进行分析,发现eIF2A和eIF2D在HSPCs(包括HSC、CMP和LMPP)和红系祖细胞(Early.Eryth)中表达水平较高(P<0.001)(图2A~C,E~F),而MCTS1在多种细胞群体中无明显表达差异(图2D, G)。
2.3 eIF2A和eIF2D在健康人和AML患者中具有表达差异
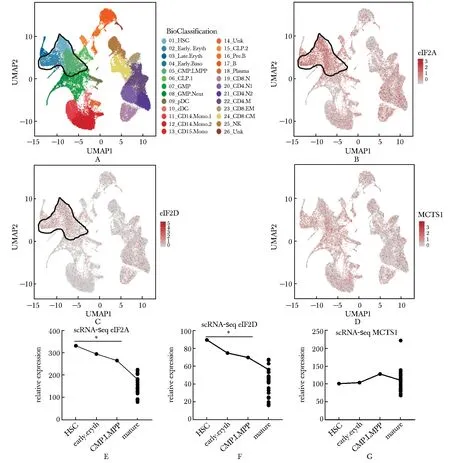
进一步探索上述Met-tRNAiMet载体蛋白在AML中的表达变化情况。利用参考文献[9-10]中的数据集GSE13159分析健康人和AML患者单个核细胞中3个替代蛋白的表达水平,发现eIF2A和eIF2D在AML患者中表达显著上调(P<0.001)(图3A,B),但MCTS1在健康人和AML患者中的表达无显著差异(图3C)。
eIF2A(A, D), eIF2D(B, E) and MCTS1(C, F) expression analyzed in RNA-seq data of mouse blood cells; Lt-HSC.long-term hematopoietic stem cell; St-HSC.short-term hematopoietic cell; MPP.multiple potential progenitor; CMP.common myeloid progenitor; MEP.megakaryocyte erythrocyte progenitor; GMP.granulocyte-macrophage progenitor; Erya and Eryb.erythrocyte A and erythrocyte B; mono.monocyte; CLP.common lymphoid progenitor; CD4.CD4+T cell; CD8.CD8+T cell; B.B cells; NK.natural killer;*P<0.05, **P<0.01, ***P<0.001 compared with HSPCs group
2.4 eIF2A和eIF2D对AML细胞系增殖的影响
利用AML细胞系MOLM13进行eIF2A和eIF2D的功能研究。在MOLM13细胞系中,构建的两条位点特异的shRNA均能显著地在蛋白水平抑制eIF2A或eIF2D的表达(图4A左,B左),可用于后续功能实验。抑制eIF2A或eIF2D的表达均导致MOLM13细胞增殖受阻(P<0.001)(图4A右, B右)。
2.5 eIF2A和eIF2D对AML细胞系细胞周期的影响
抑制eIF2A或eIF2D的表达导致MOLM13细胞周期中处于G1期的细胞减少(P<0.01),G2/M期的细胞增多(P<0.01)(图4C,D),即细胞在G2/M期发生阻滞。
2.6 AML细胞应激状态下eIF2A和eIF2D表达上调
分别用salubrinal(10 μmol/L)处理和血清饥饿的方式处理细胞系MOLM13使细胞进入应激状态。两个应激组eIF2A和eIF2D的蛋白表达均上调(图5)。
A.scRNA-seq LSI UMAP projection of 35882 single cells across healthy hematopoiesis;eIF2A(B,E), eIF2D(C,F) and MCTS1(D,G) expression analyzed in the biological classifications for the scRNA-seqclusters; *P<0.001 compared with mature group
3 讨论
血细胞的生成依赖于HSCs独一无二的自我更新能力和多谱系分化潜能,HSCs可分化生成所有血细胞[11]。AML是HSPCs发生的一种侵袭性克隆障碍,其具体表现为髓系干祖细胞分化受阻,并自我更新产生LSCs[12]。由于LSCs具有耐药性,所以AML患者复发率高,5年存活率低。目前已报道的AML关键作用分子有很多,比如NPM1c[13]、RBM39[14]等,但尚未证实具有临床治疗效果,AML的研究成果仍然处于基础研究水平,急需适用性更强的作用机制,找到AML治疗的关键靶向分子。
eIF2A(A), eIF2D(B) and MCTS1(C) expression analyzed in GSE13159; *P<0.001 compared with normal group

cell proliferation(A, B right) and cell cycle(C)in MOLM13 cell line was analyzed after eIF2A(A left) or eIF2D(B left)knocked down; D.significant difference analysis of cell cycle; *P<0.01, **P<0.001 compared with plko.1 group
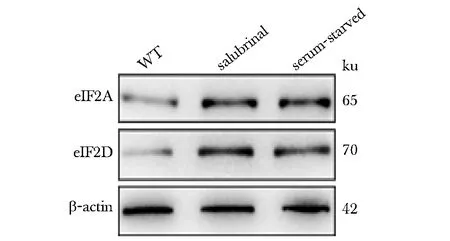
图5 应激状态下MOLM13细胞中eIF2A和 eIF2D的表达变化Fig 5 The changes of eIF2A and eIF2D expression in MOLM13 in stress
本研究证明,eIF2A和eIF2D在AML患者和正常HSPCs中高表达,提示eIF2A和eIF2D可能作为原癌基因在AML中发挥促癌作用。eIF2A和eIF2D的功能研究发现,eIF2A和eIF2D能够促进MOLM13的增殖,并且能够维持MOLM13细胞周期的正常进行。值得注意的是,本研究证实eIF2A和eIF2D能够使MOLM13细胞正常经过细胞周期中的G2/M期,靶向抑制eIF2A或eIF2D表达后可使MOLM13阻滞在G2/M期。靶向G2/M期检查点使肿瘤细胞长期阻滞在G2/M期可以作为肿瘤治疗策略[15]。细胞应激状态下eIF2A和eIF2D表达水平上调,提示eIF2A和eIF2D可能在eIF2不足的情况下通过转运Met-tRNAiMet促进特定mRNA分子的翻译。
综上,eIF2A和eIF2D可能通过促使正常细胞周期的进行而增加MOLM13细胞的增殖能力,从而发挥原癌基因的功能;eIF2A和eIF2D有作为AML治疗靶向分子的可能。
