基于SIRT1/PGC-1α通路探讨电针联合丰富康复训练对脑缺血大鼠氧化应激的影响
2021-04-16姚晓雯李梦醒高云云金子开
姚晓雯,唐 巍,李梦醒,兰 崴,王 玉,高云云,金子开
(安徽中医药大学针灸推拿学院,安徽 合肥 230012)
缺血性脑卒中(cerebral ischemic stroke,CIS)的生理病理过程属于多因素参与、多环节循环、多途径损伤的酶促级联反应。因其高发病率、高死亡率、高致残率,CIS严重威胁人类健康。既往研究显示,电针与现代康复医学联合的治疗模式通过抗炎、增强神经可塑性、促血管新生、抑制细胞凋亡等多种途径改善脑部供血,促进神经损伤修复。沉默信息调节因子1(silent information regulator 1,SIRT1)/过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)是一条内源性的抗氧化损伤通路,SIRT1通过烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)依赖的去乙酰化调控PGC-1α活性,参与氧化应激、能量代谢、细胞凋亡等多种生物学途径。本实验通过观察电针联合丰富康复训练对大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型大鼠SIRT1/PGC-1α通路及相关凋亡基因[B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、半胱氨酸蛋白酶-3(cysteinyl aspartate specific proteinase-3,Caspase-3)、半胱氨酸蛋白酶-9(cysteinyl aspartate specific proteinase-9,Caspase-9)]的影响,从氧化应激角度阐明电针联合丰富康复训练的神经保护机制。
1 材料
1.1 实验动物 选取清洁级成年健康雄性SD大鼠75只,体质量为(300±20)g,于(23±3)℃、45%~55%湿度环境下自由饮食饲养,术前禁食不禁水。本实验经安徽中医药大学实验动物伦理委员会批准,实验动物生产许可证号为SCXK(鲁)2019-0003。
1.2 试剂与仪器 荧光显微镜(BA410E):Motic公司;石蜡切片机(TM2135):Leica公司;激光多普勒仪(FP 50 Shift):北廷测量技术公司;荧光定量PCR仪(PIKOREAL 96):Thermo Scientific;丙二醛(malonic dialdehyde,MDA)(A003-1)、超氧化物歧化酶(superoxide dismutase,SOD)(A001-1):南京建成生物工程研究院;TUNEL细胞凋亡检测试剂盒(C1088):Beyotime公司;SIRT1(bs-0921R):Bioss;PGC-1α(SC-517380):Santa Cruz;Bcl-2(RS-0032R)、Caspase-3(ab32351)和Caspase-9抗体(ab32539):上海瑞齐生物科技公司。
1.3 康复训练器材 FT-200动物跑步机:成都泰盟软件公司;Roto-Rod Series 8转棒测试仪:上海达燊实业有限公司;网屏(50 cm×40 cm)、平衡木(170 cm×2 cm)、自制丰富环境笼(笼中放置彩球、塑料管隧道、积木等)。
2 方法
2.1 动物模型复制方法及分组 随机选取15只大鼠为假手术组,仅分离颈动脉,不进行结扎和插线步骤。其余大鼠参照Longa线栓法复制MCAO模型。按40 mg/kg剂量腹腔注射1%戊巴比妥钠麻醉大鼠,麻醉后将大鼠仰卧位固定于鼠板,在右侧颈部做一切口,钝性分离皮下组织,充分暴露右侧颈总动脉并用缝合线标记,继续分离颈外及颈内动脉,缝合线结扎颈外动脉远心端并电凝,用动脉夹暂时夹闭颈总及颈内动脉,在颈外动脉残端作一“V”型切口,将尼龙线插入,待线栓前端抵达分叉处时放开颈内动脉处动脉夹,继续向颈内动脉深入,深度为18~20 mm,以微遇阻力为度。麻醉清醒后4 h,参考改良神经功能缺损评分(modified neurological severity scores,mNSS)量表评估大鼠神经功能状态,2~18分为模型复制成功。将模型复制成功的大鼠按随机数字表法分为模型组、电针组、康复组和联合组,每组15只。
2.2 治疗方法 电针组和联合组电针选穴参照《实验针灸学》及《大鼠穴位图谱的研制》,选取“百会”“大椎”进行针刺。模型复制后4 h开始治疗,用固定器限制大鼠行动,暴露针刺穴位,以疏密波,频率5~30 Hz,电流1~2 mA进行电针治疗。康复组和联合组进行丰富环境与康复训练。丰富环境治疗:将大鼠置于自制丰富环境笼中,给予声音、颜色和灯光刺激。康复训练治疗:将大鼠置于不同器材上,分别进行跑台、转棒、网屏、平衡木训练,以上治疗均每次30 min,每日1次,共治疗3 d。
2.3 激光多普勒测定缺血侧皮质区脑血流量 在插线后5 min及最末次治疗结束后进行大鼠缺血区局部脑血流量测定。麻醉大鼠后将其头部固定于脑立体定位仪上,沿正中线偏左侧剃毛,暴露颅骨,根据《大鼠脑立体定位图谱》用牙科钻沿冠状缝与矢状缝定位并钻开一颅窗(约4 mm×3 mm),将多普勒光纤探头固定至颅窗处,测量并记录。
2.4 生化检测缺血侧皮质区SOD、MDA水平 取大鼠脑组织皮质区制备组织匀浆,根据SOD、MDA试剂盒说明书依次进行操作,用酶标仪测定各管吸光度值,根据公式计算SOD活力值与MDA的含量。
2.5 苏木精-伊红(hematoxylin-eosin,HE)染色和TUNEL法观察大鼠缺血侧皮质区形态学变化与阳性细胞率 将大鼠处死,取出全脑,用4%多聚甲醛固定,进行石蜡包埋,制成石蜡切片。一部分用HE染液进行染色,另一部分滴加蛋白酶K(不含DNase),37 ℃作用20 min以消化蛋白质,PBS洗涤3次,将蛋白酶K冲洗干净。配制并加入50 μL TUNEL反应液,避光孵育60 min,PBS反复冲洗,DAPI染细胞核,封片,荧光显微镜下观察大鼠缺血侧皮质区,随机选取400倍视野进行阳性细胞计数,并计算阳性细胞率(阳性神经细胞数/神经细胞总数)。
2.6 RT-PCR法检测大鼠缺血侧皮质区SIRT1、PGC-1α、Bcl-2、Caspase-3、Caspase-9 mRNA表达水平 Trizol试剂提取各组大鼠皮质区总RNA,使用微量核酸蛋白分析仪测定260、280 nm的OD值。而后参照逆转录试剂盒,进行PCR扩增。PCR反应条件:95 ℃ 1 min,95 ℃ 20 s,60 ℃ 1 min,40个循环。引物序列如表1所示,采用2-ΔΔC法计算SIRT1、PGC-1α、Bcl-2、Caspase-3、Caspase-9 mRNA的相对表达水平。

表1 各检测指标的引物序列
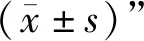
3 结果
3.1 各组大鼠缺血侧皮质区脑血流量比较 与假手术组相比,模型组插线后5 min、3 d的脑血流量均明显下降(P
<0.05)。与模型组相比,各治疗组插线后5 min脑血流量差异无统计学意义(P
>0.05),治疗3 d后联合组脑血流量显著增高(P
<0.05);与电针组、康复组相比,联合组脑血流量显著升高(P
<0.05)。见表2。3.2 各组大鼠缺血侧皮质区MDA、SOD水平比较 与假手术组相比,模型组MDA水平上升,SOD水平下降(P
<0.05);与模型组相比,各治疗组MDA水平均下降,SOD水平均升高(P
<0.05);与电针组和康复组相比,联合组MDA水平降低,SOD水平升高(P
<0.05)。见表3。两因素方差分析显示,治疗手段对氧化应激因子表达水平的主效应具有统计学意义(P
<0.05);电针联合丰富康复训练对MDA、SOD表达水平存在交互效应(P
<0.05)。见表4。
表2 各组大鼠缺血侧皮质区脑血流量比较

表3 各组大鼠缺血侧皮质区MDA、SOD水平比较
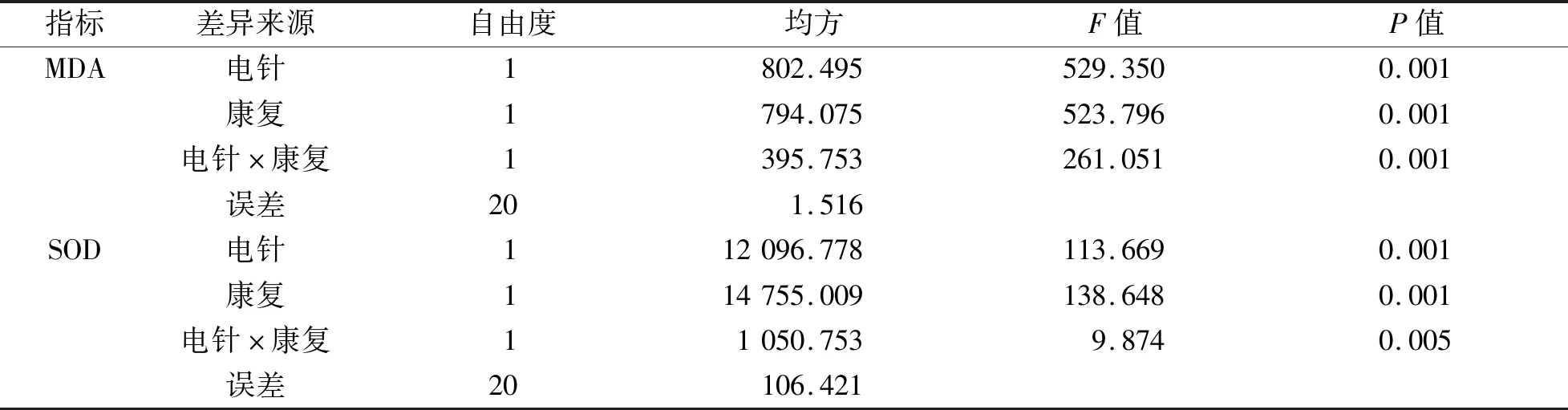
表4 电针与康复训练对脑缺血大鼠氧化应激因子表达水平影响的两因素析因设计方差分析结果
3.3 各组大鼠缺血侧皮质区形态学变化及阳性细胞率比较 HE染色结果显示,假手术组皮质区神经细胞排列整齐,结构完整,核仁清晰;模型组神经细胞排列紊乱,细胞结构出现不同程度破坏,如核固缩、嗜染质。与模型组相比,各治疗组均出现好转趋势,虽有不同程度的间质水肿、排列紊乱,但可以看到皮质区嗜染质相对较少,细胞结构破坏程度相对减轻,联合组尤为明显。见图1。TUNEL染色结果显示,假手术组仅有少量阳性细胞。与假手术组相比,模型组大鼠缺血侧皮质区阳性细胞数大量增加,阳性细胞率大幅升高(P
<0.05);与模型组相比,各治疗组阳性细胞数减少,阳性细胞率均呈下降趋势(P
<0.05);与电针组、康复组相比,联合组阳性细胞数量相对变少,阳性细胞率降低(P
<0.05)。见图2和表5。3.4 各组大鼠缺血侧皮质区SIRT1、PGC-1α、BCL-2、Caspase-3、Caspase-9 mRNA表达水平比较 与假手术组相比,模型组SIRT1、PGC-1α、Bcl-2 mRNA表达水平均显著减少(P
<0.05),Caspase-3、Caspase-9 mRNA表达水平显著增加(P
<0.05)。与模型组相比,各治疗组SIRT1、PGC-1α、Bcl-2 mRNA表达水平均显著增加(P
<0.05),Caspase-3、Caspase-9 mRNA表达水平显著减少(P
<0.05)。见表6。两因素方差分析结果显示,分组因素对SIRT1、PGC-1α mRNA表达水平的主效应有统计学意义(P
<0.05);电针与丰富康复训练联合干预对SIRT1、PGC-1α mRNA的表达水平存在交互作用(P
<0.05),对凋亡相关基因表达水平的影响无交互作用(P
>0.05)。见表7、表8。
图1 各组大鼠缺血侧皮质区形态学变化(HE染色,10×40倍)
4 讨论
CIS属中医“中风”范畴,基本病机为气血逆乱,上犯于脑,脑之神明失用,证候多为本虚标实。研究显示,电针通过穴位感受器、神经递质将腧穴局部效应传入中枢,在脑损伤疾病中有显著疗效。丰富康复训练具有独特优势,可刺激脑部特定运动区域,改善脑组织微循环,实现神经细胞再生与功能重组。在脑缺血中,氧化应激是破坏神经细胞活力和组织损伤的主要条件,自由基的大量释放会影响DNA、脂质和蛋白质等重要生物分子,造成细胞损伤。
SIRT1是依赖于NAD的去乙酰化酶,在应激反应中起关键作用,PGC-1α作为其下游靶点,正常情况下可与SIRT1形成转录复合体控制代谢基因表达。脑缺血时,神经细胞处于氧化应激状态,治疗手段干预激活SIRT1/PGC-1α通路,提升抗氧化酶和抗氧化剂能力,减少氧化应激和神经细胞凋亡。

图2 各组大鼠缺血侧皮质区细胞凋亡情况(TUNEL荧光染色,10×40倍,白色箭头表示凋亡细胞)

表5 各组大鼠缺血侧皮质区阳性细胞率比较
两因素方差分析显示,治疗手段对MDA、SOD、SIRT1、PGC-1α、Caspase-3、Caspase-9、Bcl-2 mRNA表达水平的主效应均有统计学意义,说明本实验治疗手段是影响结果的主要因素。研究发现,氧化应激因子、SIRT1、PGC-1α和凋亡细胞因子的表达具有一定规律性。脑缺血后,MDA含量增加,SOD活性下降,提示脑内自由基过表达,抗氧化物被消耗,脑内氧化失衡。此时,缺血侧皮质区SIRT1 mRNA表达减少,下游PGC-1α mRNA表达水平也随之下降,缺血侧凋亡细胞大幅增多,Caspase-3、Caspase-9表达增多,Bcl-2表达减少,提示缺血性脑损伤后氧化应激持续发生,细胞凋亡途径启动。3种治疗手段均能使SIRT1、PGC-1α mRNA表达水平上调,Caspase-3、Caspase-9 mRNA表达水平下调,Bcl-2 mRNA表达水平上调,提示不同治疗手段通过上调SIRT1/PGC-1α通路,发挥抗缺血性脑损伤作用。联合组通过电针与康复的交互效应,显著上调SIRT1、PGC-1α mRNA的表达,提示外周康复刺激与直接电针刺激共同生成的效应产物能减轻缺血后脑组织氧化应激损伤,发挥神经保护作用。但联合组对凋亡因子表达水平的交互作用无统计学意义(P
>0.05),提示脑缺血急性期,电针联合丰富康复训练对细胞凋亡有抑制作用,但交互作用并不明显。
表6 各组大鼠缺血侧皮质区SIRT1、PGC-1α、Bcl-2、Caspase-3、Caspase-9 mRNA表达水平比较
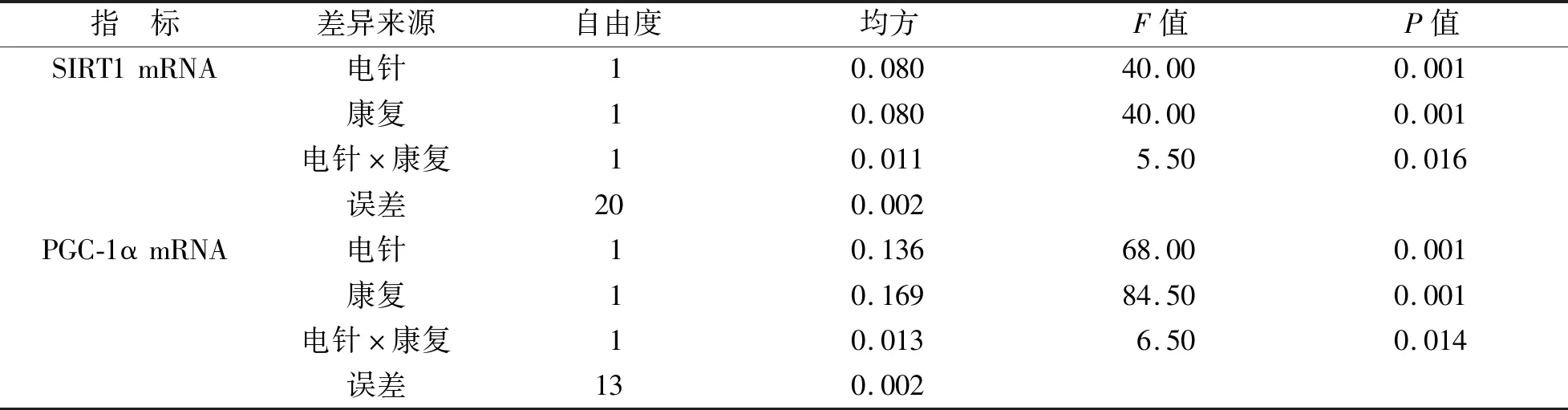
表7 电针与康复训练对脑缺血大鼠SIRT1、PGC-1α mRNA表达水平影响的两因素析因设计方差分析结果

表8 电针与康复训练对脑缺血大鼠凋亡相关基因表达水平影响的两因素析因设计方差分析结果
目前,SIRT1/PGC-1α通路在CIS的基础性研究成果甚少,电针与康复疗法联合调控缺血后氧化应激机制研究尚不多见。本实验通过电针联合丰富康复训练对MCAO大鼠进行干预,发现电针法、康复法、联合法均在不同程度上激活了SIRT1/PGC-1α通路,调节氧化应激,抑制细胞凋亡;且电针与康复联合治疗对SIRT1、PGC-1α mRNA表达水平的影响具有交互效应(P
<0.05),发挥正向协同作用。本研究中选择3 d作为治疗终点,旨在观察SIRT1/PGC-1α通路在急性期的抗氧化和神经保护作用,但本实验仅评估SIRT1/PGC-1α通路的即时效应,在后续研究中,应延长治疗观察期,对电针联合丰富康复训练与氧化应激相关性进行深入研究。