血管软化丸调控miRNA-155防治动脉粥样硬化的机制
2021-04-16秦合伟姬令山李文涛
聂 勇,秦合伟,吕 哲,姬令山,李文涛
(1.驻马店市中医院,河南 驻马店 463000;2.河南中医药大学第二附属医院,河南 郑州 450002)
动脉粥样硬化(athcrosclerosis,AS)是缺血性心脑血管疾病的基本病理基础,脂质代谢紊乱、血液流变性异常和炎症反应是促使AS形成的重要危险因素。研究发现,miRNAs在调节AS发生发展中具有重要作用,miRNA-155(miR-155)是非编码的微小RNA之一,其可表达于活化的免疫细胞,并与免疫功能相关,而单核巨噬细胞、内皮细胞及血管平滑肌细胞也参与了AS形成过程。此外,miR-155调控炎症反应防治AS与调控细胞因子信号转导抑制剂1(suppressor of cytokine signaling 1,SOCS1)/磷酸化转录激活子3(phosphorylated signal transducer and activator of transcription 3,p-STAT3)炎症信号通路,进而影响程序性细胞凋亡因子4(programmed cell death 4,PDCD4)表达,以及影响肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)、白细胞介素-6(nterleukin-6,IL-6)、干扰素-γ(interferon gamma,IFN-γ)3种炎症因子水平有关。本实验通过观察血管软化丸对miR-155和SOCS1/p-STAT3/PDCD4炎症信号通路的调控,以及对TNF-α、IL-6、IFN-γ等炎症因子的影响,探究其抗AS的作用机制。
1 材料和方法
1.1 体内实验
1.1.1 实验动物 ApoE小鼠60只,SPF级,8周龄,体质量(18±2)g,购自南京大学模式动物研究所[动物生产许可证号:SCXK(苏)2015-0001]。RAW264.7小鼠巨噬细胞株购自ATCC。将所有动物饲养于河南中医药大学第二附属医院动物实验中心,(22±1)℃恒温,60%~75%恒湿,12 h循环照明,自由摄食、饮水。本实验已通过河南中医药大学第二附属医院实验动物伦理委员会审查,伦理审查批准文号为20170228。
1.1.2 药物与试剂 血管软化丸组方:黄芪30 g,山楂20 g,莱菔子15 g,丹参、三七、陈皮各12 g,清半夏10 g,甘草6 g。所有中药饮片均来自河南中医药大学第二附属医院药剂科,由医院煎药房按照要求,煎煮和浓缩成3.456、0.864 g/mL的汤剂。荧光定量PCR试剂盒(00382278):TaKaRa公司;RNA逆转录试剂盒(Cat 638313):Fermentas公司;蛋白提取试剂盒(P0011):碧云天公司;抗体miR-155(Ab139805)、SOCS1(bs-4615R)、p-STAT3(10931)、PDCD4(F0413)和GAPDH(112438):Cell Signaling公司;二抗(羊抗小鼠IG-HRP,ab97023):武汉博士德生物工程有限公司;鼠TNF-α ELISA试剂盒(1403045)、鼠IL-6 ELISA试剂盒(1403079)、鼠IFN-γ ELISA试剂盒(1403026):武汉博士德生物工程有限公司;Anti-miR-155:由广州锐博生物科技有限公司设计和合成。
1.1.3 模型复制与动物分组 所有小鼠适应性饲养1周,各组均予以自由饮水,ApoE小鼠给予全程高脂饲料(含脂肪21%、胆固醇0.15%)喂养,高脂饲料饲养8周,以复制AS模型。模型复制成功(小鼠主动脉壁可见明显的斑块形成)后将60只ApoE小鼠随机分为5组,每组12只,均持续给药8周。①模型组:ApoE小鼠全程高脂饲养,不进行任何干预。②miR-155抑制剂组:尾静脉注射miR-155抑制剂,按30 mg/(kg·d)注射,每周1次,连续注射8周,期间给予高脂饲料。③miR-155模拟物组:尾静脉注射miR-155模拟物,按30 mg/(kg·d)注射,每周1次,连续注射8周,期间给予高脂饲料。④血管软化丸高剂量组:给予相当于70 kg成人12倍剂量[86.4 g/(kg·d)]的血管软化丸,连续干预8周,期间给予高脂饲料。⑤血管软化丸低剂量组:给予血管软化丸21.6 g/(kg·d),连续干预8周,期间给予高脂饲料。
1.1.4 样品采集和病理形态学观察 药物干预8周后,颈椎脱臼法处死小鼠,沿主动脉瓣至髂动脉分支处剥离全长主动脉,选取近主动脉瓣附近主动脉壁,一部分固定于4%甲醛溶液中,用于苏木精-伊红(hematoxylin-eosin,HE)染色;一部分置于-80 ℃冰箱冻存,用于分子生物学等检测。
1.1.5 qRT-PCR检测各组小鼠主动脉miR-155、SOCS1、p-STAT3、PDCD4 mRNA表达水平 将小鼠主动脉组织称取质量后,加入适量Trizol,按试剂盒说明书提取总RNA,逆转录成cDNA,以cDNA为模板,采用SYBR Green进行qRT-PCR反应。反应参数:95 ℃ 30 s,1个循环;95 ℃ 5 s,55 ℃ 10 s,40个循环,采用2-ΔΔC法计算目的基因的表达水平。以GAPDH为内参,基因引物序列见表1。

表1 基因引物序列
1.1.6 ELISA法检测小鼠血清中TNF-α、IL-6、IFN-γ水平 采集小鼠血浆,严格按照ELISA试剂盒说明书操作方法检测血清中TNF-α、IL-6、IFN-γ水平。
1.2 体外实验
1.2.1 含药血清制备和细胞分组 将20只雄性健康SD大鼠[体质量(300±20)g,购自南京大学模式动物研究所]随机分为中药组和对照组。中药组给予高剂量[86.4 g/(kg·d)]血管软化丸,对照组灌胃给予等量生理盐水,每日早晚各1次,连续5 d。末次给药后1 h,腹腔注射水合氯醛(350 mg/kg)麻醉,腹主动脉取血,分离血清,离心,过滤除菌,分装备用。采用ox-LDL刺激RAW264.7巨噬细胞建立模型,以每孔1×10/mL将细胞铺板于24孔板,分别加入5、10、20 μg/mL ox-LDL处理24 h。模型复制后按照干预方法分为4组。①对照组:对照组大鼠血清(RPMI 1640完全培养基);②miR-155抑制剂组:模型复制后,参照脂质体2 000说明书将miR-155抑制剂转染至RAW264.7细胞;③miR-155模拟物组:将miR-155模拟物转染至RAW264.7细胞;④血管软化丸含药血清组:模型复制后采用血管软化丸含药血清干预。
1.2.2 血清干预和细胞转染实验
(1)含药血清作用于RAW264.7细胞 将第3~5代RAW264.7细胞弃去培养基,用PBS温和洗3遍,在37 ℃、5% CO孵箱中培养16 h,待铺板率达50%,弃去培养基,分别加入血管软化丸不同浓度(6.25、12.5、25 μg/mL)含药血清的RPMI 1640培养基,最终选取血管软化丸25 μg/mL含药血清培养基干预,对照组给予空白血清完全培养基干预,每孔100 μL,培养24 h。
(2)细胞转染实验 按照文献[4]方法转染细胞。在无菌条件下,用含有10% FBS的细胞培养基DMEM,将RAW264.7细胞(1×10/mL)接种于6孔板,于37 ℃、5% CO细胞培养箱中孵育,备用。取miR-155抑制剂或miR-155模拟物(20 μmol/L) 6 μL和HiPerFect转染试剂12 μL,滴入300 μL细胞培养基DMEM,使其终浓度为5 nmol/L。室温下,放置5~10 min,形成转染复合物。将转染复合物分别均匀滴入上述接种细胞培养基中,待融合度约达到80%时,终止培养,刮取细胞,提取细胞RNA。
1.2.3 RT-PCR检测RAW264.7细胞中miR-155、SOCS1、p-STAT3、PDCD4 mRNA表达水平 收集RAW264.7细胞,分离提取总RNA,逆转录成cDNA,采用SYBR Green进行RT-PCR反应。反应参数:95 ℃ 5 s,55 ℃ 10 s,40个循环。采用2-ΔΔC法计算样本中目的基因表达水平。
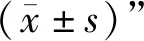
2 结果
2.1 一般情况 饲养和给药过程中,各组小鼠因撕咬致死1只,因灌胃致死1只,剔除离群值3只,最后进入统计的各组小鼠数量各为11只。
2.2 各组小鼠主动脉的组织形态学变化 模型组小鼠主动脉管径厚薄不均匀,内膜不光滑,管壁细胞分布不整齐,有较小的AS斑块。miR-155抑制剂组小鼠血管管径厚薄不均匀,斑块形成明显,内皮下大量泡沫细胞形成,可见胆固醇结晶;AS斑块可见染色较浅的无定形物、钙化颗粒物,AS斑块截面积显著大于其他各组。miR-155模拟物组和血管软化丸含药血清组小鼠主动脉各层结构清晰,血管细胞排列较整齐,病变程度明显轻于模型组。见图1。

图1 各组小鼠主动脉的组织形态学变化(HE染色,10×20倍)
2.3 各组小鼠主动脉miR-155、SOCS1、p-STAT3、PDCD4 mRNA表达水平比较 与模型组比较,miR-155抑制剂组小鼠主动脉miR-155和SOCS1 mRNA表达水平明显降低(P
<0.05),miR-155模拟物组和血管软化丸高、低剂量组主动脉miR-155和SOCS1 mRNA表达水平明显升高(P
<0.05)。与模型组比较,miR-155抑制剂组小鼠主动脉p-STAT3和PDCD4 mRNA表达水平明显升高(P<0.05),miR-155模拟物组和血管软化丸高、低剂量组p-STAT3和PDCD4 mRNA表达水平明显降低(P
<0.05)。血管软化丸高、低剂量组小鼠主动脉miR-155、SOCS1、p-STAT3、PDCD4 mRNA表达水平比较,差异无统计学意义(P
>0.05)。见表2。
表2 各组小鼠主动脉miR-155、SOCS1、p-STAT3、PDCD4 mRNA相对表达水平比较
2.4 各组小鼠血清中TNF-α、IL-6、IFN-γ水平比较 与模型组比较,miR-155抑制剂组小鼠血清TNF-α、IL-6、IFN-γ水平明显升高(P
<0.05),miR-155模拟物组和血管软化丸高、低剂量组小鼠血清TNF-α、IL-6、IFN-γ水平明显降低(P
<0.05);血管软化丸高、低剂量组小鼠血清TNF-α、IL-6、IFN-γ水平比较,差异无统计学意义(P
>0.05)。见表3。2.5 血管软化丸含药血清对RAW264.7细胞中miR-155、SOCS1、p-STAT3、PDCD4 mRNA表达水平的影响 与对照组比较,miR-155抑制剂组RAW264.7细胞中miR-155和SOCS1 mRNA表达水平明显降低(P
<0.05),p-STAT3和PDCD4 mRNA表达水平明显升高(P
<0.05),miR-155模拟物组和血管软化丸含药血清组RAW264.7细胞中miR-155和SOCS1 mRNA表达水平明显升高(P
<0.05),p-STAT3和PDCD4 mRNA表达水平明显降低(P
<0.05)。见表4。
表3 各组小鼠血清中TNF-α、IL-6、IFN-γ水平比较

表4 含药血清对RAW264.7细胞中miR-155、SOCS1、p-STAT3、PDCD4 mRNA表达水平的影响
3 讨论
研究发现,miR-155可表达于活化的免疫细胞,通过增加黏附因子和趋化因子表达促进炎症反应,并参与AS的发生发展过程。实验研究发现,miR-155表达缺乏能够降低巨噬细胞炎症浸润程度和抑制AS形成,而过表达miR-155则促进泡沫细胞的形成,促进炎症反应,加速AS形成。PDCD4是一种肿瘤抑制因子,PDCD4能够激活NF-κB,抑制IL-10表达,促进炎症反应,诱导内皮细胞增殖和凋亡。SOCS1是一种炎症负向调控因子之一,能够负向调控各种炎症反应,抑制TNF-α、IL-6、INF-γ等炎症因子的产生,而miR-155能够直接结合SOCS1,逆向调控巨噬细胞炎症反应。研究发现,miR-155通过调控SOCS1/p-STAT3炎症信号通路调控PDCD4,影响TNF-α、IL-6、INF-γ的生成和AS发生。
高脂血症可归属于中医学“血浊”范畴,血浊可致痰、瘀、毒等病理产物产生,壅塞脉道,沉积管壁,形成AS。本课题组结合中医基础理论及前期大量的临床试验,认为痰瘀证候是AS的主要证型,本研究所用血管软化丸由保和丸化裁而成。方中山楂消食导滞,为君药;黄芪补气健脾,半夏健脾燥湿化痰,三七和丹参活血化瘀,共为臣药;莱菔子下气消食除胀,陈皮理气和中,共为佐药;甘草健脾和中,调和诸药,为使药。诸药合用,共奏消积化痰、活血化瘀之功。本课题组既往研究发现,血管软化丸可通过调控miR-467b靶向LPL调控巨噬细胞,减少炎症因子分泌和巨噬细胞脂质蓄积,抑制AS发生发展。
本研究通过观察血管软化丸对miR-155和SOCS1/STAT3/PDCD4信号通路的调控,影响TNF-α、IL-6、IFN-γ的表达,从细胞、分子、组织水平多层次揭示血管软化丸防治AS的作用靶点。本研究发现,血管软化丸能够提高主动脉miR-155、SOCS1 mRNA表达水平,降低p-STAT3、PDCD4 mRNA表达水平,降低血清TNF-α、IL-6、IFN-γ水平,本实验结果与血管软化丸通过抑制炎症反应影响炎症因子水平的既往结果一致。组织形态学观察显示,血管软化丸组小鼠AS病变程度明显轻于模型组,同时体外实验也验证了血管软化丸含药血清能够提高ox-LDL损伤模型RAW264.7细胞中miR-155、SOCS1 mRNA表达水平,降低p-STAT3、PDCD4 mRNA表达水平。
本研究提示:miR-155能够调控SOCS1-STAT3-PDCD4生物轴,影响TNF-α、IL-6、IFN-γ 3种炎症因子表达;血管软化丸抗AS的分子机制可能与调控miR-155和SOCS1/p-STAT3/PDCD4炎症信号通路,影响TNF-α、IL-6、IFN-γ等炎症因子水平有关。
