李子发酵前后挥发性成分及游离氨基酸的变化分析
2021-04-15李春燕魏福晓王道平
周 美 ,王 瑜 ,李春燕 ,张 明 ,李 青 ,魏福晓 ,王道平*
(1.贵州医科大学 省部共建药用植物功效与利用国家重点实验室,贵阳 550014;2.中国科学院 贵州省天然产物化学重点实验室,贵阳 550014)
李子又名嘉庆子、布霖,蔷薇科李属植物,为核果类水果,广泛分布于长江流域及西北一带,在我国有悠久的栽培历史。李子营养成分丰富,主要包括碳水化合物、蛋白质、核黄素、胡萝卜素、维生素C及多种微量元素等[1-4]。李子性平,味甘、酸,具有生津止渴、降低血压、促进消化、清肝除热、美容养颜等功效[5-7]。近年来,随着李子种植面积不断扩大,李子产量大幅度提升,然而李子属于季节性水果,鲜果不耐储藏,且价格较低,因此,如何延伸产业链、提高李子经济附加值是亟待解决的问题。
李子酵素是以李子为原料,加入白砂糖、发酵剂,经过低温长时间发酵而产生的功能性微生物发酵产品。在底物发酵过程中,微生物通过本身的中间代谢,使底物产生一系列的生物化学变化,得到的发酵产物不仅保留了底物特有的风味和营养成分,还能产生新的氨基酸等生理活性物质,风味和口感可得到明显改善[8-10]。开发李子酵素,可有望解决李子不耐储藏、附加值低等问题,还能丰富饮料品种,增加果农收入。
挥发性成分是评价水果酵素风味的重要指标[11-12];氨基酸是组成生物体中酶和蛋白质的基本单元,其种类和含量是评价食品营养价值的主要指标之一[13-14]。而关于李子发酵前后挥发性成分及游离氨基酸变化的系统性研究较少,因此,本工作采用顶空固相微萃取-气相色谱-质谱法(HS-SPMEGC-MS)分析了李子发酵前后挥发性成分的变化,采用氨基酸自动分析仪分析了李子发酵前后游离氨基酸的种类及含量的变化,以期为李子酵素及相关产品的综合开发利用奠定科学基础。
1 试验部分
1.1 仪器与试剂
HP6890/5975C型GC-MS联用仪;Supelco型手动固相微萃取装置,纤维头所装萃取纤维为2 cm-50/30μm DVB/CAR/PDMS StableFlex,配25 mL固相微萃取仪采样瓶;S433D 型全自动氨基酸分析仪,配阳离子分析柱;SKG-PB-936 型打浆机;YLKJ-JCG-500型不锈钢夹层锅;AG 285型电子天平;Millipore-0026型超纯水机。
磷酸丝氨酸、牛磺酸、磷乙醇氨、天冬氨酸、苏氨酸、丝氨酸、天冬酰胺、谷氨酸、α-氨基己二酸、甘氨酸、丙氨酸、瓜氨酸、α-氨基丁酸、缬氨酸、胱氨酸、蛋氨酸、异亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、β-丙氨酸、β-氨基异丁酸、γ-氨基丁酸、组氨酸、3-甲基组氨酸、1-甲基组氨酸、色氨酸、鸟氨酸、赖氨酸、精氨酸、脯氨酸等31种氨基酸(内含其他物质尿素和肌肽)混合标准溶液的浓度为100 nmol·L-1。
柠檬酸-柠檬酸锂缓冲液的pH 分别为2.90,4.20,8.00。
衍生剂茚三酮溶液:20 g·L-1。
氢氧化锂再生液:0.5 mol·L-1。
白砂糖为食品级;自制复合型发酵剂;茚三酮、乙醇、磺基水杨酸均为分析纯;发酵用水为灭菌饮用纯净水,试验用水为超纯水。
1.2 仪器工作条件
1.2.1 HS-GC-MS
1)HS条件 加热温度60 ℃;顶空萃取时间45 min;解吸时间5 min。
2)GC 条件 HP-5MS 色谱柱(60 m×0.25 mm,0.25μm);汽化室温度250 ℃,进样口温度250℃;载气为高纯氦气(纯度为99.999%),流量1.0 mL·min-1;不分流进样;溶剂延迟时间1 min。色谱柱升温程序:初始温度为40 ℃,保持2 min;以5 ℃·min-1升至270 ℃,保持63 min。
3)MS条件 电子轰击(EI)离子源,离子源温度230 ℃;接口温度250 ℃,四极杆温度150 ℃;电子能量70 e V;倍增器电压1 368 V;溶剂延迟时间1 min;扫描范围质荷比(m/z)29~500。
1.2.2 氨基酸分析
LCAK07/Li型标准分析阳离子型交换树脂;进样量50μL;通道1采用的检测波长为440 nm,用于检测脯氨酸,通道2采用的检测波长为570 nm,用于检测除脯氨酸以外的其他氨基酸;输液泵压力0~4.2 MPa;洗脱泵流量0.45 mL·min-1,茚三酮衍生泵流量0.25 mL·min-1;衍生方式为在线衍生;分离柱温度37 ℃,反应器温度130 ℃;流动相:A 为pH 2.90的柠檬酸-柠檬酸锂缓冲液;B 为pH 4.20的柠檬酸-柠檬酸锂缓冲液;C为pH 8.00的柠檬酸-柠檬酸锂缓冲液;D 为0.5 mol·L-1的氢氧化锂再生液。梯度洗脱程序见表1。
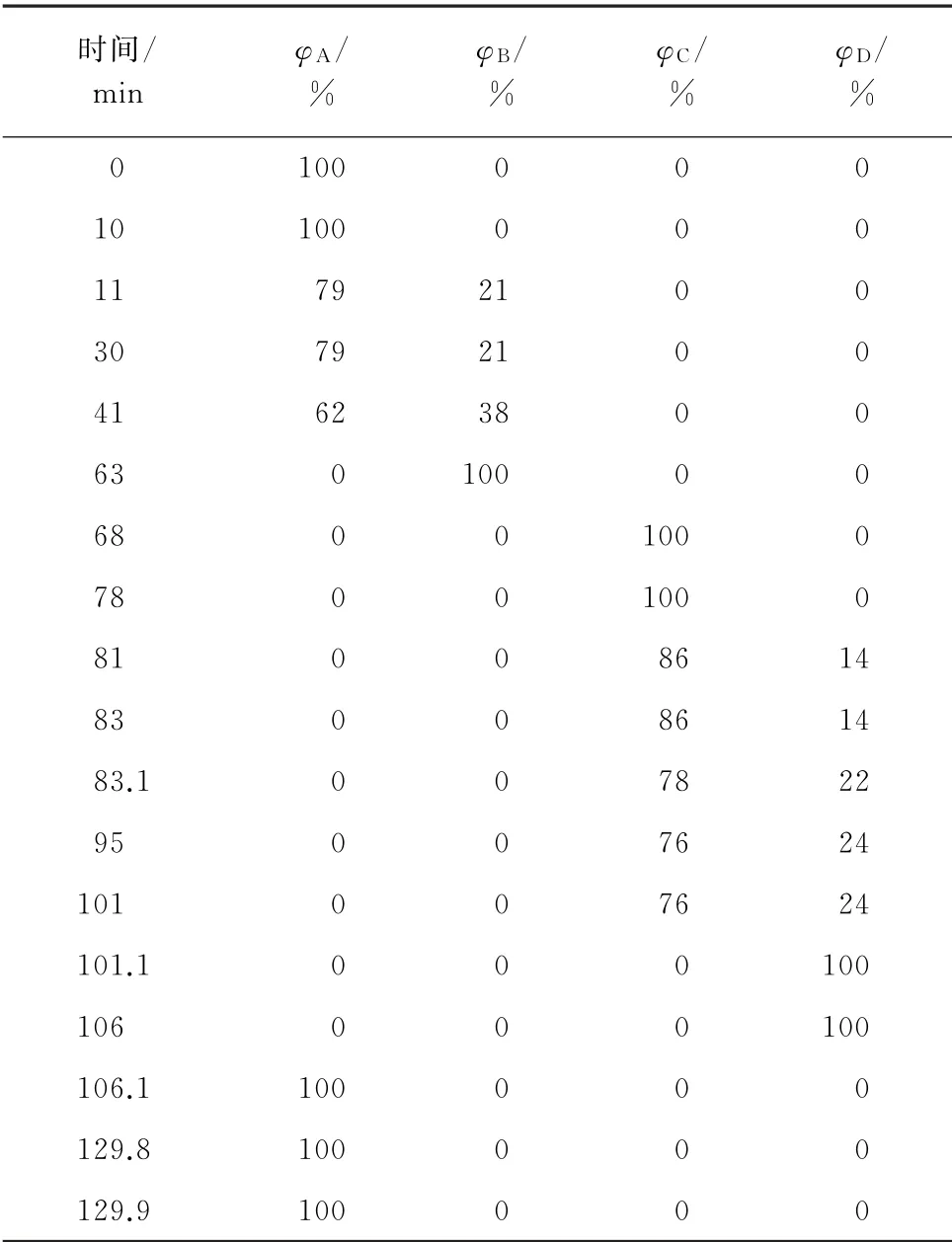
表1 梯度洗脱程序Tab.1 Program of elution gradient
1.3 试验方法
1.3.1 李子酵素制备
称取50 kg洗净去核新鲜李子样品,加入等质量的灭菌饮用纯净水打浆2 min,将浆液放入不锈钢夹层锅中加热熟化,于90~100 ℃下熬煮8 min后冷却至室温,按照其总质量的0.03%添加发酵剂,按照其总质量的8%添加白砂糖,搅拌使白砂糖完全溶化,将其转至陶瓷坛内,用0.154 mm 纱布封口,在18 ℃下发酵3个月,得到呈淡黄色澄清透明状的产物;在洁净度为10 万级的条件下,用0.45μm 的除菌滤膜于0.1 MPa下加压过滤,得到李子酵素样品,于15 ℃条件下保存备用。
1.3.2 挥发性成分试验
分别称取3.5 g去核均浆的新鲜李子样品、7 g李子酵素样品,置于固相微萃取仪采样瓶中,按照HS-SPME-GC-MS仪器工作条件分析发酵前后样品中的挥发性成分。
1.3.3 游离氨基酸试验
新鲜李子样品打浆5 min,以10 000 r·min-1的转速离心5 min,取50 mL 上清液用水定容至100.0 mL。取李子汁和李子酵素各25 mL,分别加入100 mL 乙醇,摇匀,静置30 min,以10 000 r·min-1的转速离心15 min,用质量分数为1%磺基水杨酸溶液将上清液定容至5.0 mL,过0.22μm 滤膜,滤液按照氨基酸分析仪器工作条件测定。
2 结果与讨论
2.1 挥发性成分结果分析
李子发酵前后样品的总离子流图见图1。
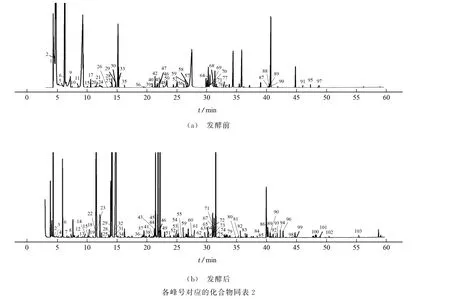
图1 李子发酵前后挥发性成分的总离子流图Fig.1 TIC chromatograms of volatile components before and after fermentation of Prunus salicina Lindl
对照NIST数据库,通过挥发性成分的质谱碎片信息、保留指数、保留时间等进行定性分析;采用峰面积归一法进行相对含量统计,结果见表2。其中峰号82,90,98,101对应的化合物属于烃类化合物;峰号2,4,5,7,9,13,14,16,17,19,28,29,30,48,49,52,58,60对应的化合物属于醇类化合物;峰号1,20,21,27,34,36,43,50,59,64,74,76对应的化合物属于醛类化合物;峰号10,55,83,86,95,96,97,103对应的化合物属于酮类化合物;峰号8,25,37,38,42,67,72对应的化合物属于羰酸类化合物;峰号63,73,80,85,91,99对应的化合物属于酚类化合物;峰号11,35,39,53,54,81对应的化合物属于其他化合物;其他峰号对应的化合物属于酯类化合物。
由表2可以看出:在李子发酵前后,其中的挥发性成分种类和含量具有较大差异;新鲜李子中检出48种挥发性成分,包括烃类(1种)、醇类(11种)、醛类(9种)、酮类(3种)、羧酸类(1种)、酯类(19种)、酚类(1种)、其他(3种)化合物,其中含量最高的是醇类化合物;李子酵素中共检出68种挥发性成分,包括烃类(4 种)、醇 类(11 种)、醛 类(6 种)、酮 类(5种)、羧酸类(6种)、酯类(28种)、酚类(5种)、其他(3种),其中醇类和酯类化合物含量较高。发酵后的李子酵素中挥发性成分较发酵前的共增加了20种,这是李子酵素香气浓郁的主要原因。
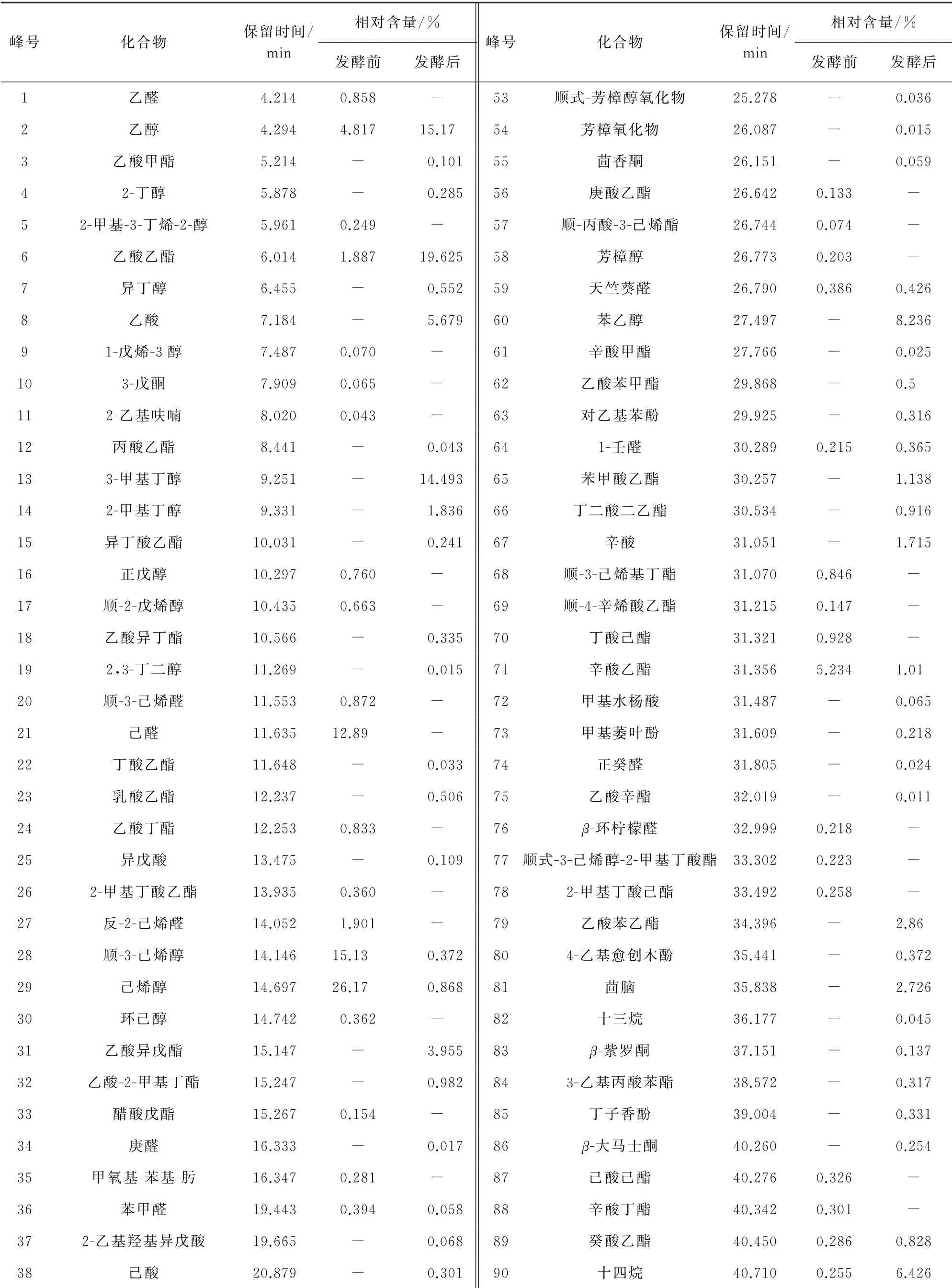
表2 李子发酵前后挥发性成分分析结果Tab.2 Analytical results of volatile components before and after fermentation of Prunus salicina Lindl
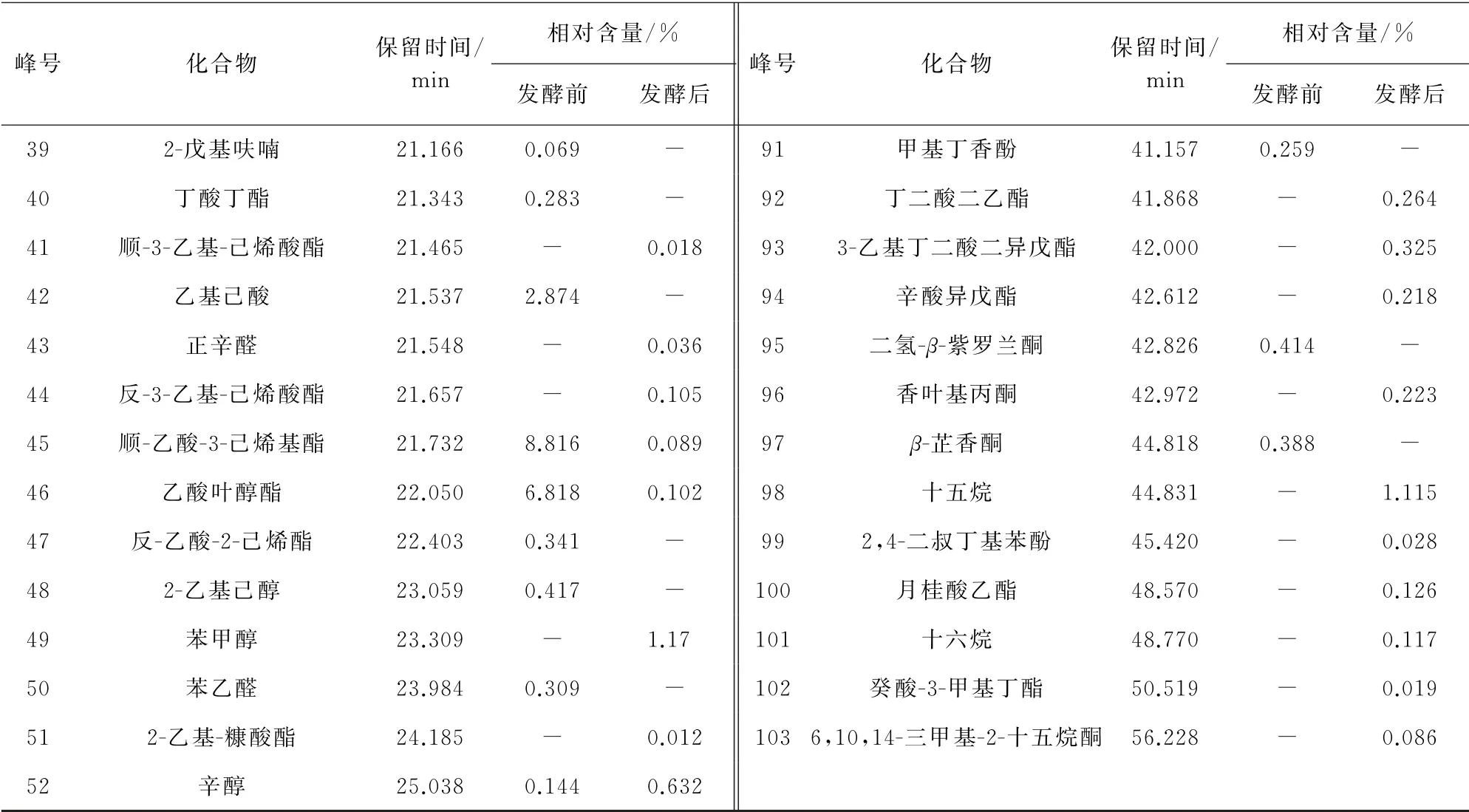
表2 (续)
2.2 游离氨基酸结果分析
2.2.1 色谱行为
31种氨基酸混合标准溶液与发酵前后样品的色谱图见图2。
2.2.2 标准曲线和检出限
按照氨基酸分析仪器工作条件对100 nmol·L-1的氨基酸混合标准溶液进行单点外标法测定,以氨基酸的浓度为横坐标,其对应的色谱峰面积为纵坐标绘制标准曲线。
按照3倍信噪比(3S/N)计算31种氨基酸的检出限(3S/N),得到31 种氨基酸的检出限为0.5~7.9 nmol·L-1。
2.2.3 精密度试验
按照氨基酸分析仪器工作条件对100 nmol·L-1的氨基酸混合标准溶液进行测定,重复进样6次,计算各氨基酸峰面积的相对标准偏差(RSD),所得结果为0.70%~2.2%,小于3%,表明该方法的精密度良好。
2.2.4 回收试验
在李子汁和李子酵素中分别加入100 nmol·L-1的氨基酸混合标准溶液,按1.3.3节制备2种样品溶液,每种样品平行制备6份,按照氨基酸分析仪器工作条件分析加标前后的样品,记录各氨基酸色谱峰面积,计算李子发酵前后各游离氨基酸的相对含量,并计算回收率,结果见表3,其中“*”为必需氨基酸,李子汁和李子酵素中均未检出α-氨基己二酸和β-氨基异丁酸。
由表3可以看出:李子汁中含有20种游离氨基酸,总量为6 105 mg·L-1,天冬酰胺含量最高,其次是丙氨酸;其中,7种为人体必需氨基酸,13种为非必需氨基酸,必需氨基酸总量为983 mg·L-1,相对含量为16.10%;李子酵素中含24种游离氨基酸,总量为4 127 mg·L-1,丙氨酸含量最高,其次是磷酸丝氨酸;其中,8种为人体必需氨基酸,16种为非必需氨基酸,必需氨基酸总量为1 099 mg·L-1,相对含量为26.63%;李子发酵前后必需氨基酸种类和含量均增加;和发酵前的李子相比,李子酵素中游离氨基酸总量降低,这可能与微生物生长消耗部分氨基酸有关;新增了牛磺酸、胱氨酸、蛋氨酸、3-甲基组氨酸、1-甲基组氨酸等5种氨基酸;以李子汁和李子酵素为基质得到的加标回收率分别为95.3%~101%和95.5%~101%,表明本方法具有较好的可靠性。
2.2.5 稳定性试验
按照1.3.3节方法制备李子汁和李子酵素样品溶液,并分别于0,4,8,16,24,32 h进样测定。结果显示:31种氨基酸峰面积的RSD(n=6)为0.70%~2.2%,均小于3%,表明供试品溶液在32 h内稳定。
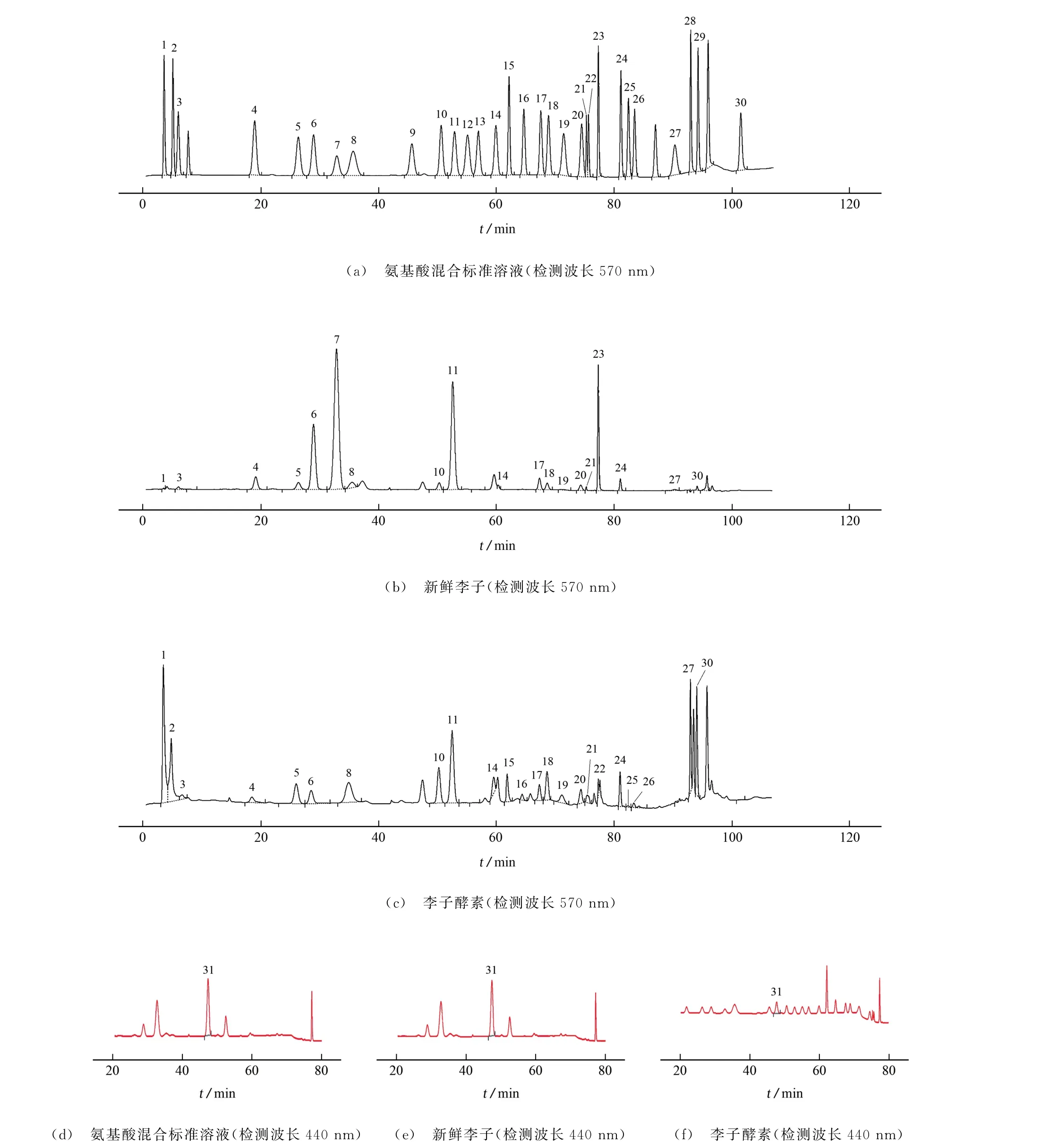
图2 氨基酸混合标准溶液、李子酵素、新鲜李子中游离氨酸酸的色谱图Fig.2 Chromatograms of free amino acids in amino acid mixed standard solution,enzyme of Prunus salicina Lindl,and fresh Prunus salicina Lindl
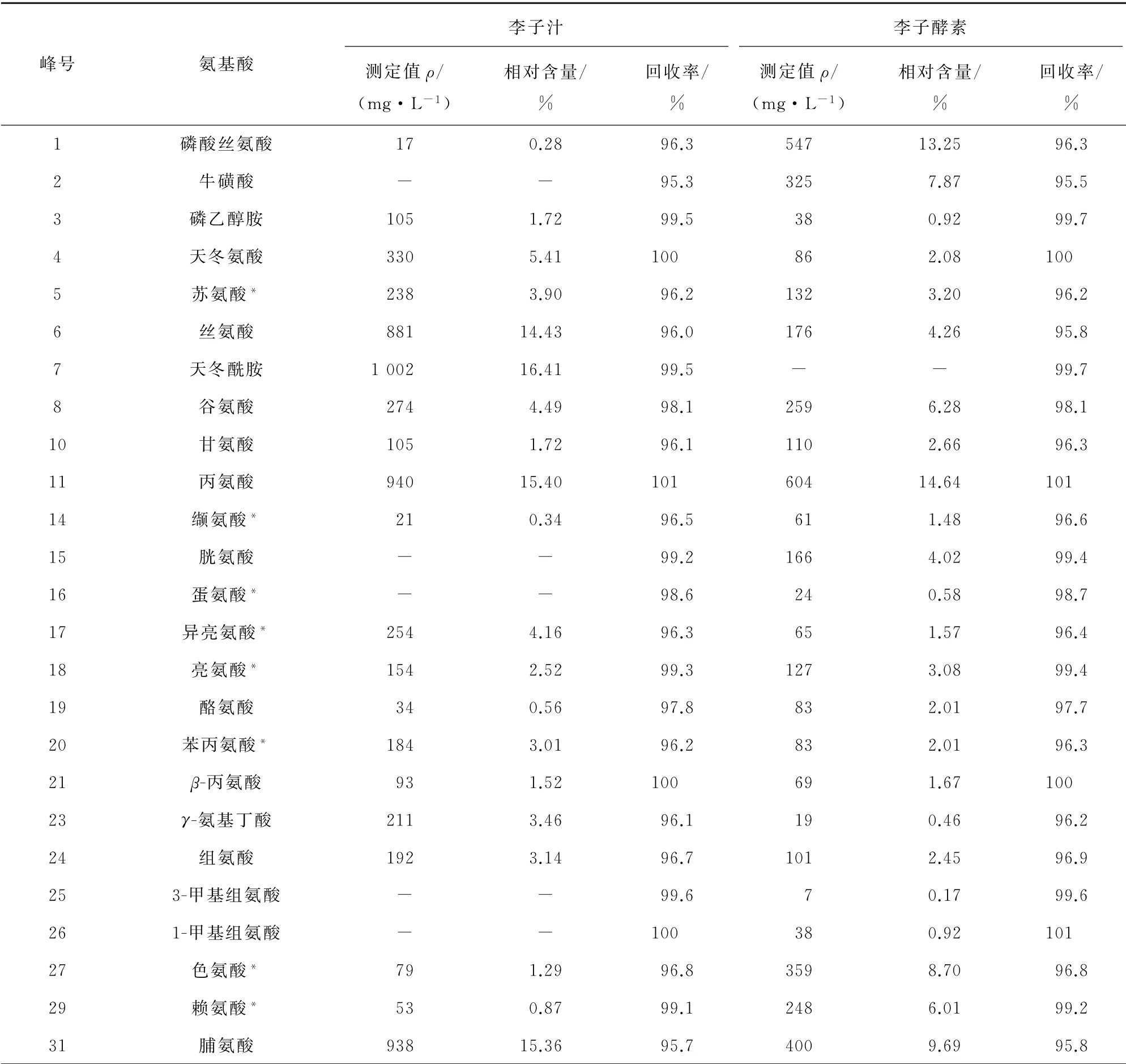
表3 回收试验结果Tab.3 Results of test for recovery
本方法采用HS-SPEM-GC-MS分析了新鲜李子和李子酵素中的挥发性成分,李子汁中检出48种挥发性成分,李子酵素中共检出68种挥发性成分,发酵后挥发性成分共增加了20种,使李子酵素的风味和口感得到明显改善。采用氨基酸分析仪分析了李子汁和李子酵素中游离氨基酸的种类和含量,发现李子酵素中游离氨基酸的种类比发酵前的增加了5种,部分氨基酸含量较发酵前的也有所增加,且人体必需氨基酸占总氨基酸比例较大。本方法可为进一步研究李子酵素香气物质和氨基酸种类增多的机理奠定一定的科学基础,也可为李子酵素产品的开发提供技术支撑。
