多壁碳纳米管基质固相分散萃取-高效液相色谱法测定蔬菜中7种氨基甲酸酯类农药残留量
2021-04-15方树桔王红斌张艳丽屈林悦杨志娥李桂镇
方树桔,杨 敏,王红斌,谭 伟,张艳丽,屈林悦,杨志娥,李桂镇
(云南民族大学 化学与环境学院,昆明 650500)
氨基甲酸酯类农药是一种高毒性的杀虫剂[1],属于胆碱酯酶抑制剂,在农业生产中应用比较广泛。氨基甲酸酯类农药对人类身体健康具有一定的危害作用[2],因此,该类农药残留量也日渐受到人们的关注。由于氨基甲酸酯类农药的热稳定性较差,目前针对氨基甲酸酯农药残留量的测定方法主要为高效液相色谱法(HPLC)[3]和高效液相色谱-质谱法[4]。与HPLC 相比,高效液相色谱-质谱法虽然专属性较强,但其检测成本更高,操作更繁琐。
常用的蔬菜类样品前处理方法较多,其中,基质固相分散萃取法(MSPD)是近年发展起来的一种前处理方法,该方法可以同时完成样品的制备、萃取和净化等步骤,具有快速、高效的特点[5]。MSPD 的关键步骤是选择何种材料作为其固相萃取材料。多壁碳纳米管(MWCNTs)是由多层六角碳网层面卷成的同轴圆筒状的碳纳米管[6],具有很好的表面吸附性能[7-9],是在色谱分析中广泛应用的固相萃取材料[10]。相关的研究也较多,如利用MWCNTs作为固相萃取材料进行样品前处理,测定了茶叶中26种农药[11]以及水果和蔬菜[12-13]中有机磷农药含量,方法简单易操作、可靠性高、回收率好,且检出限低。
本工作以MWCNTs作为固相萃取材料,建立了多壁碳纳米管基质固相分散萃取-高效液相色谱法(MWCNTs-MSPD-HPLC)测定蔬菜中7种氨基甲酸酯类农药(涕灭威砜、3-羟基克百威、涕灭威、克百威、异丙威、灭多威和甲萘威)残留量的方法,并推广应用于水果中7种氨基甲酸酯类农药含量的测定,以期为蔬菜和水果中氨基甲酸酯类农药残留量的监控提供技术参考。
1 试验部分
1.1 仪器与试剂
Agilent 1290型高效液相色谱仪,配自动进样系统和二极管阵列检测器(DAD);RE-52AA 型真空旋转蒸发仪;SHB-Ⅲ型冷却循环泵;JJ 500型电子天平;AB 204S型电子天平。
7 种氨基甲酸酯类农药标准储备溶液:1 000 mg·L-1,使用时用甲醇配制成2.50 mg·L-1的混合标准溶液,再根据实际需要用甲醇配制成不同质量浓度的混合标准溶液。
MWCNTs:型号为GYM 003,工业级,纯度大于90%,外径为50~100 nm,长度为5~10μm,杂质(灰分测试结果)的质量分数小于3.5%,比表面积大于100 m2·g-1,使用前将其在105 ℃下活化1 h。
7种氨基甲酸酯类农药的纯度均不小于98%;无水硫酸镁为分析纯;甲醇、乙腈、乙酸乙酯、环己烷、二氯甲烷、甲苯均为色谱纯;试验用水为纯净水。
蔬菜样品中的扁豆样品采自云南省临沧市,其余5种蔬菜(空心菜、白菜、结球甘蓝、茄子和黄瓜)样品采自海南省海口市、琼海市;水果样品中的香蕉采自云南省普洱市,桃子分别采自海南省海口市、琼海市。
1.2 仪器工作条件
RRHD SB-C18(150 mm×2.1 mm,1.8μm),柱温30℃;检测波长为200 nm(除甲萘威和灭多威的5种农药),220 nn(甲萘威),230 nm(灭多威);进样量2.5μL;流动相为乙腈-水体系;流量0.15 mL·min-1;梯度洗脱程序见表1。

表1 梯度洗脱程序Tab.1 Program of eluent gradient
1.3 试验方法
称取0.50 g样品于研钵中,加入100 mg活化好的MWCNTs和0.50 g无水硫酸镁,研磨成均匀粉末。将研磨好的混合物转移到底部放有筛板的注射器内,顶部放入少许脱脂棉,压实,保证柱子均匀填实且无裂缝。用20 mL乙腈洗脱柱子,收集洗脱液,于35 ℃旋蒸至近干,用2 mL甲醇溶解残渣,过0.22μm 滤膜,按照仪器工作条件对滤液中的7种氨基甲酸酯类农药含量进行测定。
2 结果与讨论
2.1 MSPD条件的选择
2.1.1 MWCNTs用 量
试验考察了MWCNTs用量分别为60,80,90,100,120 mg时对氨基甲酸酯类农药萃取效果的影响,结果见图1。
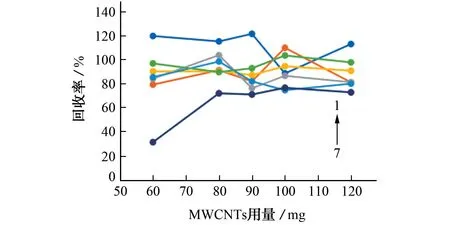
图1 MWCNTs用量对7种农药回收率的影响Fig.1 Effect of MWCNTs amount on recovery of the 7 pesticides
由图1可知:当MWCNTs用量为60 mg时,甲萘威回收率较低,不能满足分析要求;当MWCNTs用量达到80 mg时,各农药的回收率均在60%以上;当MWCNTs用量为100~120 mg时,各农药的回收率较为理想,满足分析要求。综合考虑,试验选择的MWCNTs的用量为100 mg。
2.1.2 洗脱剂及用量
比较了乙腈、甲醇、乙酸乙酯、乙酸乙酯-环己烷混合溶液(体积比为4∶1)、甲醇-乙腈混合溶液(体积比为7∶3)、甲醇-乙腈混合溶液(体积比为3∶7)、乙腈-甲苯混合溶液(体积比为4∶1)作洗脱剂时对空心菜中7种氨基甲酸酯类农药的洗脱效果。结果显示:用乙酸乙酯、乙腈-甲苯混合溶液(体积比为4∶1)洗脱时,洗脱液中有很多非极性的杂质存在,推测其原因是空心菜样品中含有较多非极性杂质[14],而乙酸乙酯和乙腈-甲苯混合溶液(体积比4∶1)这两种洗脱剂的极性较乙腈弱,更容易将样品中的非极性杂质洗出;用甲醇、乙酸乙酯-环己烷混合溶液(体积比4∶1)、甲醇-乙腈(体积比3∶7)和甲醇-乙腈混合溶液(体积比为7∶3)洗脱时,涕灭威砜的回收率偏高,甲萘威的回收率偏低,这可能是由于这3种洗脱剂洗脱出了大量的杂质,和涕灭威砜及甲萘威的极性相似,从而干扰了涕灭威砜、甲萘威的含量测定;而用乙腈洗脱时,7种氨基甲酸酯类农药的回收率都能满足分析要求,且无杂质峰干扰。考虑到蔬菜样品水分含量高且用乙腈洗脱基质干扰程度小,故选择乙腈作洗脱剂。
试验还考察了洗脱剂乙腈的用量分别为8,10,15,20,25,30 mL时对7种氨基甲酸酯类农药洗脱效果的影响。结果显示:涕灭威砜、3-羟基克百威、涕灭威、克百威、异丙威、灭多威等6种农药回收率受洗脱剂用量影响较小;随着洗脱剂用量的增大,甲萘威回收率逐渐增大,当洗脱剂用量超过20 mL后,甲萘威回收率趋于稳定,故试验选择乙腈的用量为20 mL。
2.2 色谱条件的选择
2.2.1 色谱柱
考察了ZORBAX Eclipse Plus C8色谱柱(100 mm×3.0 mm,1.8μm)和RRHD SB-C18色谱柱(150 mm×2.1 mm,1.8μm)对7种氨基甲酸酯类农药分离效果的影响。结果表明:使用ZORBAX Eclipse Plus C8色谱柱(100 mm×3.0 mm,1.8μm)分离时,7种农药分离度较差、响应强度较低;而使用RRHD SB-C18色谱柱(150 mm×2.1 mm,1.8μm)分离时,7种农药的基线平稳、峰形好、响应强度高。因此,试验选择RRHD SB-C18色谱柱(150 mm×2.1 mm,1.8μm)分离7种氨基甲酸酯类农药。
2.2.2 流动相流量
试验采用乙腈-水体系进行梯度洗脱,考察了流量分别为0.10,0.15,0.20 mL·min-1时对7种氨基甲酸酯类农药分离效果的影响。结果显示:当流量为0.10 mL·min-1时,7种农药出峰过慢;当流量为0.20 mL·min-1时,7种农药保留时间均提前,色谱峰相互叠加,如涕灭威砜保留时间为1.829 min,出峰过早,色谱柱平衡时间较短,从而引起7种农药色谱峰相互叠加;当流量为0.15 mL·min-1时,7种农药在27 min内完成出峰,各农药峰形尖锐且分离度较好。因此,试验选择流动相流量为0.15 mL·min-1。
2.2.3 检测波长
用仪器配置的DAD 对7种农药进行了190~235 nm 波长范围内的紫外扫描。结果表明:甲萘威在220 nm 处有最大吸收;灭多威在230 nm 处有最大吸收;其余5种农药均在200 nm 处有最大吸收。故试验确定甲萘威的检测波长为220 nm,灭多威的检测波长为230 nm,其余5 种农药的检测波长为200 nm。
2.2.4 柱 温
对7种农药在不同柱温(20,30,40 ℃)下的分离效果进行了考察。结果显示:柱温对7种农药的出峰有一定的影响,但影响不大;当柱温为20℃时,7种氨基甲酸酯类农药出峰时间整体延迟;当柱温为30℃时,基线平稳,各农药间的分离度均较好;当柱温为40 ℃时,虽然7种农药出峰均提前,但是基线不够平稳。因此,试验选择的柱温为30 ℃。
2.2.5 进样量
对7种氨基甲酸酯类农药在进样量分别为1.0,2.5,5.0μL 时的分离效果进行了比较。结果显示:进样量大于2.5μL时,7种农药的峰形较差;进样量为1.0μL时,7种农药响应信号强度较弱。因此,试验选择的进样量为2.5μL。
在优化的色谱条件下,1.0 mg·L-17 种农药的混合标准溶液的色谱图见图2。
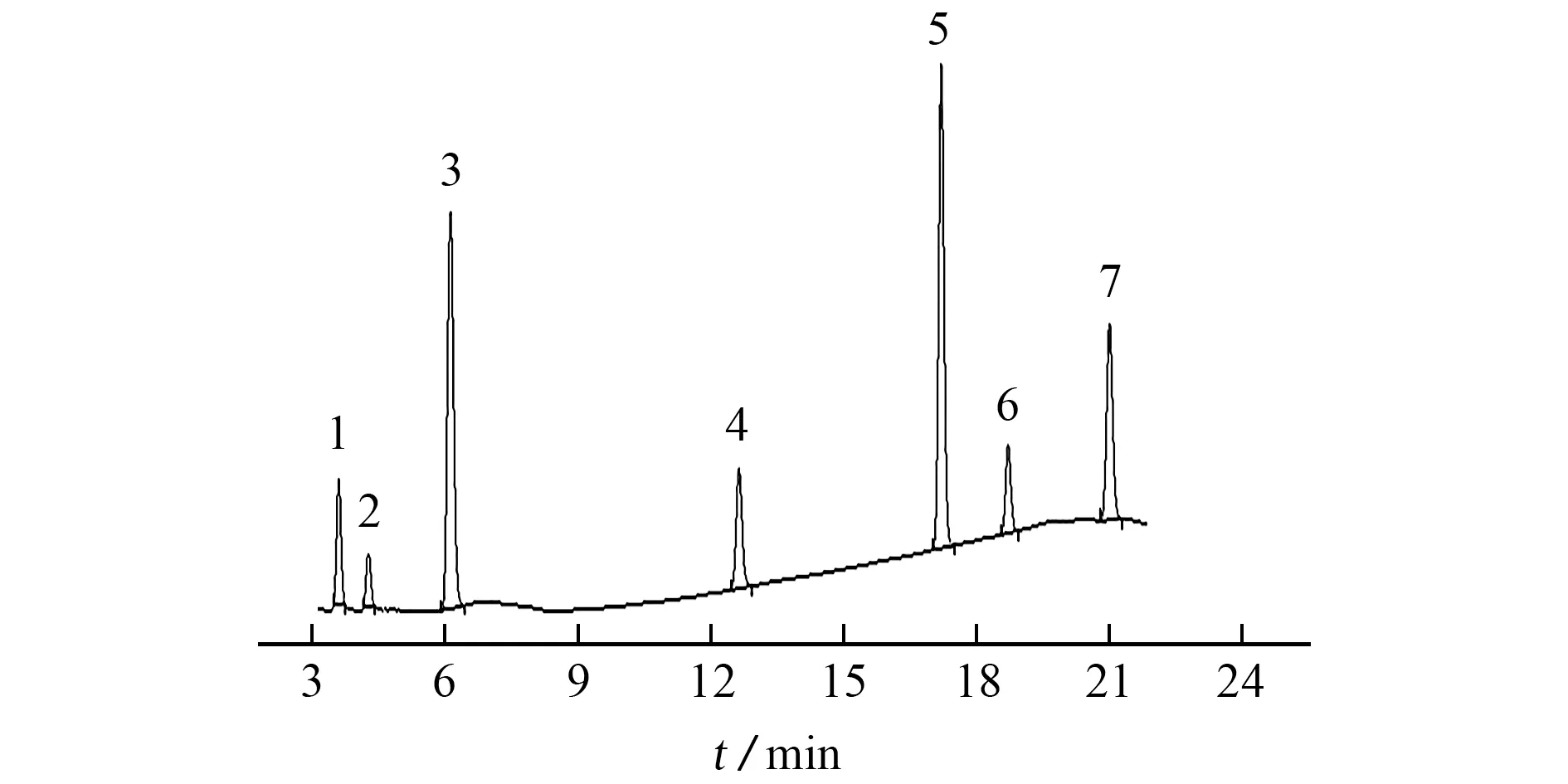
图2 混合标准溶液色谱图Fig.2 Chromatogram of mixed standard solution
由图2可知:涕灭威砜、灭多威、3-羟基克百威、涕灭威、克百威、甲萘威和异丙威的保留时间分别为3.625,4.297,6.153,12.686,17.265,18.780,21.075 min。
2.3 标准曲线和检出限
按照仪器工作条件对0.025,0.05,0.10,0.50,1.00,2.50,5.00 mg·L-1的7种氨基甲酸酯类农药混合标准溶液系列进行测定,以各农药的质量浓度为横坐标,其对应的峰面积为纵坐标绘制标准曲线。结果显示:7 种农药的标准曲线的线性范围均为0.025~5.00 mg·L-1,线性回归方程、相关系数见表2。
以3倍信噪比(S/N)计算检出限(3S/N),结果见表2。
由表2可知:各农药的线性关系较好,相关系数均大于0.999 0;检出限为0.002 7~0.011 0 mg·kg-1。
2.4 精密度和回收试验
称取0.50 g空白样品(空心菜),按照试验方法进行3个浓度水平的加标回收试验,每个浓度水平平行测定5次,计算回收率和测定值的相对标准偏差(RSD),结果见表3。其中由于甲萘威响应较好,适当降低了其加标量。
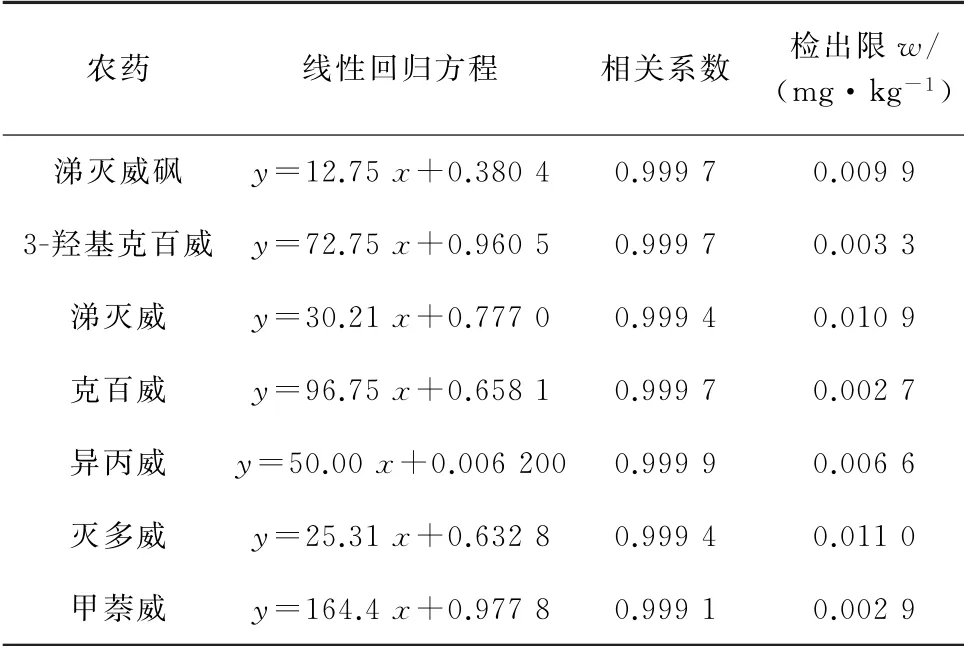
表2 线性回归方程、相关系数和检出限Tab.2 Linearity regression equations,correlation coefficients and detection limits
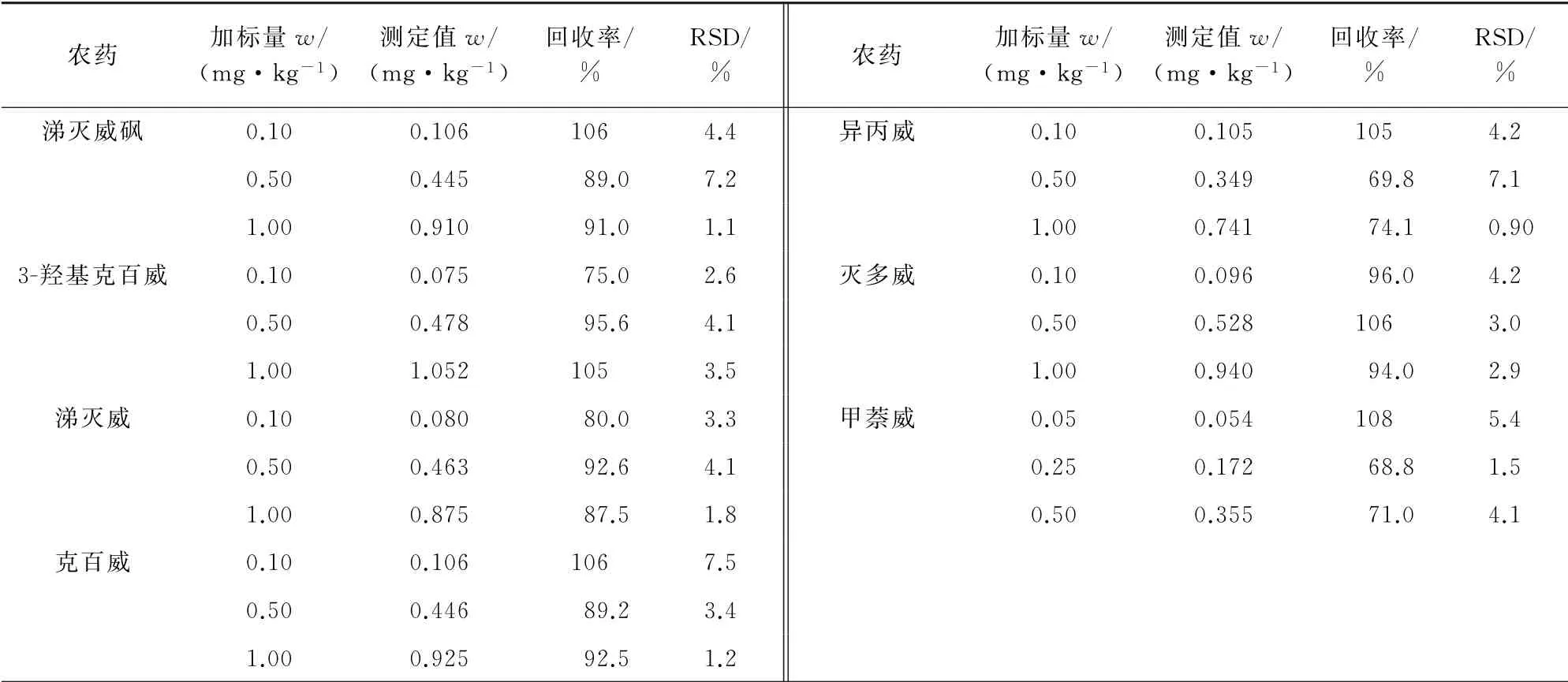
表3 精密度和回收试验结果(n=5)Tab.3 Results of tests for precision and recovery(n=5)
由表3 可知:各农药的回收率为68.8%~108%,RSD 不大于8.0%,符合GB/T 27404-2008《实验室质量控制规范 食品理化检测》对农药残留分析的要求。
2.5 样品分析
按照试验方法分析空心菜、白菜、结球甘蓝、扁豆、茄子和黄瓜等6 种蔬菜样品。结果显示:在白菜、结球甘蓝、扁豆样品中检出了氨基甲酸酯类农药。
将这3种阳性蔬菜样品的测定结果与NY/T 761-2008《蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》标准方法所得的测定结果进行了比对,结果见表4。
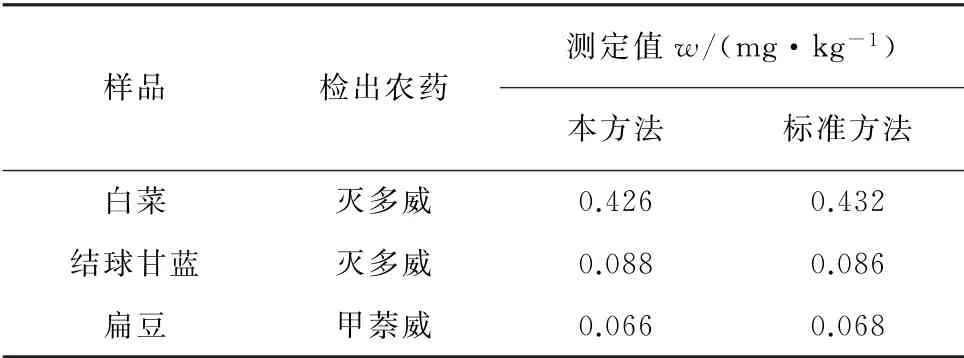
表4 样品分析结果Tab.4 Analytical results of the samples
由表4可知,3种蔬菜中氨基甲酸酯类农药的残留量均在GB 2763-2014《食品安全国家标准 食品中农药最大残留限量》规定的限值范围内,且测定结果与标准方法的基本一致。
2.6 方法推广
按照试验方法对来自2个产地的桃子和1个产地的香蕉进行加标回收试验(加标量为0.10,0.50,1.00 mg·kg-1),每种样品平行测定5次,计算回收率和测定值的RSD。结果显示:在3个样品中均未检出上述7种农药,且得到的7种农药的回收率为71.2%~108%,测定值的RSD 为0.30%~9.9%,满足农药残留分析要求。
本工作建立了MWCNTs-MSPD-HPLC 测定蔬菜中7种氨基甲酸酯类农药残留量的方法,并扩展应用到了水果样品。该方法简单、快速、可靠,可用于蔬菜样品中氨基甲酸酯类农药残留量的分析,并具有广泛的应用前景。
