空化射流对大豆分离蛋白结构及乳化特性的影响
2021-04-15江连洲杨宗瑞任双鹤郭增旺王中江尹金富
江连洲,杨宗瑞,任双鹤,郭增旺,王中江,3,尹金富
(1. 东北农业大学食品学院,哈尔滨 150030;2. 临邑禹王植物蛋白有限公司,德州 251200;3. 山东万得福实业集团有限公司,东营 257500;4. 潍坊第一春食品有限公司,潍坊 262699)
0 引 言
大豆分离蛋白(SPI,Soy Protein Isolate)具有较高的食品的营养价值[1]。然而,未经改性的天然SPI理化性质易受环境因素影响,因而使其应用受到一定程度的限制[2],不能满足特定食品加工的要求。
现有研究表明,空化射流处理具有高热、高压、强剪切、强冲击波等特点[3-4]。处理中产生的能量可以打开各种材料的分子链,产生的冲击波和微射流通过冲蚀作用使物料粉碎。作为一种操作简单、性能稳定、易于工业化的新技术,空化射流近年来逐渐得到各界学者的广泛关注。Oliete等[5]发现空化射流产生的空化效应可改变豌豆球蛋白聚集体的结构,从而增强了其乳液稳定性,具有较高的工业化价值。Subirade等[6]发现空化效应对β-乳球蛋白三级结构的影响比较显著。解长远等[7]研究了空化射流处理时间对不同质量浓度大豆11S球蛋白结构与功能特性的影响,结果表明处理后的大豆11S球蛋白功能特性得到改善。同时蛋白质浓度也会影响物理场对蛋白改性的效果。李笑笑[8]的研究表明高场强超声波处理大豆蛋白后,所有样品的溶解度均呈现显著升高趋势,其中5%浓度的SPI具有更高的溶解度,但超声处理对3%浓度的SPI溶解性提升的幅度相对更大。李雨枫等[9]的研究表明不同浓度下的肌原纤维蛋白也会影响高压均质对其的改性效果。但是目前关于空化射流物理场对蛋白的结构和界面特性影响的互作机制还尚未见报道。
本文采用空化射流处理对SPI进行物理改性,探究空化射流处理时间对不同大豆蛋白浓度下的结构及乳液界面性质的影响,为SPI工业改性应用提供新方法及相应理论依据。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白(食品级,纯度92%):山东禹王实业有限公司。
十二烷基硫酸钠(SDS,Sodium Dodecyl Sulfate):天津市光复精细化工研究所;lowery蛋白试剂盒:北京索莱宝科技有限公司;8-苯胺基-1-萘磺酸(ANS,8-Anilino-1-Naphthalenesulfonic acid):美国Sigma公司。所用其他试剂最低纯度为分析纯。
1.2 仪器与设备
FD 5-3型冷冻干燥机,美国SIM公司;2L实验室小型射流空化机,北京中森汇嘉科技发展有限责任公司;电子分析天平,北京赛多利斯仪器系统有限公司;GL-20G-Ⅱ高速冷冻离心机,上海安亭科学仪器厂;PHSJ-4A型实验室pH计,中国上海雷磁公司;L-8800型氨基酸分析仪,日本日立公司;Zetasize Nano ZS90纳米粒度及Zeta电位分析仪,英国马尔文仪器有限公司;D-6L超高压均质机,美国PhD科技有限公司;1600PC紫外-可见分光光度计,上海美普达仪器有限公司;RST-CPS流变仪,美国博勒飞公司;XW-80A旋涡混合器,上海青浦沪西仪器厂。
1.3 试验方法
1.3.1 样品的制备
参考解长远等[7]的方法并加以改动,将SPI以2%和5%的浓度溶解于pH值为7.0,0.01 mol/L的磷酸盐缓冲溶液中,搅拌直至样品充分溶解。将样品溶液用空化射流机在0.01 MPa压力、20 ℃下分别处理2、4、6、8、10 min,得到样品溶液(2种浓度SPI溶液及对应的5种不同空化射流处理时间的SPI溶液)共12种。冻干后即得样品。
1.3.2 氨基酸含量的测定
参考Wu等[10]的测量方法,将样品溶液在110 ℃条件下加入6.0 mol/L的HCl溶液酸解24 h后,用氨基酸分析仪测定,进样量为30μL。
1.3.3 还原性SDS-PAGE(Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis)电泳
参考Laemmli[11]的方法并加以改动,将样品以0.01 g/mL浓度溶于pH值为7.0,0.01 mol/L磷酸盐缓冲溶液中,再与上样缓冲液等量混合,煮沸5 min,上样量为12μL。电泳过程采用恒压模式,在浓缩胶中电压为80 V,分离胶中电压为120 V。停止电泳后将分离胶移入考马斯亮蓝R-250染色液中染色0.5 h,再于脱色液中浸泡至无色,拍照记录结果。
1.3.4 溶液粒径的测定
用pH值为7.0,0.01 mol/L的磷酸盐缓冲溶液将样品配成0.2%的蛋白溶液,在室温下采用Zetasize Nano ZS90纳米粒度及Zeta电位分析仪进行测量。参数设置为颗粒折射率1.45,分散剂折射率1.34,吸附率0.001。
1.3.5 乳液样品的制备
将样品以0.01 g/mL浓度溶于pH值为7.0,0.01 mol/L磷酸盐缓冲溶液中,混匀后在4 ℃冰箱过夜,使其充分水合。向溶液中加入5%的大豆油,经11 000 r/min粗均1.5 min后,在60 MPa下高压均质3次,得到新鲜乳液。
1.3.6 乳液ζ-电位的测定
将乳液用pH值为7.0,0.01 mol/L的磷酸盐缓冲溶液稀释(1∶100),充分混匀后,装入电位杯,用Zetasize Nano ZS90纳米粒度及Zeta电位分析仪测量电位,重复3次。
1.3.7 界面蛋白含量的测定
界面蛋白含量的测定参照Keerati等[12]的方法并加以改动。将乳液在室温下20 000 r/min离心40 min,离心后乳液分为上下2层。取下层的蛋白水相过0.22μm滤膜后用lowry法测定其蛋白含量。界面蛋白含量计算公式如式(1):
式中Γ为界面吸附蛋白量,mg/m2;Ctotal为乳液中总蛋白浓度,(g/g);Cserum为水相的蛋白浓度,(g/g);B为液滴的比表面积,(m2/g)。
1.3.8 乳液粒径的测定
乳液的粒度分布采用Chen等[13]的方法,将乳液用去离子水稀释(1∶1 000),充分混匀后,通过Zetasize Nano ZS90纳米粒度及Zeta电位分析仪测定。参数设置为颗粒折射率1.45,分散剂折射率1.33,吸附率0.001。在环境温度下进行测量,并重复3次。记录乳状液滴粒径分布曲线和体积平均粒径(D4,3)。
1.3.9 乳液动态流变学的测定
根据Niu等[14]的方法并加以改动,设置2个板间距为0.5 mm,直径为40 mm的平板。取1 mL乳液加到流变仪感应板上,在角频率为0.63 rad/s的条件下进行温度扫描,最大应变为0.02%。测定期间样品以5 ℃/min的速率从25 ℃升温至90 ℃,恒温20 min后再以5 ℃/min的速率降至25 ℃。记录下弹性模量G′的数值变化。
1.3.10 乳化活性及乳化稳定性的测定
乳化活性及乳化稳定性的测定根据汪菁琴[15]的方法并加以改动,将乳液用1 g/L的SDS溶液稀释(1∶250),充分混匀后,用分光光度计在波长500 nm下测量其吸光值A。30 min后再次测量其吸光值A0。用1 g/L的SDS溶液作为空白对照。乳化活性(EAI,Emulsifying Activity Index)和乳化稳定性(ESI,Emulsifying Stability Index)的计算公式如式(2)、式(3):
式中A为样品溶液吸光值;A0为30 min后样品溶液的吸光值;C为乳化液形成之前的溶液中蛋白质的质量浓度,(g/mL);φ为油占乳化液的体积分数;N为样品稀释倍数。
1.3.11 数据分析
每个试验重复3次,采用Origin 2019b软件作图。采用SPSS 26软件进行ANOVA差异显著性分析,P<0.05为显著性差异。
2 结果与讨论
2.1 氨基酸含量分析
空化射流对2%和5%浓度大豆分离蛋白的人体必需氨基酸及含硫氨基酸含量的影响见表1。
由表1可知,空化射流处理对不同浓度的SPI氨基酸含量具有显著的影响,其中含硫氨基酸含量发生了显著的变化。这表明适当的空化射流处理可以通过氨基酸间的相互转化,改变SPI的氨基酸组成[16]。随空化射流处理时间的延长,2%和5%浓度下SPI组分中的含硫氨基酸(即甲硫氨酸和半胱氨酸)均呈现逐渐下降的趋势,且丙氨酸含量的变化趋势大致与含硫氨基酸的变化趋势相反。这可能是因为空化射流物理场的空化效应所产生的局部瞬时高温使甲硫氨酸转化为半胱氨酸,而半胱氨酸发生了脱硫反应,转化为丙氨酸,进而导致含硫氨基酸(半胱氨酸和甲硫氨酸)含量的下降[17]。这表明空化射流处理可以通过改变SPI中的氨基酸组成及含量影响蛋白结构,进而实现对SPI功能活性的调节。
2.2 SDS-PAGE图谱分析
采用SDS-PAGE 分析不同空化射流处理时间下SPI的组成,结果见图1。
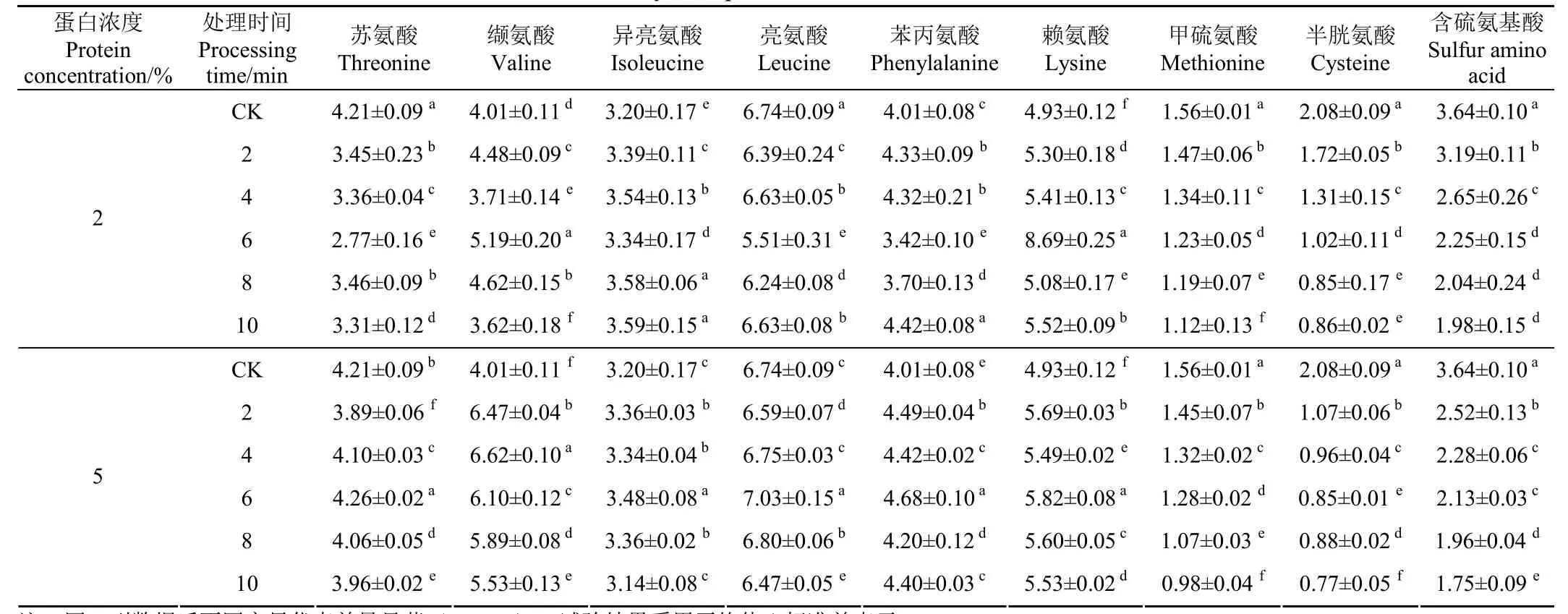
表1 不同空化射流处理时间对2%及5%浓度的大豆分离蛋白部分氨基酸组成的影响Table 1 Effect of different cavitation jet treatment time on the amino acid composition of 2% and 5% concentration of soybean protein isolate %
由图1可知,空化射流处理对不同浓度的SPI的亚基组成无显著影响,未改变SPI的7S和11S亚基部分,但随空化射流处理时间的延长,亚基条带的变化趋势出现了区别。2%浓度下大豆蛋白的亚基条带的呈现了α(67 kDa)、α′(71 kDa)、β(50 kDa)和A(36 kDa)亚基部分逐渐变浅,B(18 kDa)亚基部分逐渐变深的趋势;而5%浓度下大豆蛋白的亚基条带则呈现出α、α′、β和A亚基部分先变浅后变深,B亚基部分先变深后变浅的趋势。同时在空化射流处理初期,腔体内的高温、高压力、高剪切力等极端环境使得分子间和分子内的氢键断裂,蛋白分子的空间结构被破坏,大分子的蛋白骨链断开,形成小分子的蛋白,导致电泳结果上部的条带变浅,下部条带变深[18]。但随着空化射流处理时间的延长,会产生过处理效应导致蛋白分子的疏水性基团暴露,在疏水作用力的作用下蛋白亚基重新聚集。较高浓度的蛋白溶液中暴露的疏水基团更多,更易重新聚合,使得溶液中的大分子再次增多。因而导致5%浓度条件下的电泳结果在8 min开始出现上部条带(>16 kDa)变深,下部条带(<16 kDa)变浅的情况出现。而5%浓度条件下SPI的大分子亚基含量减少程度显著高于2%浓度,这可能是因为空化射流作用于高浓度的SPI溶液时,同体积空化泡内的分子碰撞机率更大,导致对蛋白的解聚作用更加明显[19]。因此,5%蛋白浓度的经空化射流处理后70~120 kDa分子量的亚基消失,20 kDa分子量的亚基增多。
2.3 溶液平均粒径分析
空化射流对2%和5%浓度大豆分离蛋白的溶液平均粒径的影响如图2所示。
由图2可知,空化射流处理对不同浓度的SPI粒径产生了显著的影响。随空化射流处理时间的延长,2%的和5%SPI浓度下的蛋白粒径都是呈现先降低后升高的趋势的,且2%、5%的SPI溶液分别在处理为8和6 min时达到最低。这可能是由于空化作用后引发的剪切力和高温高压作用将稳定蛋白分子的疏水作用力等破坏并将蛋白骨架打散[20],使得蛋白分子裂解,SPI中7S和11S组分随之出现了展开现象,从而导致蛋白聚集体更加分散,使其在空间结构上更加疏散[21],这就导致了蛋白溶液接受空化射流处理后蛋白粒径的下降。Arzeni等[22]在研究超声波处理卵清蛋白时也发现相似的现象。但是随着空化处理时间的延长,蛋白分子不断展开,导致其中的疏水性基团暴露,同时由于出现了过处理效应,产生的空化泡的振幅最大值增加,空化泡溃灭时的最高温度和最大压力逐渐减小[23],这就导致蛋白分子聚集[24-25],于是溶液的平均粒径在达到最小值后呈逐渐增大的趋势。在各处理时间内5%的蛋白溶液的平均粒径均高于2%的蛋白样品,但随空化处理时间延长,在8 min时2种浓度的溶液平均粒径差距最大,5%的蛋白溶液比2%的蛋白溶液高了53.79%,这是因为空化射流处理过程中会破坏疏水作用力,使得蛋白分子中的疏水基团暴露,而5%的蛋白样品中暴露的疏水基团要高于2%的蛋白,因此在过处理以后5%浓度的蛋白样品中疏水性基团间的碰撞概率更高,进而导致会形成更多微小的聚集体,使溶液的平均粒径增加得更快。
2.4 乳液ζ-电位分析
空化射流对2%和5%浓度大豆分离蛋白的乳液ζ-电位的影响如图3所示。
ζ-电位可以表征乳液体系的稳定性,其绝对值的高低和体系的稳定性呈正比。由图3可知,随空化射流处理时间的延长,2%和5%的SPI下的ζ-电位的变化趋势都是先下降后增长的,且5%浓度下的ζ-电位一直低于2%浓度。2%浓度的SPI在8 min时达到最低值-14.11 mV;5%浓度的SPI在6 min时达到最低值-17.67 mV。这可能是因为空化射流物理场能通过场能导致蛋白结构发生舒展,蛋白亚基展开,形成更多的无规则卷曲结构,进而暴露出更多的带负电荷的氨基酸残基,导致蛋白分子表面的电荷量增多,ζ-电位绝对值升高[24-26]。同时由于5%浓度的SPI溶液接受空化处理时含有的SPI分子较多,分子间碰撞更强,氨基酸残基暴露更多[27],所以5%浓度下处理的SPI的ζ-电位一直较低。随着空化射流处理时间达到了一定的限度后,乳液中的蛋白分子因过处理现象又重新聚合,形成一些大的聚集体,这导致一些原本暴露于分子表面带负电荷的氨基酸残基被重新包埋,导致乳液的ζ-电位开始出现增加的趋势。这和平均粒径结果相一致。
2.5 界面蛋白含量分析
空化射流对2%和5%浓度大豆分离蛋白的界面蛋白含量的影响如图4所示。
在乳化体系中,油水界面处吸附的蛋白质量是衡量界面活性一个重要指标,它通过影响界面蛋白膜的覆盖率和厚度来影响乳液的稳定性[28],界面蛋白吸附量主要受蛋白扩散能力的影响。由图4可知,空化射流处理对不同浓度的SPI的界面蛋白含量产生了显著的影响。随空化射流处理时间的延长,2%和5%的SPI浓度下的界面蛋白含量均呈现先上升后下降的趋势,且均明显高于未处理的SPI乳液界面蛋白含量。这表明空化射流处理可以显著地增加SPI中的界面蛋白含量,但与蛋白浓度和空化射流处理时间有关。蛋白质在油水界面的吸附具有浓度依赖性,即蛋白质浓度越高,吸附量越大[29-30]。所以可以看到,未经处理时5%的SPI浓度相比于2%SPI浓度的界面蛋白含量就更大。随着空化射流处理时间的延长,2%和5%浓度的蛋白乳液的界面蛋白浓度不断上升。这可能是因为空化射流处理使得亚基与亚基之间形成交联结构,改变了SPI的结构,暴露了更多的疏水基团[27],进而提高了SPI的表面疏水性,使吸附蛋白间的疏水作用力增加,可以促进蛋白与界面的接触[31],同时因为空化泡溃灭时产生的高温而导致了乳液油滴界面蛋白浓度的增加[12],这会导致界面蛋白膜的厚度增大,有利于乳液中网络结构的形成。但是当处理时间到达6 min时,5%浓度的蛋白乳液的界面蛋白浓度达到最大值3.23 mg/m2;2%浓度的蛋白乳液的界面蛋白浓度则在8 min时达到最大值3.19 mg/m2。进一步延长处理时间时,界面蛋白浓度出现轻微下降。这可能与以下2个原因有关,一是界面吸附量越大,蛋白在界面上进行结构展开的空间越小,结合新蛋白的机会就越小[32];二是乳液中蛋白聚集体的存在可能会通过位阻效应使吸附在界面处的蛋白浓度降低[33]。电位大小主要取决于液滴界面物质所带电荷的多少,而SPI在其乳液体系中均充当乳化剂的作用,经剪切乳化和高压均质后吸附于液滴表面,是主要的界面物质,因此2种不同浓度的乳液体系的电位也会受其界面蛋白含量影响,界面蛋白含量越多,乳液电位的绝对值越大[34]。
2.6 乳液粒径分布分析
空化射流对2%和5%浓度大豆分离蛋白的乳液粒径分布的影响如图5所示。
乳液粒径是衡量乳液稳定性的重要指标,液滴粒径越小,乳析速度越慢,乳液就越稳定[35],同时SPI乳液的粒径分布还能体现乳液中的蛋白聚集过程。由图5可知,2种蛋白浓度下未经处理的SPI粒径分布都在10~100μm处有主峰,100~1 000μm处有小峰。经空化射流处理后,其粒径分布发生变化,100~1 000μm处的小峰消失并在0~10μm处新出现小峰,同时粒径分布更加集中。这是因为空化射流处理产生的空化效应如剪切力、冲击波和微射流等作用,破坏了蛋白质分子间的作用力,使得蛋白质分子展开,使蛋白中大分子的聚集体解离成小分子,打散了溶液中较大的聚集体[36],这与聚丙烯酰胺电泳显示的结果相对应。粒径分布越集中,乳化稳定性越强[37],这也与前文中ζ-电位和后文中的乳化稳定性结论相对应。此外,随处理时间延长,2%蛋白浓度的SPI乳液粒径明显降低,体积平均粒径D4,3从50.12μm减小至31.50μm,而5%蛋白浓度的SPI乳液粒径呈现先下降然后在6 min后增加的趋势。乳液粒径的下降可能是因为空化射流处理产生的空化效应破坏了蛋白分子间的相互作用,使聚集体解离引起的[38-39],这与李杨等[40]研究结论相同。但是空化效应的过处理现象也会引发蛋白质分子的聚集,而使其平均粒径增加,这就是为何6 min后5%浓度的SPI乳液粒径呈现上升趋势。
2.7 乳液流变学分析
空化射流对2%和5%浓度大豆分离蛋白的乳液流变性质的影响如图6所示。
弹性模量(G′)表示待测样品在受外力而发生弹性形变过程中所蓄积的能量,是衡量待测样品黏弹性的一种尺度[41]。图6为2%和5%浓度的SPI分散液及其经受不同空化射流处理时间后的弹性模量(G′)在加热、保温及冷却过程中随时间变化的弹性模量。
由图6可知,不同空化射流时间下的SPI乳液的弹性模量总体变化趋势相同,都是呈现逐步上升且上升越来越快的趋势。在初始阶段,SPI乳液的弹性模量随时间变化非常缓慢。这是因为此时维持SPI乳液中蛋白结构的力还较弱,如氢键等[42]。随着温度的升高,样品开始发生部分变性,蛋白质分子逐步解折叠,暴露分子内部的疏水性残基,分子间疏水作用力增强,静电斥力较弱,所以此时的弹性模量升高不明显。在保温过程中,弹性模量开始逐渐升高,这表明,随着温度升高,有更多的蛋白和被蛋白包裹的油滴进入乳液网络结构中[43]且SPI分子内部肽链展开[44-45],蛋白质完全变性。在降温过程中,样品弹性模量持续上升,此时蛋白质分子间的氢键、二硫键等作用力大于疏水作用力,使展开的肽链发生交联形成类似于凝胶网络状的结构,蛋白质的骨链增大导致其粒径增大。冷却至约70 ℃,SPI乳液的弹性模量显著递增,说明此时乳液中可能开始形成凝胶。即未经处理的SPI表现出更具黏性的流体性质,而经过空化射流处理的SPI表现出更具弹性的类固体性质。同时我们可以看出,弹性模量的变化还与ESI、EAI呈现显著的正相关[46]。
同时我们还可以从图中看出,接受不同空化射流处理时间的2%和5%浓度SPI乳液在同一时间的弹性模量均呈现高于未经空化射流处理的特征,且均呈现随空化射流处理时间的增加而先上升后下降的趋势,2%浓度在8 min达到最大值,5%浓度在6 min达到最大值。这一变化趋势符合我们在其他指标中看到的变化规律。空化射流处理初期,SPI乳液的弹性模量随处理时间延长而逐渐增加,这可能是因为初始的空化作用较弱,分子间的交联能力较差,随着时间的延长,蛋白质结构发生改变,分子间交联能力逐渐增强,导致弹性模量增加。而随着空化处理时间的进一步延长弹性模量开始出现降低的趋势,这主要是由于当空化射流作用达到饱和后,过高的空化压力和时间导致其结构发生改变,形成少量不溶性聚集体,降低了蛋白质分子之间的交联,导致了弹性模量的降低。还有一部分原因是由于过处理也会导致蛋白质中的7S组分增多,7S组分为球状蛋白质,吸附至界面展开所需的能量较大,所以吸附速度较慢[47],导致出现先增加后下降的趋势出现。同时Baldursdottir等[48]指出,球状蛋白质会在界面处展开和结构重排。而G′的增加有可能是界面处的蛋白质分子通过疏水相互作用建立网络结构,也可能是多层吸附结构的形成[49]。此外,据报道,蛋白质分子间相互作用和交联是在部分展开时建立的,这也会导致G′增加[50]。
2.8 乳化活性及乳化稳定性分析
空化射流对2%和5%浓度大豆分离蛋白的乳化活性及乳化稳定性的影响如图7所示。
由图7可知,SPI样品的乳化活性及乳化稳定性受到了空化射流处理的影响,产生了显著的变化(P<0.05)。其中2%浓度的SPI样品的乳化活性及乳化稳定性的变化呈现先升高后降低的趋势,在处理8 min时分别达到71.01 m2/g和168.75 min,较最低值分别提升248.94%和95.58%;5%浓度的SPI样品的乳化活性及乳化稳定性随空化处理时间增加而呈现先升高再降低而后又升高的规律,虽然中间出现了一定的波动,但是整体呈上升趋势,在处理10 min时分别达到52.91 m2/g和126.97 min,较最低值分别提升70.29%和101.83%。
浓度为2%的蛋白样品乳化活性及乳化稳定性一开始呈现增加的趋势,这是因为空化射流处理后样品中的亚基解聚,蛋白质分子伸展,分子内部基团暴露,蛋白质分子趋于无序,刚性结构减弱柔性结构增加,同时由于11S组分展开,形成了更多的无规则卷曲结构分散到油-水界面因此使得样品的乳化活性有显著提高[14]。而在空化处理后期,蛋白样品的乳化活性和乳化稳定性均有下降,这可能是因为在空化处理后期,在过高的压力和高速冲击波作用下,分子间疏水相互作用、二硫键、静电相互作用及氢键等作用力会使其发生聚集产生不溶性聚集体,导致乳化活性降低。同时,在高速剪切机械作用与热效应的双重影响下,蛋白质发生变性,也会导致其乳化活性下降。乳化稳定性的下降则是因为空化处理后期使解聚的亚基以及小分子蛋白发生了聚集,而聚集后构象稳定性增强,不易快速在油-水界面上稳定,导致乳化稳定性降低[51]。
5%浓度的SPI的乳化活性及乳化稳定性随空化射流时间的变化,可能是由于空化射流处理初期,空化腔内的局部极端热导致SPI先发生聚集,随后在空化效应和高速机械剪切作用下蛋白质分子逐渐伸展,聚集体发生解聚,分子内部基团暴露,在乳化过程中有更多的小分子聚集在油水界面上,因此使得样品的乳化活性呈现出先升高再降低而后又升高的规律[14]。而经空化射流处理后乳化稳定性的明显增加可能是因为随着空化射流时间的延长,空化效应和剪切效应使得蛋白质分子中的疏水性基团逐渐暴露出来,导致蛋白液滴的比表面积增加,加强了蛋白质分子与油滴间的吸引作用,使蛋白质分子的体积减小,降低了分子的沉降速率,从而增加了蛋白溶液的乳化稳定性[52]。
当乳化活性增加时,意味着乳化体系中粒子间的作用较强,发生了一定的交联作用[53],这也导致了流变学测定时发现SPI体系中是弹性成分占较大优势。同时可以看出,2%浓度的SPI的乳化活性在各个时间点都是高于5%浓度的。这是因为在低蛋白浓度的情况下,空化作用会破坏SPI结构,致使蛋白中的亲水基团愈发亲水,疏水基团愈发疏水,从而使得乳状液的稳定性有所增加;当蛋白浓度增大时,空化作用对SPI分子结构的作用会变小,导致SPI的乳化活性也逐渐减小[54]。
3 结 论
1)空化射流处理2%浓度SPI能有效提高其乳化活性及乳化稳定性。当处理时间为8 min时,乳化活性为71.01 m2/g,乳化稳定性为168.75 min,较最低值分别提升248.94%和95.58%。同时ζ电位绝对值达到最大值为-14.11 mV,界面蛋白含量达到最大值为3.19 mg/m2,且粒径最小。说明此时大豆分离蛋白分布均匀,最为稳定,有利于提高其乳化活性。
2)5%浓度SPI空化射流处理10 min时,乳化活性为52.91 m2/g,乳化稳定性为126.97 min,较最低值分别提升70.29%和101.83%。但ζ-电位绝对值、界面蛋白含量已经呈现下降趋势。说明此时大豆分离蛋白虽然乳化性能还维持在较好水平,但是已经出现过处理现象。
3)空化射流处理2种浓度的大豆分离蛋白都可以使部分亚基解聚,降低含硫氨基酸的含量。同时空化效应使蛋白质分子展开,暴露更多的疏水性氨基酸,提高其流变性能。且SPI浓度为5%时各项指标相比2%时都更易达到极值。
本研究对大豆工业化利用及提升大豆蛋白加工技术具有重要的理论及实践价值,而且对研发新型大豆蛋白饮料、蛋白生物凝胶等具有重要的科学意义。
