大黄素对自身免疫性甲状腺炎小鼠的作用机制研究*
2021-04-14张国平李攀胡通海吴可人
张国平,李攀,胡通海,吴可人
(1.嵊州市中医院 外二科,浙江 嵊州312400;2.浙江中医药大学附属第一医院肝胆外科,浙江 杭州310000)
自身免疫性甲状腺炎(autoimmune thyroiditis,AT)主要是由免疫功能紊乱、环境及遗传等因素综合作用导致的自身免疫性疾病,是细胞免疫与体液免疫共同作用的结果[1-3]。AT 发病率不断上升,严重影响人们生活质量[4-5]。近年来,临床上针对AT 主要采用免疫抑制剂、糖皮质激素等治疗,但其效果并不十分理想,且对机体免疫功能造成较大损害[6]。而大黄素属一种蒽醌类衍生物,具有一定的免疫抑制作用。因此,本文研究旨在探讨大黄素治疗AT 小鼠的作用机制。
1 材料与方法
1.1 实验动物
60 只SPF 级昆明小鼠,雌性,适应性饲养1 周,湿度(55±10)%,温度(23±2)℃,自由饮食,购自辽宁实验动物中心,动物生产许可证号:SCXK2017-0001,动物使用许可证号:SCXK2017-0008。
1.2 主要试剂和仪器
大黄素(南京景竹生物科技有限公司,纯度98%),小鼠甲状腺球蛋白抗体(thyroglobulin antibody, TGAb) 和甲状腺过氧化物酶自身抗体(thyroid peroxidase autoantibody, TPOAb)酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)试剂盒(上海广锐生物科技有限公司)。Bio-Rad酶标仪(美国伯乐公司),流式细胞仪(美国BD公司)。
1.3 动物模型的复制与分组
1.3.1 模型复制取10 mg 猪甲状腺球蛋白溶于5 ml 水,将其与完全弗氏佐剂等体积充分混合制成油包水乳剂。取小鼠甲状腺球蛋白0.5 ml,均匀分布于腹部、背部2 点皮下注射,初次免疫为每个点注射0.25 ml,14 d 后取甲状腺球蛋白与不完全弗氏佐剂等体积混合,再多点皮下注射,持续4 周。
1.3.2 分组60 只小鼠随机分为正常组、模型组和实验组,每组20 只。实验组给予75 mg/kg 大黄素灌胃,1 次/d,持续8 周;对照组和模型组灌胃等剂量生理盐水,1 次/d,持续8 周。
1.4 方法
1.4.1 甲状腺组织形态观察取小鼠甲状腺组织,以生理盐水清洗,在10%中性甲醛溶液中固定,石蜡包埋,连续切片,行常规HE 染色,在显微镜下观察淋巴细胞浸润情况。
1.4.2 血清TGAb 和TPOAb 水平检测各组小鼠摘眼球取血0.3 ml,静置15 min,2 500 r/min 离心12 min,离心半径15 cm,取上清液,采用ELISA测定TGAb 和TPOAb 水平,严格依据试剂盒说明书进行操作。
1.4.3 甲状腺淋巴细胞浸润程度评价甲状腺淋巴浸润程度=滤泡间浸润程度+上皮间淋巴浸润程度。滤泡间浸润程度评价:(-)为0 分;(±)为1 分;(+)为2 分;(++)为3 分;(+++)为4 分。上皮间浸润程度:0 个炎细胞/张切片为0 分;1 或2 个炎症细胞/张切片为1 分;1 个炎细胞/10 个高倍视野为2 分;1 个炎细胞/5 高倍视野为3 分;1 个炎细胞/2 高倍视野为4 分。
1.4.4 外周血T淋巴细胞亚群检测各组小鼠摘眼球取血0.3 ml,肝素抗凝,制备成1×107个/ml 单细胞悬液,加入抗体,避光染色30 min,加入溶血素反应10 min,2 500 r/min离心6 min,离心半径15 cm,弃上清液,加入PBS 溶液洗涤2 次,加入1%多聚甲醛固定,采用流式细胞术测定T 淋巴细胞亚群变化。
1.5 统计学方法
数据分析采用SPSS 19.0 统计学软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析,进一步两两比较用LSD-t检验,P <0.05为差异有统计学意义。
2 结果
2.1 各组小鼠甲状腺组织形态变化
正常组小鼠光镜下甲状腺滤泡呈椭圆形或者圆形,滤泡腔内充满淡红色胶质,同时内有适量吸收空泡;甲状腺肉眼观为细条状、淡红色。模型组小鼠光镜下可见甲状腺组织中有弥漫性或灶性淋巴细胞浸润,并伴甲状腺滤泡萎缩;甲状腺滤泡上皮较正常略大,滤泡腔变小;甲状腺肉眼可见颜色变谈,并且与周围组织不粘连。实验组小鼠病变程度较模型组明显减轻。见图1。
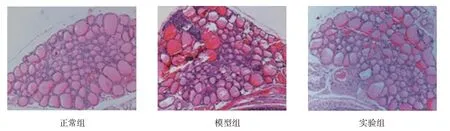
图1 各组小鼠甲状腺病理形态学观察 (HE染色×200)
2.2 各组小鼠血清TGAb和TPOAb水平比较
正常组、模型组和实验组小鼠血清TGAb 和TPOAb 水平比较,经单因素方差分析,差异有统计学意义(P <0.05)。进一步两两比较结果显示:正常组低于实验组和模型组(P <0.05);实验组低于模型组(P <0.05)。见表1。
表1 各组小鼠血清TGAb和TPOAb水平比较(n=20,mIU/L,±s)
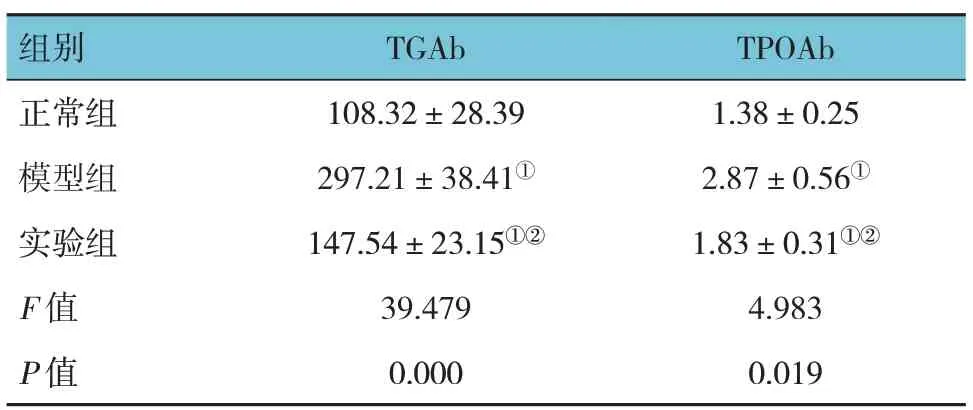
表1 各组小鼠血清TGAb和TPOAb水平比较(n=20,mIU/L,±s)
注:①与正常组比较,P <0.05;②与模型组比较,P <0.05。
组别TPOAb TGAb正常组模型组实验组F 值P 值1.38±0.25 2.87±0.56①1.83±0.31①②4.983 0.019 108.32±28.39 297.21±38.41①147.54±23.15①②39.479 0.000
2.3 各组小鼠淋巴细胞浸润程度比较
正常组、模型组和实验组小鼠淋巴细胞浸润程度分别为(0.28±0.05) 分、(3.97±0.78) 分和(1.83±0.41)分,经单因素方差分析,差异有统计学意义(F=6.521,P=0.002)。进一步两两比较结果显示:正常组低于实验组和模型组(P <0.05);实验组低于模型组(P <0.05)。
2.4 各组小鼠外周血T淋巴细胞亚群变化
正常组、模型组和实验组小鼠CD3+CD4+和CD3+CD8+比较,经单因素方差分析,差异有统计学意义(P <0.05)。进一步两两比较结果显示:正常组低于实验组和模型组(P <0.05);实验组低于模型组(P <0.05)。见表2。
表2 各组小鼠外周血T淋巴细胞亚群比较(n=20,%,±s)
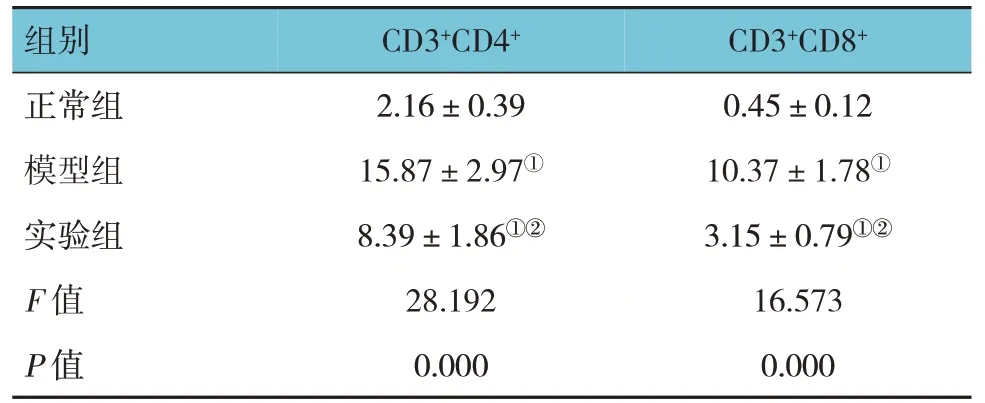
表2 各组小鼠外周血T淋巴细胞亚群比较(n=20,%,±s)
注:①与正常组比较,P <0.05;②与模型组比较,P <0.05。
组别CD3+CD8+CD3+CD4+正常组模型组实验组F 值P 值0.45±0.12 10.37±1.78①3.15±0.79①②16.573 0.000 2.16±0.39 15.87±2.97①8.39±1.86①②28.192 0.000
3 讨论
AT 主要包括特发性粘液性水肿、Hashimoto's甲状腺炎及Grave's 病等,其中Hashimoto's 甲状腺炎即慢性淋巴细胞性甲状腺炎[7-14]。AT 主要是由于机体对甲状腺产生了体液免疫和细胞免疫反应,造成甲状腺功能紊乱[15-20]。目前,临床上针对AT 患者主要采用西医治疗,但其效果并不十分理想,且会导致患者免疫功能下降。近年来,随着中医药的不断深入研究,其应用于AT 患者获得良好疗效,且可增强机体免疫功能[20]。
大黄素属一种蒽醌类衍生物,具有清热解毒功效。药理研究表明,大黄素具有抑制胰酶活性、免疫调节、抗氧化、改善微循环、保护肝肾、抑菌、抗炎及清除自由基等作用。研究报道显示,大黄素主要经调节T 淋巴细胞亚群间的分化、平衡及其分泌能力,进一步发挥免疫保护作用[21]。本研究结果发现,与模型组比较,实验组淋巴细胞浸润程度减轻,由此可见大黄素可减轻甲状腺组织淋巴细胞浸润程度。TGAb 和TPOAb 是AT 的特征性自身抗体,通常AT 患者表现为血清TGAb和TPOAb 水平升高,并且两者在患者血清中表达是临床诊断AT 的重要指标。本研究结果发现,与模型组相比,实验组血清TGAb 和TPOAb 水平降低,由此可见大黄素可降低血清TGAb 和TPOAb水平。
CD4+与CD8+T 细胞是人体免疫系统中重要的免疫细胞,其中CD4+主要表达于辅助T 细胞,并且是Th 细胞TCR 识别抗原的共受体,同时与MHC Ⅱ类分子的非多肽区结合,从而参与Th 细胞TCR 识别抗原的信号转导[22-23];其中CD8+主要表达于细胞毒性T 细胞上,并且通过表面的MHC Ⅰ类分子与CD4 等其他免疫细胞的MHC Ⅱ类分子结合,识别其他免疫细胞表面结合的抗原物质[24-25]。本研究结果发现,与模型组相比,实验组CD3+、CD4+和CD4+CD8+水平下降,由此可见大黄素可调节免疫平衡。
综上所述,大黄素可下调AT 小鼠血清TGAb和TPOAb,减轻淋巴细胞浸润程度,调节小鼠免疫功能。
