美罗培南持续泵入治疗ICU老年脓毒血症患者的机制探讨
2021-04-13安阳童朝辉张睢扬王磊谢建新张旭燃
安阳 童朝辉 张睢扬 王磊 谢建新 张旭燃
1河北燕达医院呼吸与危重症医学科(河北廊坊065201);2首都医科大学附属朝阳医院呼吸与危重症医学科(北京100024);3火箭军总医院呼吸与危重症医学科(北京100035);4河北燕达陆道培医院临床药理室(河北廊坊065201)
脓毒血症是由感染、创伤等引起的全身炎症性反应,能够导致组织器官损伤的综合征[1]。重症监护病房(intensive care unit,ICU)是为重症或昏迷患者提供护理及针对性的监测[2]。脓毒血症是引起ICU 老年患者死亡的重要原因[3]。脓毒血症患者的病理生理变化,可使药代动力学(pharmacokinetics,PK)和药物效应动力学(pharmacodynamics,PD)发生改变,使得抗生素在体内的分布、代谢和排泄发生改变[4],进而影响抗生素治疗效果,增加病死率[5]。2016年生存脓毒症运动(SSC)指南强调,抗生素方案应根据PK∕PD 原则进行优化[6]。最新研究中利奈唑胺、阿米卡星或庆大霉素等药物治疗脓毒症疗效的目标药代动力学∕药效学(PK∕PD)指标已有相关临床研究[7-8]。而新型碳青霉烯抗生素美罗培南持续泵入对脓毒血症患者PK∕PD 研究较少,因此,本研究选取60 例ICU 老年脓毒血症患者作为研究对象,旨在探讨PK∕PD 理论下美罗培南治疗ICU 老年脓毒血症患者的临床疗效,为制定更合理的给药方案,最大程度发挥美罗培南的药效提供参考。
1 资料与方法
1.1 一般资料选取2019年1月至2020年3月我院收诊的60 例ICU 老年脓毒血症患者作为研究对象,其中男38例,女22例,年龄65 ~81岁,平均年龄(70.23±3.59)岁。采取随机数字表法分为两组,分别为治疗药物监测(TDM)组和对照组。TDM 组男18 例,女12 例,平均年龄(70.27 ± 3.09)岁,BMI(22.45 ± 1.12)kg∕m2,革兰阴性菌19 例,革兰阴性菌11 例,合并基础疾病13 例,感染部位:肺部感染16例、泌尿生殖系统感染6例、腹部感染5例,其他3例;TDM 组男20 例,女10 例,平均年龄(70.54 ±3.23)岁,BMI(22.58 ± 1.06)kg∕m2,革兰阴性菌18例,革兰阴性菌12 例,合并基础疾病14 例,感染部位:肺部感染17 例、泌尿生殖系统感染5 例、腹部感染6 例,其他2 例;两组基线资料比较,差异无统计学意义(P>0.05)。
1.2 纳入标准和排除标准纳入标准:(1)符合《2012 国际严重脓毒症及脓毒性休克诊疗指南》中脓毒血症诊断标准[9],为重症ICU 患者;(2)年龄≥65 岁且≤81 岁;(3)临床一般资料完整;(4)患者及患者家属自愿签署知情同意书。排除标准:(1)多重耐药菌感染者;(2)对美罗培南耐药者;(3)伴有自身免疫系统疾病者或严重糖尿病、高血压患者;(4)严重认知障碍、精神疾病者;(5)严重传染性疾病患者。
1.3 治疗方法采用美罗培南1 g,每8 h 给药一次,首剂以0.9%氯化钠注射液100 mL 将1.0 g 美罗培南(批准文号:H20090959,生产厂家:海正辉瑞制药有限公司)充分溶解后,以200 mL∕h输注,后采用0.9%氯化钠注射液100 mL 将1.0 g 美罗培南,充分溶解后,以33.3 mL∕h,3 h 延长滴注,监测血药浓度。其中TDM 组根据以下3 点调整美罗培南剂量:(1)当40%fT >4 ~8 MIC 维持原有剂量不变;(2)当40%fT >8 MIC,将原有剂量减少25%~50%;(3)当40%fT <4 MIC 将原有剂量增加25%~50%;对照组不进行剂量调整。7 d 为一个疗程。
1.4 观察指标
1.4.1 临床指标记录两组白细胞计数、体温、机械通气时间、ICU 停留时间,比较两组患者临床指标。白细胞计数检测方法:治疗前一天及治疗后第3 天,清晨空腹,采集静脉血3 mL,采用全自动血液分析仪及其配套试剂(型号:XE-5000,日本Sysemx 公司),检测白细胞计数;免疫比浊法检测CRP,采用全自动生化分析仪及配套试剂盒(BS-480;迈瑞生物医疗(深圳);电化学发光法检测PCT,试剂盒及配套试剂(明德生物科技股份有限公司(武汉)。
1.4.2 治疗效果评判标准[10]显效:临床症状及体征消失,白细胞计数恢复正常;有效:临床症状、体征、白细胞计数,仅1 项未达标;无效:临床症状、体征、白细胞计数,两项或两项以上,未达标;治愈率=[(显效+有效)例数]∕总例数×100%;比较两组临床治疗效果。
1.4.3 微生物治愈率治疗前一天、治疗后第3天,采集患者血液标本5 mL,进行病原菌培养。血培养标准为双套四管,两组厌氧菌、两组需氧菌,每管血20 mL 左右,同时记录痰培养结果。按照全国临床检验操作规程中的要求接种、培养、计数。完全清除:病原菌消失,无新的出现;部分清除:病原菌含量下降;未清除:无变化甚至出现新的病原菌;微生物治愈率=[(完全清除+部分清除)例数]∕总例数×100%;比较两组患者微生物治愈率。
1.4.4 不良副作用和病死率观察并比较两组患者不良副作用发生率及病死率。
1.4.5 PK、PD 测定检测用药前,用药8、16、24、32、40、48、56、72 h 的血药浓度,采集血液标本3 mL,于肝素抗凝管中,以13 000 r∕min 离心半径为8.4 cm 离心10 min,取血浆200 μL,测定血药浓度。血药浓度采用高效液相色谱法测定,1260 高效液相色谱仪(美国Agilent 公司)。将已获得的数据采用WinNonlin 5.2 软件计算PK 参数;使用蒙特卡洛模拟软件Crystal Ball 7.2.3 计算达到PK∕PD 目标的达标率。
1.5 统计学方法应用SPSS 21.0 软件分析处理统计学数据。计量资料以均数±标准差表示,符合正态分布,行t检验;计数资料,用例(%)表示,以χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 两组临床指标比较TDM组白细胞计数、CRP、PCT、机械通气时间、ICU 停留时间均显著低于对照组,差异有统计学意义(P<0.05);TDM 组体温低于对照组,但差异无统计学意义(P>0.05)。见表1。
表1 两组临床指标比较Tab.1 Comparison of clinical indicators between the two groups ±s
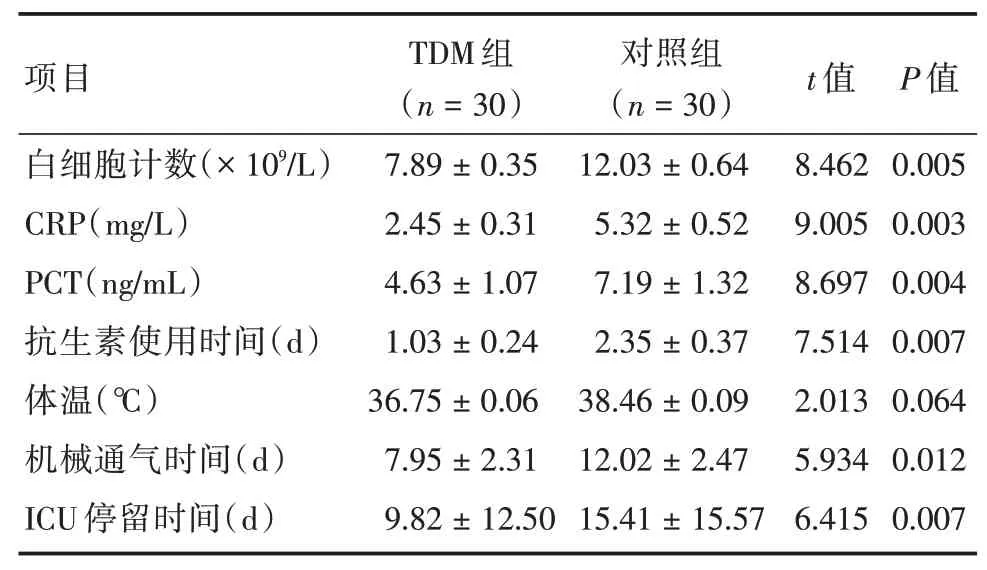
表1 两组临床指标比较Tab.1 Comparison of clinical indicators between the two groups ±s
项目白细胞计数(×109∕L)CRP(mg∕L)PCT(ng∕mL)抗生素使用时间(d)体温(℃)机械通气时间(d)ICU 停留时间(d)TDM 组(n=30)7.89±0.35 2.45±0.31 4.63±1.07 1.03±0.24 36.75±0.06 7.95±2.31 9.82±12.50对照组(n=30)12.03±0.64 5.32±0.52 7.19±1.32 2.35±0.37 38.46±0.09 12.02±2.47 15.41±15.57 t 值8.462 9.005 8.697 7.514 2.013 5.934 6.415 P 值0.005 0.003 0.004 0.007 0.064 0.012 0.007
2.2 两组治疗效果比较TDM 组临床治愈率比对照组高,差异有统计学意义(P<0.05)。见表2。
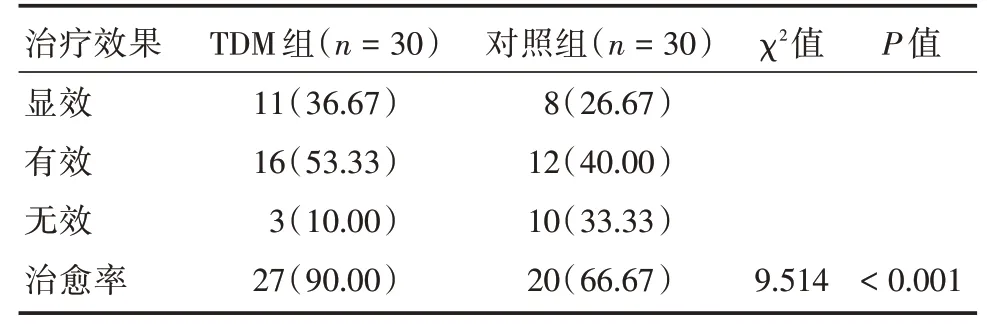
表2 两组治疗效果比较Tab.2 Comparison of treatment effects between the two groups例(%)
2.3 两组微生物治愈率比较两组患者共检出革兰阳性菌15 株,常见为金黄色葡萄球菌7 株;革兰阴性菌40 株,常见为肺炎克雷伯杆菌8 株,铜绿假单胞菌16 株;真菌5 株。TDM 组与对照组病原菌比较,差异无统计学意义(P>0.05)。与对照组比,TDM 组微生物治愈率更高,差异有统计学意义(P<0.05)。见表3。
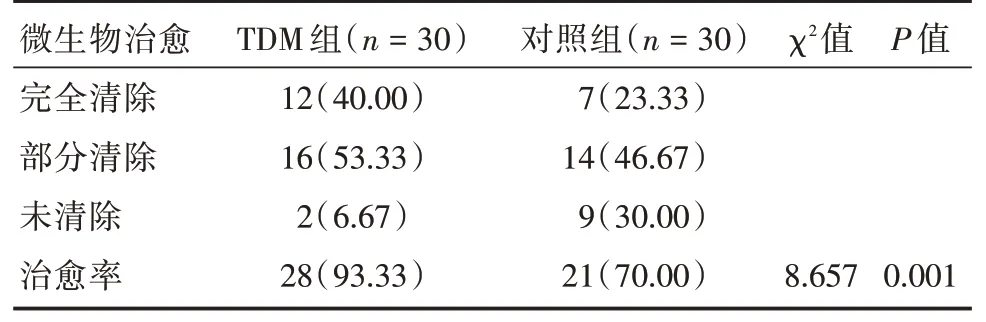
表3 两组微生物治愈率比较Tab.3 Comparison of microbial cure rates between the two groups 例(%)
2.4 两组不良副作用发生率及病死率比较与对照组比,TDM 组不良副作用发生率及病死率较低,差异有统计学意义(P<0.05)。见表4。
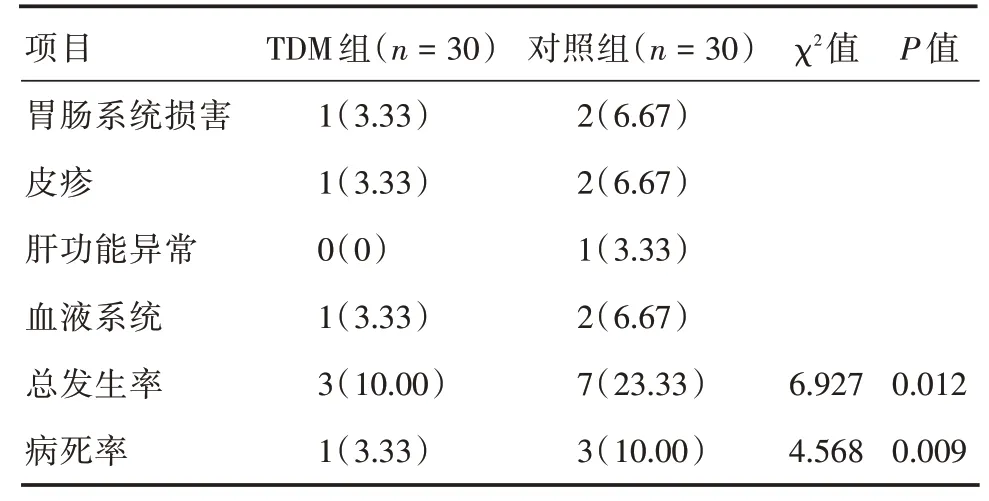
表4 两组不良副作用发生率及病死率比较Tab.4 Comparison of the incidence and case fatality of adverse side effects between the two groups 例(%)
2.5 两组PK、PD参数分析TDM组调整前PK、PD参数与对照组比较差异无统计学意义(P>0.05)。TDM 组调整后PK、PD 参数显著优于对照组,差异有统计学意义(P<0.05)。见表5。
2.6 两组实现PK/PD 目标比较TDM 组中实现PK∕PD 目标的老年脓毒血症患者28 例,占93.33%;对照组中实现PK∕PD 目标的老年脓毒血症患者16 例,占53.33%。TDM 组实现PK∕PD 目标的老年脓毒血症患者比对照组多,差异有统计学意义(t=6.549,P=0.013)。
表5 两组PK、PD 参数分析Tab.5 Analysis of two groups of PK and PD parameters±s
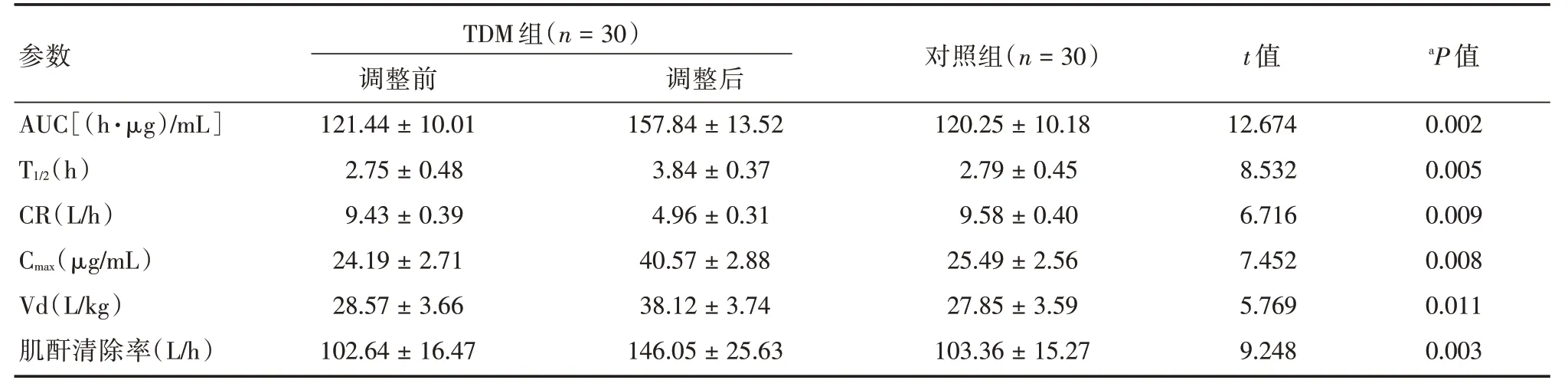
表5 两组PK、PD 参数分析Tab.5 Analysis of two groups of PK and PD parameters±s
注:a 表示,TDM 组调整后与对照组比,P <0.05
整前TDM 组(n=30)调整后 对照组(n=30)t 值aP 值4±10.01157.84±13.52120.25±10.1812.6740.002 5±0.483.84±0.372.79±0.458.5320.005 3±0.394.96±0.319.58±0.406.7160.009 9±2.7140.57±2.8825.49±2.567.4520.008参数AUC[(h·μg)∕mL]T1∕2(h)CR(L∕h)Cmax(μg∕mL)Vd(L∕kg)肌酐清除率(L∕h)调121.4 2.7 9.4 24.1 28.57±3.66 102.64±16.47 38.12±3.74 146.05±25.63 27.85±3.59 103.36±15.27 5.769 9.248 0.011 0.003
3 讨论
严重的脓毒症会导致宿主的免疫反应损害自身的组织和器官,在某些情况下会导致器官功能障碍和死亡。ICU 老年脓毒血症患者机体衰弱、免疫功能较差,感染性疾病是脓毒症常见的死亡原因[11-12]。早期抗生素治疗是决定ICU 老年脓毒血症患者转归情况的重要因素[13]。抗菌素疗效与PK∕PD 有关,一系列器官功能障碍加上药物相互作用和其他治疗干预措施可能对危重患者的抗菌药物的药代动力学产生强烈影响,PK∕PD 参数可以更准确反映抗菌药物在体内的抗菌作用的时间过程[14]。
最新研究显示,血药浓度大于最小抑菌浓度(minimal inhibitory comentration,MIC)是评价杀菌效果的药效学重要参数[15]。血药浓度大于MIC 能够提高重症感染患者临床治愈率;当血药浓度大于4 ~6 MIC 时,微生物治愈率和临床治愈率可进一步提高[16]。机体感染程度不同,美罗培南PK 参数存在一定的差异[17],实时监测患者体内血药浓度,以保证用药安全及有效性[18-19]。当PK 试验不可行时,可使用具有蒙特卡洛模拟的PK∕PD 分析,以开发最佳药物剂量[20]。美罗培南是碳青霉烯类药物,抗菌谱广,对革兰阳、阴性菌以及多重耐药革兰阴性菌的抗菌活性显著[20-22]。当该药物的血药浓度高于病原菌的MIC 时发挥抗菌效果[23]。如何应用PK∕PD 原理合理化使用美罗培南对临床研究有重要意义。多数研究显示,美罗培南微量持续泵入治疗脓毒血症的效果优于静脉滴注,延长输注比间歇性推注具有更高的临床改善率和更低的病死率,改善患者生存状态[24]。
本研究中,TDM 组白细胞计数、CRP、PCT、机械通气时间、ICU 停留时间均显著低于对照组,临床治愈率、微生物治愈率显著高于对照组,不良副作用发生率及病死率均显著低于对照组。本研究结果说明根据PKPD 理论制定给药方案,可以提高病原菌清除率、临床治疗效果和防止细菌耐药产生。美罗培南持续泵入,使得血药浓度达峰时间缩短,能够快速发挥抗菌效果,生物利用度高,经尿液排出,无蓄积,减少相关不良反应发生。由于老年患者多存在肝、肾功能减退,导致药物半衰期延长,毒副作用增加,因此本研究根据40%T 与4MIC 之间的变化,不断改变美罗培南持续泵入的剂量,有利于维持最佳治疗效果。以上研究表明,在临床治疗时,严密监护老年患者的血药浓度及药物效应,对优化美罗培南的给药方案,提高药效,减少毒副反应有重要价值。
综上所述,利用TDM 可优化美罗培南治疗ICU 老年患者脓毒血症的临床疗效,降低病死率、实现PK∕PD 目标,提高临床治愈率和微生物治愈率。
