MALAT1通过miR-30调控骨巨细胞瘤基质细胞生长、迁移和侵袭
2021-04-13薛伟康少英郭洪生王培霞王振兴高庆亮李岩张英民王华军郑小飞
薛伟 康少英 郭洪生 王培霞 王振兴 高庆亮 李岩 张英民 王华军 郑小飞
1邯郸市中心医院骨三科(河北邯郸056001);2暨南大学第一临床医学院,暨南大学附属第一医院骨关节与运动医学中心(广州510630)
骨巨细胞瘤(giant cell tumor of bone,GCTB)是原发骨肿瘤,临床上较为常见,约占全部骨肿瘤的6%[1]。多见于20~40 岁青年人群,好发于四肢长骨[2]。骨巨细胞瘤具有极强的侵袭能力,产生严重的溶骨性骨破坏[3]。溶骨性骨破坏引起严重骨痛并可导致病理性骨折,严重影响患者生存质量[4]。基质细胞(spindle-like stromal cells of GCTB,GCGSC)被认为是骨巨细胞瘤中唯一具有无限增殖能力的肿瘤成分细胞,在溶骨性骨破坏和肿瘤异常增殖过程中起关键作用[5]。长链非编码RNA(LncRNA)不仅在多种肿瘤中发挥重要作用[6],而且对骨生长、分化等功能也有调节作用[7]。研究表明LncRNA MALAT1 通过多种信号通路调节骨肉瘤发生发展[8-11],可能是骨肉瘤的治疗靶点之一[12]。然而MALAT1 对于骨巨细胞瘤的调控作用未知。另一方面,MALAT1 作为miRNA(微小核糖核酸)海绵(microRNA sponge),竞争miRNAs 结合区域,使得miRNA 无法与下游靶基因结合,从而抑制miRNA 的功能,影响蛋白质编码转录[13]。因此,阐明MALAT1 对骨巨细胞瘤的作用,明确其海绵的靶miRNA,可以为临床治疗骨巨细胞瘤提供理论基础和治疗靶点,具有重要意义。
1 材料与方法
1.1 标本来源选取2017年1月到2019年6月在邯郸市中心医院就诊的3 例骨巨细胞瘤患者术后样本,均经病理切片确诊,并取同一患者未有肿瘤侵袭的松质骨组织(癌旁组织)作为对照样本。取样符合本单位的伦理学标准并得到了批准,且取样获得患者或家属的知情同意。
1.2 体外培养原代骨巨细胞瘤细胞系取骨巨细胞瘤肿瘤组织,PBS 冲洗后剪碎,置于含20%胎牛血清的高糖DMEM 培养基,置于37 ℃、5%CO2培养箱中培养。24 h 后半量换液,观察细胞生长状况。细胞经过8 次传代后可获得纯度较大的基质细胞[14],冻存一批备用(Stromal cells,图1)。建系成功后的骨巨细胞瘤细胞培养于96 孔板,6 孔板进行相应转染实验。
图1 体外培养的骨巨细胞瘤基质细胞典型形态(200×)Fig.1 Presentative images of cultured stromal cells of giant cell tumor of bone(200×)
1.3 MTT 检测细胞增殖复苏培养骨巨细胞瘤基质细胞以5 × 105∕mL 的密度接种于96 孔板。细胞转染后,置于37 ℃、5% CO2培养箱中培养48 h,培养结束后每孔添加20 μL 的MTT∕PMS 混合液(购于碧云天公司),按试剂盒说明书进行相应处理,再次培养2 h,最后用酶标仪在490 nm波长下对样本进行定量检测。计算细胞增殖生长速度。
1.4 qPCR 检测lncRNA 及miRNA 水平骨巨细胞瘤组织或细胞于液氮下研磨,加入TRIZOL(购自Invitrogen)裂解细胞,按常规步骤提取总RNA。逆转录试剂盒购自TAKARA 公司(日本),按照试剂盒操作程序进行逆转录,-80 ℃保存备用。为检测lncRNA MALAT1 及miR-30 表达水平,参照文献合成对应的探针引物进行实时定量PCR 反应(ABI Taqman lnc∕miRNA RT 试剂盒)。反应体系:初始95 ℃10 min;95 ℃30 s,解链;58 ℃30 s 退火;70 ℃10 s 延伸,设置30 个循环;70 ℃10 min后-80 ℃保存。以内参为对照,取三复孔进行平均,对照组设为100%,对实验组进行相对定量。
1.5 荧光素酶报道基因设计引物扩增lncRNA MALAT1 的3′UTR 区序列,将其克隆到PGL3 basic载体,构建PGL3-MALAT1-WT 质粒;设计相应的MALAT1 突变 质粒,构建PGL3-MALAT1-MUT 质粒。GenePharm 吉玛公司合成miR-30 的mimic 及inhibitor 片段,在293 细胞转染相应的质粒及miR-30 片段。48 h 后裂解细胞,检测荧光素酶活性。
1.6 细胞转染与Transwell细胞迁移和侵袭基质细胞细胞融合至50%,采用Lipofectamine 2000 试剂盒 转 染MALAT1 质 粒 和∕或miR-30 mimic∕inhibitor片段(由GenePharm 吉玛公司合成)。细胞转染后,收集各组处理细胞,用100 μL 无血清重悬转入Transwell 小室,进行迁移和侵袭(铺Matrigel 胶),在37 ℃,5% CO2的细胞培养箱孵育24 h 后取出小室,4%多聚甲醛固定20 min,PBS 洗涤1 次,结晶紫染色10 min,PBS 洗干净,并于显微镜下观察细胞是否穿透小孔,并进行拍照,200×光镜选取5 个视野计数穿膜细胞个数,实验重复3 次。
1.7 统计学方法应用SPSS 20.0 统计软件进行分析,计量资料采用均数±标准差组间比较采用独立样本t检验。P<0.05认为差异有统计学意义。
2 结果
2.1 MALAT1 及miR-30 在骨巨细胞瘤组织中的表达情况通过实时定量qPCR 技术,对临床收集的3 例骨巨细胞瘤组织及松质骨对照组织进行MALAT1 及miR-30 表达水平的检测。结果表明,与对照组相比,miR-30在骨巨细胞瘤组织中的表达水平显著升高[(1.032±0.064)vs.(2.135±0.240),P<0.05],而MALAT1 的水平则显著减低[(1.086±0.119)vs.(0.630±0.100),P<0.05]。见图2。
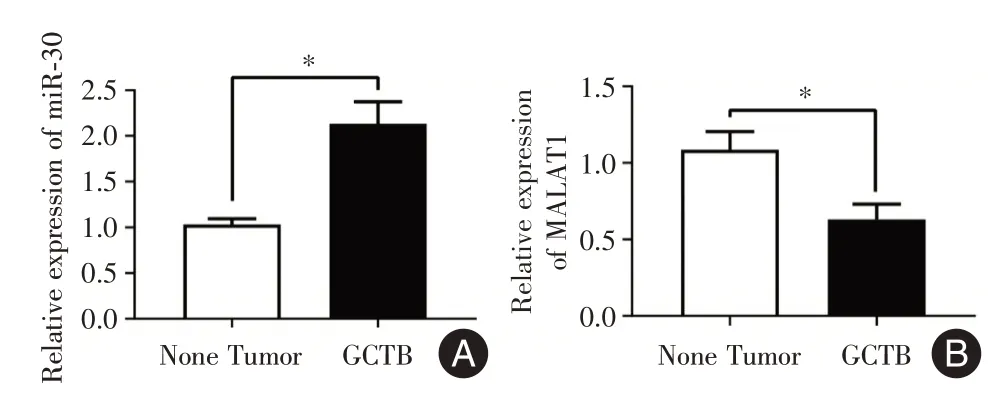
图2 实时定量PCR 检测骨巨细胞瘤组织中miR-30 及MALAT1 表达情况Fig.2 The levels of miR-30 and MALAT1 in GCTB tissues were detected by quantitative PCR
2.2 荧光素酶报道基因检测MALAT1 靶向吸附miR-30 的情况生物信息学工具ENCORI 分析发现,MALAT1 的chr11:65267543-65267564 区域有miR-30的结合位点,提示MALAT1可能是miR-30的靶基因。构建包含miR-30 靶向的MALAT1 3′UTR区域的荧光素酶报道基因(MALAT1 WT)及相应的突变(MALAT1 MUT)质粒,合成miR-30 mimic 相似物。见图3A。
荧光素酶报道基因实验的结果表明,过表达MALALT1 WT 和miR-30 片段后,荧光素酶报道的荧光信号明显减弱[(1.012 ± 0.126)vs.(0.479 ±0.062),P<0.05]。过表达miR-30 mimic 相似物对突变质粒的荧光信号不产生影响。结果说明miR-30 及MALAT1 有直接调控关系。见图3B。
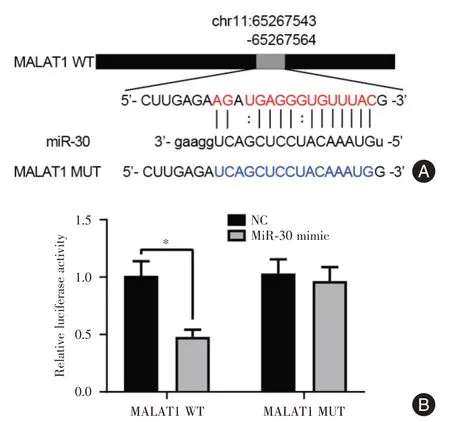
图3 MALAT1 表达对miR-30 的影响Fig.3 The influence of MALAT1 expression on miR-30
2.3 MALAT1、miR-30单独对骨巨细胞瘤基质细胞生长及迁移侵袭的调控通过MTT实验及Transwell实验观察过表达MALAT1 及抑制miR-30 对细胞的生长、迁移和侵袭的影响。过表达MALAT1之后,基质细胞生长明显被抑制,其生长曲线变得平缓;而且Transwell 的实验结果表明,过表达MALAT1 后,细胞的迁移和侵袭能力显著下降(P<0.05)。见图4A-C。过表达miR-30 inhibitor抑制物之后,基质细胞的生长(图4D)、迁移(P<0.05,图4E)和侵袭(P<0.05,图4F)能力也同样受到抑制。
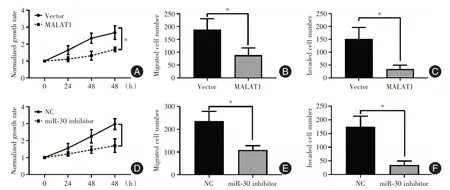
图4 MALAT1、miR-30 对骨巨细胞瘤基质细胞生长、迁移和侵袭的影响Fig.4 The role of MALAT1 and miR-30 on the growth,migration and invasion of stromal cells
2.4 MALAT1 通过miR-30 对骨巨细胞瘤基质细胞生长及迁移侵袭的调控上下游拮抗实验结果见图5。过表达miR-30 mimic 类似物可显著促进细胞的生长,而如果同时过表达MALAT1 则可以抵消miR-30 mimic 类似物的促进作用(图5A);同样的,过表达miR-30 mimic 类似物会促进细胞的迁移和侵袭,而同时过表达MALAT1 则可抑制miR-30 mimic 类似物的促进作用(图5B-E)。
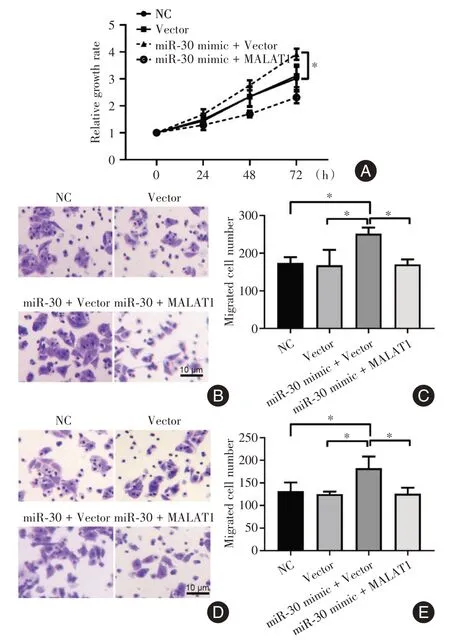
图5 MALAT1 通过miR-30 发挥调控骨巨细胞瘤基质细胞生长、迁移和侵袭的作用Fig.5 MALAT1 regulate miR-30 to affect the growth,migration and invasion of stromal cells
3 讨论
骨巨细胞瘤是一种局部侵袭性溶骨性肿瘤,可引起严重的骨破坏[15]。骨巨细胞瘤一般为良性肿瘤,但具有恶变成为恶性的骨巨细胞瘤的倾向[16]。外科手术治疗后,27%~65%的骨巨细胞瘤患者表现出局部复发[17],并且高达6%的骨巨细胞瘤发生肺转移[18-19]。众多的文献主要集中在探讨骨巨细胞瘤发生的原因及危险因素,而对具体的生理病理机制缺乏深入了解。基质细胞是骨巨细胞瘤迁移和侵袭的主要细胞成分,研究调控基质细胞分化、迁移和侵袭的机制,有助于为临床治疗骨巨细胞瘤提供新的思路和理论依据。本研究发现长链非编码RNA MALAT1 在骨巨细胞瘤组织中低表达而微小RNA miR-30 则高表达,而进一步通过生物信息学分析发现MALAT1 存在吸附抑制miR-30的靶向序列,且通过荧光素酶报道基因及突变实验证明了MALAT1 可靶向调控miR-30;单独过表达MALAT1 或者抑制miR-30 均可抑制骨巨细胞瘤基质细胞生长迁移和侵袭;而且MALAT1 是通过miR-30 调控骨巨细胞瘤发展发挥作用。因此,MALAT1∕miR-30 信号通路是介导骨巨细胞瘤基质细胞生长的关键通路。
骨巨细胞瘤是骨破坏肿瘤,因此抑制骨吸收是降低骨巨细胞瘤复发的有效治疗策略[20]。研究表明,双膦酸盐具有抗骨溶解的保护作用,可广泛用于骨巨细胞瘤的临床治疗中[21-22]。然而,长期服用双膦酸盐可能导致长骨骨骼坏死和非典型性骨折[23]。地诺单抗(Denosumab)是一种针对RANKL的单克隆抗体,最近已被批准用于骨转移治疗,对双膦酸盐难治性恶性高钙血症和某些巨细胞瘤发挥作用[24-25]。地诺单抗由于其抗吸收作用,骨转换标志立即下降,但骨碱性磷酸酶注射后1 个月才下降[26-27]。因此,RANK∕RANKL 及其下游分子的受体激活剂的治疗途径可能代表治疗骨巨细胞瘤的靶点。RunX2 在多种肿瘤中被报道与RANK∕RANKL信号密切相关[28-29],且RANK∕RANKL∕RunX2 信号通路与成骨破骨细胞的功能调节密切相关[30-31]。有文献报道,miR-30a 可以通过与其3′-UTR 结合来调节RunX2 的表达,从而调节破骨细胞的分化并促进骨巨细胞瘤中的骨生成[32]。本研究结果显示,miR-30 参与调控骨巨细胞瘤,而且MALAT1 可直接靶向调控miR-30。
LncRNA 属于长链非编码RNA,有很强的组织和细胞特异性,与多种疾病特别是骨科疾病,如骨关节炎、骨肉瘤等疾病的发生发展密切相关[7]。LncRNA 可通过相互作用位点与下游靶miRNA 竞争性相互作用,成为miRNA 的“分子海绵”,吸附性抑制miRNA 使其不能发挥作用。MALAT1 与骨科疾病的关系密切相关,有报道MALAT1 通过靶向人骨髓来源的间充质干细胞中的miRNA-143 来促进osterix 表达以调节成骨分化[33]。MALAT1 可调节肺癌的骨转移[34]。MALAT1 上调的ZEB-1 可被β-catenin 协调,增强HGF 介导的骨髓间充质干细胞向肝细胞分化的端粒酶活性[35]。骨巨细胞瘤可恶化为骨肉瘤,MALAT1 可调控骨肉瘤细胞的发生发展[36]。本研究结果表明,MALAT1 在骨巨细胞瘤中下调,低表达的MALAT1 不能很好的靶向吸附性抑制miR-30,从而使得骨巨细胞瘤基质细胞生长。
miRNA 被报道参与骨巨细胞瘤发生发展的多个环节的调控[37]。据报道,miR-126-5p 在骨巨细胞瘤的纺锤状基质细胞中显著下调,并通过抑制基质金属蛋白酶13(MMP-13)的表达影响破骨细胞的分化和骨吸收[38]。最近的一项研究还表明,miRNA-106b 通过靶向骨巨细胞瘤中的RANKL 来抑制破骨细胞生成和骨溶解[21]。miRNA 可能会调节破骨细胞的产生和功能[39]。而miR-16-5p 抑制了BMM 中的破骨细胞生成[40]。本研究表明,miR-30 参与了骨巨细胞瘤基质细胞的分化,因此是调控骨巨细胞瘤转移的关键因素。这为miR-30作为靶点提供了深入的证据。骨巨细胞瘤发生发展过程中,除了miR-30 外,肯定还有其他miRNA的参与,且除了RunX2 的下游基因外,其他基因的参与也需要进一步明确。所以本研究也有一定的局限性,大范围多样本的高通量测序研究可进一步揭示非编码及微小RNA 在骨巨细胞瘤中的作用;其下游底物也需要进一步明确,比如是否通过RunX2 发挥作用;而动物实验也需要进一步验证MALAT1∕miR-30 通路是否可调节骨巨细胞瘤的肺转移。
总之,本研究表明LncRNA MALAT1 及miR-30在骨巨细胞瘤中表达水平有异常,MALAT1 可直接海绵吸附抑制miR-30 从而调节骨巨细胞瘤基质细胞的生长、迁移和侵袭。
