LRP5基因一个新的突变位点相关的家族性渗出性玻璃体视网膜病变
2021-04-10覃亚周樊小娟刘静李晶明
覃亚周 樊小娟 刘静 李晶明
1西安交通大学第一附属医院眼科 710061;2西安市第四医院眼科 710004
家族性渗出性玻璃体视网膜病变(familial exudative vitreoretinopathy,FEVR)是一种视网膜血管生长和发育异常的遗传性疾病[1]。FEVR有多种遗传方式,包括常染色体显性遗传、常染色体隐性遗传和X染色体连锁隐性遗传,遗传方式的不同与涉及的基因突变位点有关[2]。目前已发现6个与FEVR相关的基因,包括卷曲蛋白-4(frizzled-4,FZD4)、低密度脂蛋白受体相关蛋白-5(low density lipoprotein receptor related protein-5,LRP5)、四次跨膜蛋白-12(tetraspanin-12,TSPAN12)、Norrin蛋白(norrin disease protein,NDP)、锌指蛋白408(zinc finger protein 408,ZNF408)和驱动蛋白家族成员11(kinesin family number,KIF11)[3-8]。近期一项34个FEVR家系的队列研究发现,在父母均存在相关基因突变的情况下,突变基因以LRP5最为多见,高达64.6%[9]。部分FEVR患者早期无明显视力异常,常规眼科查体容易漏诊,随着分子生物学和遗传学的发展,基因检测逐渐成为此类疾病重要的筛检手段。本研究对1个存在LRP5基因变异的FEVR家系临床表型和基因突变特点进行分析,为FEVR的精准诊断提供依据。
1 资料与方法
1.1 一般资料
采用家系调查研究方法,纳入中国陕西省西安市1个汉族FEVR家系2代3名成员。先证者因2017年体检时发现眼底有异常改变,无自觉症状,就诊于西安市第四医院并诊断为FEVR,并于2019年10月至西安交通大学第一附属医院眼科就诊行基因检测。本研究遵循《赫尔辛基宣言》,经西安交通大学第一附属医院伦理委员会批准(批文号:2017-740),所有家系成员均签署知情同意书。
1.2 方法
1.2.1一般检查 先证者及其父母均接受常规眼科检查,包括应用标准对数视力表(苏州六六视觉科技股份有限公司)检查视力、应用非接触式眼压计(TX-20,日本Topcon公司)测量眼压,应用裂隙灯显微镜(SL-1E,日本Topcon公司)及前置镜(Digital Wild field,Volk)行眼前节及眼底检查,使用超宽眼底视野扫描成像(Daytona,意大利Optos公司)进行广角荧光素眼底血管造影(fundus fluorescein angiography,FFA)以明确各家系成员的临床表型。
1.2.2基因测序及遗传学分析 采集先证者及其父母外周血5 ml,于北京中因科技有限公司进行眼科基因诊断芯片检测,该基因诊断芯片包括76种常见眼科遗传病的441个致病基因。提取受检者外周血中基因组DNA,构建基因组文库,通过探针杂交捕获相关目的基因外显子及相邻内含子部分区域,应用NovaSeq 6000技术测序平台对富集的目的基因片段进行测序,采用Sanger测序对所报告FEVR相关的变异位点进行验证。根据美国医学遗传学协会(American College of Medical Genetics,ACMG)指南[10],并采用Mutation Taster、Polyphen-2、PROVEN和REVEL软件对新发现的变异位点进行致病性分析。
2 结果
2.1 家系患者临床表型
该家系为常染色体显性或隐性遗传。先证者,男,27岁,裸眼视力(uncorrected visual acuity,UCVA)右眼1.0,左眼1.2,眼压正常,裂隙灯显微镜下检查眼底可见双眼颞侧周边部视网膜血管迂曲扩张,FFA示双眼周边视网膜血管扩张成毛刷样改变并有无灌注区形成,诊断为FEVR,行眼底激光光凝治疗。2019年10月FFA检查可见双眼周边视网膜激光斑,右眼颞侧仍可见少量荧光素渗漏灶(图1)。
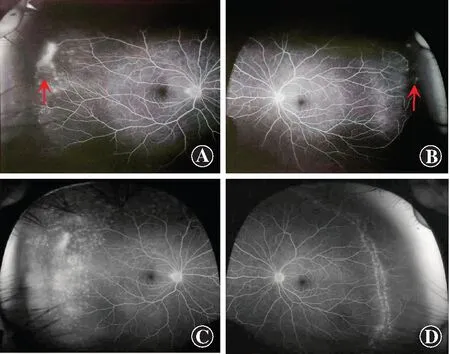
图1 先证者广角FFA图像 A:激光光凝治疗前右眼广角FFA图像 右眼颞侧周边部血管毛刷样改变,可见荧光素渗漏(红色箭头) B:激光光凝治疗前左眼广角FFA图像 左眼颞侧周边部可见少量荧光素渗漏(红色箭头) C:激光光凝治疗后2年右眼广角FFA图像 右眼颞侧周边可见激光斑,仍有少量荧光素渗漏 D:激光光凝治疗后2年左眼广角FFA图像 左眼颞侧可见激光斑,未见荧光素渗漏Figure 1 Wild-field FFA images of the proband A:Wild-field FFA of the right eye before treatment Hairbrush-like vascular abnormality with fluorescein leakage (red arrow) was visible in temporal peripheral retina B:Wild-field FFA of the left eye before treatment A slight fluorescein leakage (red arrow) was visible in temporal peripheral retina C:Wild-field FFA of the right eye 2 years after laser coagulation Laser spots were visible and fluorescein leakage was decreased D:Wild-field fundus fluorescein angiography of the left eye 2 years after laser coagulation Laser spots were visible in peripheral retina and fluorescein leakage was not observed
先证者母亲51岁,双眼UCVA均为0.8,双眼最佳矫正视力(best corrected visual acuity,BCVA)均为1.0,眼压正常,眼底检查可见左眼颞侧周边视网膜血管迂曲,广角FFA检查示左眼颞侧周边视网膜末梢血管荧光素渗漏,诊断为左眼视网膜周边血管异常。先证者父亲56岁,UCVA右眼0.08,左眼0.1,双眼BCVA均为1.0,眼压正常,眼底检查可见视盘周围萎缩环与豹纹状眼底,广角FFA检查未见眼底血管有明显荧光素渗漏,诊断为双眼高度近视眼底改变(图2)。
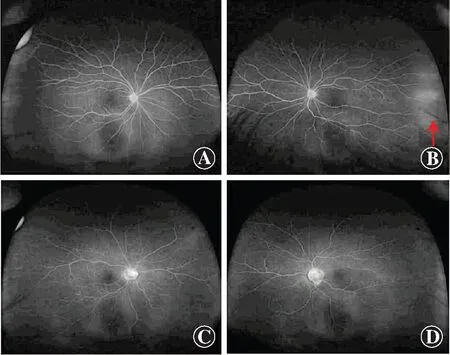
图2 先证者父母FFA图像 A:先证者母亲右眼广角FFA图像 未见荧光素渗漏 B:先证者母亲左眼广角FFA图像 可见颞侧周边视网膜末梢血管荧光素渗漏(红色箭头) C:先证者父亲右眼广角FFA图像 未见荧光素渗漏 D:先证者父亲左眼广角FFA图像未见荧光素渗漏Figure 2 FFA images of the proband's parents A:Wild-field FFA of the right eye of the proband's mother Fluorescein leakage was not detected B:Wild-field FFA of the left eye of the proband's mother The vascular fluorescein leakage (red arrow) was visible at temporal peripheral retina C:Wild-field FFA of the right eye of the proband's father Fluorescein leakage was not observed D:Wild-field FFA of the left eye of the proband's father Fluorescein leakage was not observed
2.2 家系基因检测结果及分析
基因检测结果显示,先证者存在2个新发现的基因变异位点:LRP5基因c.4110T>G(p.Cys1370Trp)和FSCN2基因c.1495G>A(p.Gly499Ser)(表1)。先证者母亲携带该LRP5基因突变位点,先证者父亲未检测到以上变异位点。
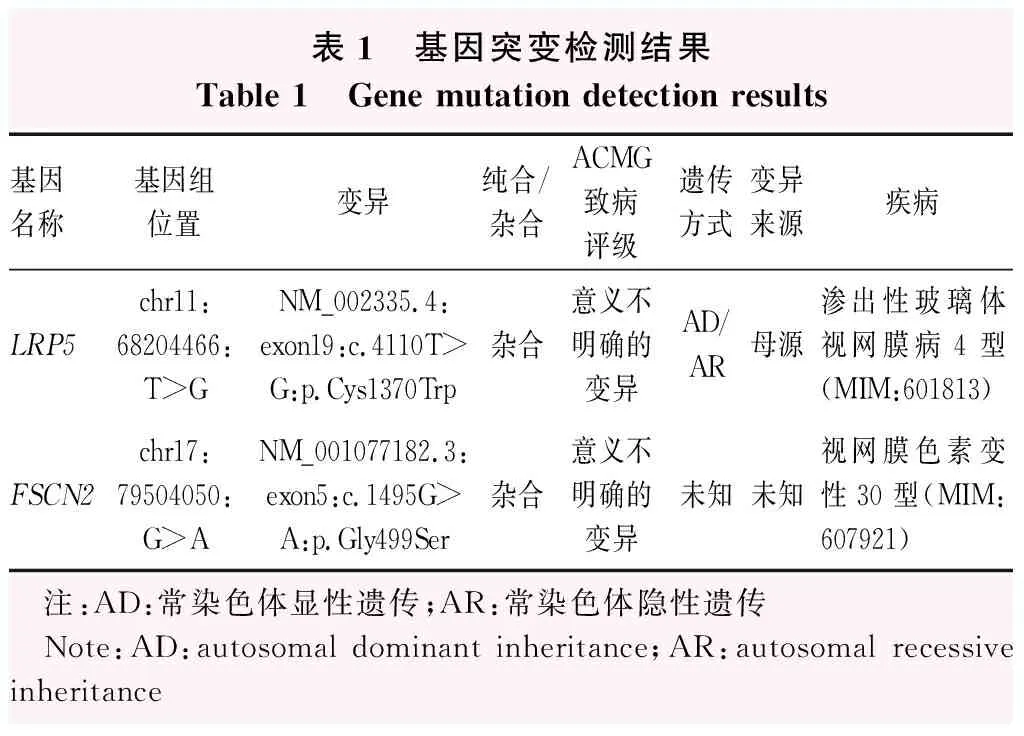
表1 基因突变检测结果Table 1 Gene mutation detection results基因名称基因组位置变异纯合/杂合ACMG致病评级遗传方式变异来源疾病LRP5chr11:68204466:T>GNM_002335.4:exon19:c.4110T>G:p.Cys1370Trp杂合意义不明确的变异AD/AR母源渗出性玻璃体视网膜病4型(MIM:601813)FSCN2chr17:79504050:G>ANM_001077182.3:exon5:c.1495G>A:p.Gly499Ser杂合意义不明确的变异未知未知视网膜色素变性30型(MIM:607921) 注:AD:常染色体显性遗传;AR:常染色体隐性遗传 Note:AD:autosomal dominant inheritance;AR:autosomal recessive inheritance
p.Cys1370Trp为LRP5基因所编码蛋白的第1370号氨基酸由半胱氨酸变为色氨酸。采用Sanger测序法对LRP5基因c.4110T>G突变进行验证,确认先证者此变异为杂合变异,先证者母亲携带这一杂合变异,父亲则不携带(图3)。根据该家系临床表型与基因检测结果绘制家系图(图4)。Genome Aggregation Database(gnomAD)和Exome Aggregation Consortium(ExAC)等多个数据库均未检测到此变异,可作为1个中等致病性证据(moderate evidence of pathogenicity,PM)2。使用MutationTaster、Polyphen-2、PROVEN和REVEL软件对此变异进行蛋白质结构、功能和进化保守性预测:MutationTaster预测该变异致病的概率为0.999;Polyphen-2评分为0.999,为很有可能致病的变异;PROVEN预测得分为-5.437,低于-2.5,为有害变异;REVEL评分为0.93,为有害变异。以上软件预测结果提供了1个此变异致病的支持证据(supporting evidence of pathogenicity,PP)3。另外,患者的临床表型高度符合FEVR,也可作为1个支持证据PP4。根据ACMG指南,PM2+PP3+PP4仅能判断此LRP5基因变异位点为临床意义未明的变异。
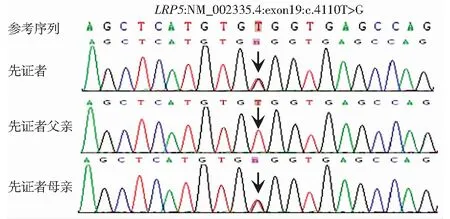
图3 Sanger法测序验证图 先证者及其母亲携带LRP5基因c.4110T>G,黑色箭头示突变位点Figure 3 Sanger sequencing results Mutation site (c.4110T>G) of LRP5 gene was detected in the proband and his mother,and black arrow indicated the mutation site
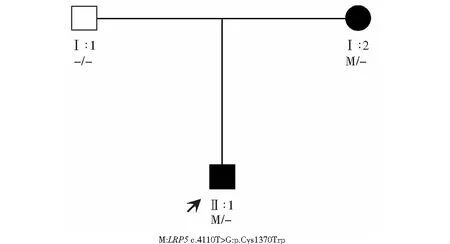
图4 FEVR患者家系图 □:正常男性;■:患病男性;●:患病女性;:先证者Figure 4 FEVR pedigree chart □:normal male;■:sick male;●:sick female;:proband
另外,仅先证者携带的FSCN2基因c.1495G>A(p.Gly499Ser)变异与视网膜色素变性相关,与FEVR临床表型不符合,仅MutationTaster、Polyphen-2及PROVEN预测为有害变异,致病性证据不足。
3 讨论
本研究发现LRP5基因1个新的突变位点c.4110T>G(p.Cys1370Trp),虽然该变异目前被判定为临床意义未明,鉴于该病表型与患者表型高度相符,可认为该变异致病可能性大。该突变位点来自于先证者母亲,若想进一步分析,需明确先证者母亲表型,对家族内其他人进行基因测序。但客观条件受限,未能取得家族中其他成员配合,故无法进行深入研究。
临床上约50%的FEVR患者由Norrie/Wnt信号通路相关的基因突变引起,涵盖FZD4、LRP5、TSPAN12和NDP[11]。Wnt信号通路参与调控细胞的增生、迁移和分化,以及眼球的组织发育和血管形成过程[12]。Norrin通路与异常视网膜血管生成密切相关,并与Wnt通路共同参与核转录调节因子β-catenin的激活,从而调控特定组织器官中促进细胞增生和分化的靶基因的表达。FEVR最常见的遗传方式是常染色体显性遗传,与FZD4和LRP5基因突变有关。正常情况下,FZD4和LRP5基因编码产物组成受体复合物,并与Wnt或Norrin蛋白结合,抑制细胞质内β-catenin的泛素-蛋白酶体途径降解,使其在细胞质中积累并进入细胞核,与细胞核内的T细胞因子或淋巴增强因子(T cell factor/lymphoid enhancer factor,TCF/LEF)作用,促进目的基因的表达。当Norrin蛋白配体与FZD4-LRP5受体复合物结合时,需要TSPAN12基因表达产物的参与,促进复合物的多聚化。其中Norrin蛋白是NDP基因编码的一种富含半胱氨酸的分泌蛋白,可与FZD4结合,其结合的特异性和亲和力越高,Norrin诱导FZD4和LRP5依赖的经典Wnt通路越高效。非经典途径还包括激活胞内信号与FZD4的结合,但此途径不需要LRP5的参与。
本研究探讨的LRP5基因突变可引起FEVR4型,目前LRP5基因突变引起的FEVR发病率约为22%[11],已有三十余个突变位点被证实与FEVR相关。LRP5蛋白是由1 615个氨基酸组成的单次跨膜蛋白,末端序列与轴蛋白连接,轴蛋白起支架作用并与糖原合成激酶-3、β-catenin组成复合物,促进β-catenin的磷酸化并进入细胞核与TCF/LEF作用。LRP5除了在视网膜血管发育中具有重要作用外,也可控制成骨细胞功能和骨的形成,导致骨质疏松,严重者可有骨折发生[13]。因此对于由LRP5基因突变所导致的FEVR患者,尤其是老年患者,需密切关注骨密度。
先证者还携带1个FSCN2基因变异位点c.1495G>A(p.Gly499Ser)。FSCN2基因位于染色体17q25,可在视网膜光感受器细胞中表达,诱导肌动蛋白交联,对维持光感受器的形态有着重要作用。FSCN2基因变异常引起视网膜色素变性30型。视网膜色素变性是一种遗传性的渐进性视网膜退化性疾病,主要由视网膜感光细胞和色素上皮细胞变性所致,以夜盲、进行性视野缩小、视力下降为主要表现,疾病晚期会出现中心视力丧失。该FSCN2基因突变遗传方式未知,还需要结合临床表型及家族史综合考虑。FSCN2基因突变改变了肌动蛋白的聚合活动和感光细胞成束蛋白的活动,导致视网膜营养障碍,从而引发视网膜退化[14]。先证者携带LRP5和FSCN2基因突变,其母亲只携带LRP5基因突变,先证者FFA示周边视网膜血管扩张成毛刷样改变并有无灌注区,而其母亲FFA仅表现为左眼颞侧周边视网膜末梢血管荧光素渗漏,先证者的眼底病变较其母亲更严重。FSCN2基因是否也参与了FEVR的发病机制,LRP5和FSCN2基因之间是否存在相互作用来共同影响FEVR患者的眼底表现,目前尚无相关研究。
FEVR患者从无症状到全盲的过程具有高度多样性,即使是在同一家系内,各患者的临床表现和严重程度也可能各不相同。本例中先证者及其母亲均携带LRP5基因突变,先证者眼底表现典型,但是其母亲仅表现为轻度的视网膜周边血管渗漏,推测这一差异可能有以下原因:基因芯片检测具有局限性,先证者可能携带其他不在基因芯片检测范围内的致病基因;现有的基因测序技术不能发现基因大片段缺失和重复变异,亦不能完全发现基因位于内含子和非翻译区的变异;此外,重要信号通路的调控、表观遗传修饰和蛋白质的翻译后修饰在眼球的正常发育中也有着至关重要的作用。未来还需更深入的研究从分子水平上明确其发病机制。
早期诊断FEVR并制定合适的治疗方案是预防疾病进展和挽救患者视力的关键,以往通过FFA可以在早期观察眼底血管变化,从而提高诊断效率。随着现代分子生物学技术的发展,在基因水平对FEVR家系进行基因检测不仅对于疾病的诊断、发现新的治疗靶点具有十分重要的意义,也可为优生优育提供遗传学咨询。
利益冲突所有作者均声明不存在利益冲突
