lncRNA ADPGK-AS1对视网膜母细胞瘤细胞生物学行为的抑制作用及其调控机制
2021-04-10张俊刘彩林卜战云
张俊 刘彩林 卜战云
1驻马店市中心医院检验科 463000;2郑州大学第一附属医院检验科 450052;3郑州大学第一附属医院眼科 450052
视网膜母细胞瘤(retinoblastoma,RB)是临床上常见的眼内原发性恶性肿瘤,严重威胁患者生命,早期发现并及时治疗可提高患者生存率。RB的发病机制尚未完全阐明,但研究发现长链非编码RNA(long noncoding RNA,lncRNA)、微小RNA(microRNA,miRNA)表达变化与RB的发生和发展密切相关,如miR-25-3p和miR-494通过调控PI3K/AKT信号通路促进RB的进展[1-2],miR-144可作为RB诊断的标志物[3],miR-129-5p、miR-936和miR-598通过减弱PI3K/Akt通路的作用来抑制RB细胞的生物学行为[4-6],沉默lncRNA ANRIL可通过调控miR-99a来抑制RB细胞增生[7],miR-184可增强RB对化学疗法的敏感性[8],miR-214-3p通过靶向ABCB1和XIAP来调控RB细胞凋亡[9],此外miR-188-5p、miR-218-5p和miR-218-5p也参与RB细胞的凋亡过程[10-12]。lncRNA在RB中表达异常,可能参与细胞增生、迁移等生物学行为变化过程。研究表明,在RB中lnc00152、lncRNA MALAT1和lncRNA TP73-AS1表达上调,可促进细胞增生、迁移及侵袭[13-15]。lncRNA ADPGK-AS1在胰腺癌组织中的表达水平升高,并通过激活锌指E-盒结合同源异形盒-1促进胰腺癌进展[16]。靶基因预测显示,二磷酸腺苷依赖的葡萄糖激酶反义RNA1(adenosine diphosphate-dependent glucokinase antisense RNA 1,ADPGK-AS1)与miR-623存在结合位点,miR-623在胰腺癌中表达水平降低,并可通过抑制基质金属蛋白酶1(matrix metalloproteinase 1,MMP1)的表达而抑制胰腺癌细胞的转移[17],推测ADPGK-AS1与miR-623的结合对RB也可发挥类似的作用,但其具体分子机制尚未阐明。本研究探讨ADPGK-AS1对RB细胞生物学行为的调控作用及其机制,以期为RB的治疗提供新的靶点。
1 材料与方法
1.1 材料
1.1.1RB组织标本收集及Y-79细胞来源 收集2017年2月至2018年11月在驻马店市中心医院和郑州大学第一附属医院接受RB手术的39例39眼患者的术中瘤体组织及瘤旁组织标本,其中男20例,女19例;年龄3~10岁,平均(6.35±2.35)岁。所有患者术中切除的眼内肿瘤组织标本经组织病理学检查证实为RB,将标本置于液氮中迅速冷冻,并转入-80 ℃超低温冰箱内保存。本研究经郑州大学第一附属医院医学伦理委员会审批(批文号:2017-KY-73)并遵循《赫尔辛基宣言》,所有患者监护人了解本研究方法及其标本再使用目的并自愿签署知情同意书。人RB细胞株Y-79细胞购自上海中乔新舟生物科技有限公司。
1.1.2主要试剂及仪器 DMEM培养液(杭州吉诺生物医药技术有限公司);Lipofectamine2000(北京赛因百奥生物技术有限公司);小干扰RNA正常对照(small interfering RNA-normal control,siRNA-NC)、siRNA-ADPGK-AS1、微小RNA正常对照(microRNA-normal control,miR-NC)、miR-623拟似物(miR-623 mimics)、anti-miR-NC、anti-miR-623(广州锐博生物科技有限公司);Trizol试剂(美国Invitrogen公司);cDNA合成与实时荧光定量PCR试剂(美国Thermo Fisher公司);MTT试剂(上海歌凡生物科技有限公司);兔抗人Ki-67一抗(9449)、兔抗人MMP-2一抗(40994)、兔抗人MMP-9一抗(13667)(美国CST公司);辣根过氧化物酶标记的山羊抗兔IgG二抗(ab172730)(美国Abcam公司)。Transwell小室(南京迅贝生物科技有限公司);Matrigel基质胶(上海伟进生物科技有限公司);ABI 7500型荧光定量RCR仪(美国ABI公司)。
1.2 方法
1.2.1细胞培养及分组 将Y-79细胞接种于96孔板,细胞密度为2.5×105个/ml,100 μl/孔,细胞培养24 h。待细胞培养至80%融合,按照实验目的分别将细胞分为siRNA-NC组、siRNA-ADPGK-AS1组、miR-NC组、miR-623组、siRNA-ADPGK-AS1+anti-miR-NC组和siRNA-ADPGK-AS1+anti-miR-623组,依据分组方法分别将相应质粒各10 μl加入培养基以转染Y-79细胞,将培养基更换为含体积分数10%胎牛血清的正常培养液,继续培养48 h。
1.2.2qRT-PCR法测定细胞中ADPGK-AS1和miR-623相对表达量 分别提取瘤旁组织、RB组织及各组Y-79细胞总RNA,检测RNA浓度,将总RNA逆转录为cDNA,以cDNA为模板进行荧光定量PCR反应。ADPGK-AS1正向引物为5’-GCCGATGTCGACACAAGCG-3’,反向引物为5’-AGCAAATGTGTTCCCATCCCT-3’;miR-623正向引物为5’-GCCGAGTGGGTTGTCGGGGACG-3’,反向引物为5’-CAGTGCGTGTGTCGTGGAGT-3’;U6正向引物为5’-ATTGGAACGATACAGAGAAGATT-3’,反向引物为5’-GGAACGCTTCACGAATTTG-3’;磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)正向引物为5’-AACGGATTTGGTCGTATTG-3’,反向引物为5’-GGAAGATGGTGATGGGATT-3’。反应体系:10倍PCR缓冲液2.5 μl,MgSO42.5 μl,dNTPs 2.5 μl,正反向引物各0.5 μl,cDNA 2.0 μl,RNase-Free ddH2O补足体系至25.0 μl。反应条件:95 ℃预反应2 min;95 ℃反应30 s,59 ℃退火30 s,72 ℃延伸30 s,共36次循环。ADPGK-AS1测定以GAPDH为内参,miR-623测定以U6为内参。采用2-△△Ct法检测ADPGK-AS1和miR-623相对表达量。
1.2.3MTT法评估各组细胞活力 将各组Y-79细胞接种于96孔板,细胞密度为2.5×105个/ml,100 μl/孔,细胞培养24 h。待细胞培养至80%融合,将MTT溶液加入培养液,20 μl/孔,继续培养4 h。离心半径6 cm,3 000 r/min离心5 min,弃上清,加入二甲基亚砜,150 μl/孔,避光振荡孵育5 min,采用酶标仪检测波长为490 nm处各孔吸光度(A)值。
1.2.4Transwell小室实验检测各组迁移和侵袭的细胞数 取各组Y-79细胞,细胞密度为2.5×105个/ml,加入Transwell小室上室,200 μl/孔,下室加入含有10%胎牛血清的培养液,600 μl/孔,培养24 h。培养液中滴加质量分数10%多聚甲醛溶液固定20 min,滴加结晶紫染液,作用10 min,光学显微镜下观察迁移细胞数。将Matrigel基质胶稀释液加入上室,40 μl/孔,继续培养细胞4 h,后续实验同细胞迁移实验,光学显微镜下观察侵袭细胞数。
1.2.5双荧光素酶报告实验测定WT-ADPGK-AS1和MUT-ADPGK-AS1酶活性 LncBase Predicted v.2预测显示ADPGK-AS1与miR-623存在结合位点(图1),分别构建野生型载体WT-ADPGK-AS1与突变型载体MUT-ADPGK-AS1,分别将miR-NC、miR-623 mimics与WT-ADPGK-AS1、MUT-ADPGK-AS1加入培养液共转染Y-79细胞,继续培养24 h。采用双荧光素酶报告基因检测系统检测,按照双荧光素酶报告基因试剂盒说明书,应用酶标仪检测萤火虫与海肾荧光值,以海肾荧光值作为内参,测定WT-ADPGK-AS1和MUT-ADPGK-AS1酶活性。分别将pcDNA、pcDNA-ADPGK-AS1、siRNA-NC、siRNA-ADPGK-AS1转染至Y-79细胞中继续培养24 h,并采用荧光定量PCR法测定细胞中miR-623表达。

图1 ADPGK-AS1的序列中含有与miR-623互补的核苷酸序列 WT:野生型;miR:微小RNA;MUT:突变型;ADPGK-AS1:二磷酸腺苷依赖的葡萄糖激酶反义RNA1Figure 1 The sequence of ADPGK-AS1 contained a nucleotide sequence complementary to miR-623 WT:wild type;miR:microRNA;MUT:mutant type;ADPGK-AS1:adenosine diphosphate-dependent glucokinase antisense RNA 1
1.2.6Western blot法测定细胞中Ki-67、MMP-2和MMP-9蛋白表达 取各组Y-79细胞,加入400 μl RIPA裂解液提取细胞总蛋白,采用BCA法测定蛋白浓度,取30 μg蛋白样品进行SDS-PAGE电泳反应,转膜,封闭,分别滴加Ki-67、MMP-2和MMP-9与内参GAPDH一抗稀释液(均1∶ 1 000),4 ℃孵育24 h,TBS洗涤,滴加相应二抗稀释液(1∶ 2 000),室温下孵育1 h,TBST洗涤,ECL显色,暗室内曝光显影,用Image J软件分析各条带灰度值。目的蛋白相对表达量=目的蛋白表达灰度值/GAPDH灰度值。
1.3 统计学方法
采用SPSS 21.0统计学软件进行统计分析。计量资料的数据经Shapiro-Wilk检验证实呈正态分布,以mean±SD表达。采用均衡分组单因素干预研究设计,瘤旁组织与RB组织中lncRNA ADPGK-AS1和miR-623 mRNA相对表达量差异比较采用配对t检验,不同干预的2个组间各检测指标差异比较采用独立样本t检验,多组间评估指标差异比较采用单因素方差分析,组间的多重比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 ADPGK-AS1和miR-623在人RB组织中的表达
与瘤旁组织比较,RB组织中ADPGK-AS1相对表达量明显升高,miR-623相对表达量明显降低,差异均有统计学意义(t=40.522,P<0.01;t=48.497,P<0.01)(表1)。
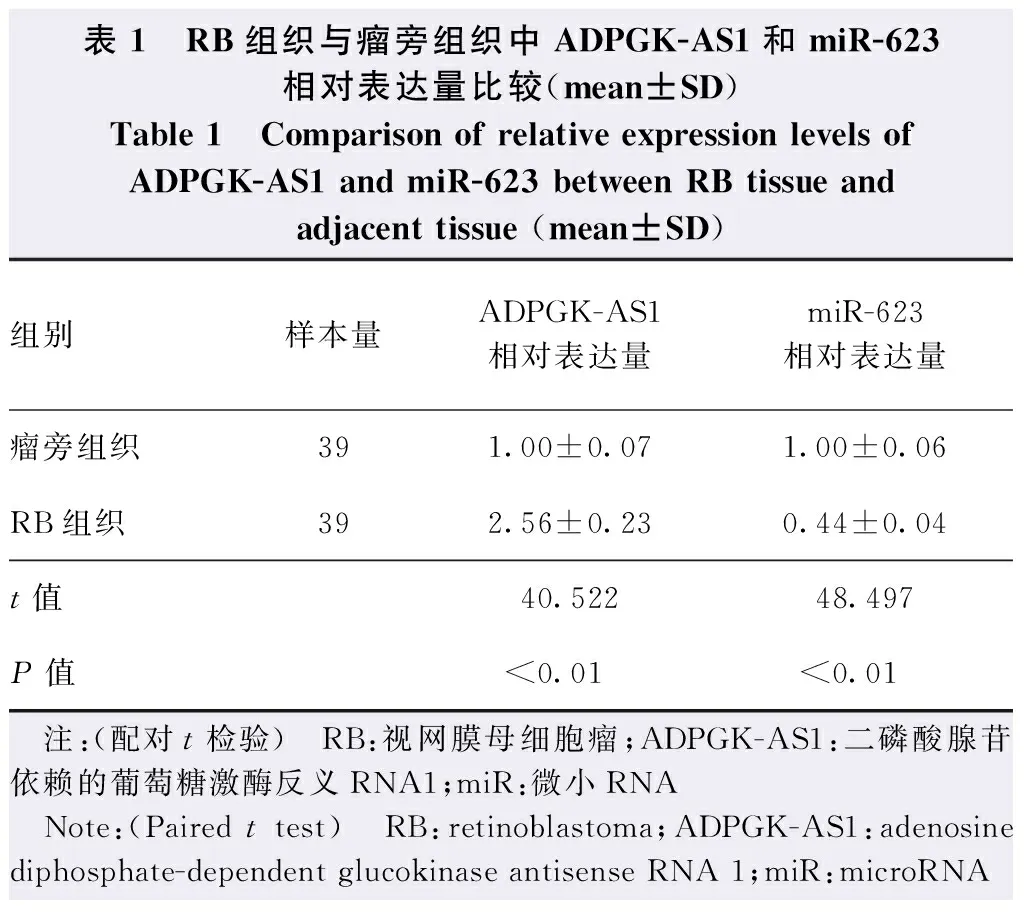
表1 RB组织与瘤旁组织中ADPGK-AS1和miR-623相对表达量比较(mean±SD)Table 1 Comparison of relative expression levels of ADPGK-AS1 and miR-623 between RB tissue and adjacent tissue (mean±SD)组别样本量ADPGK-AS1相对表达量miR-623相对表达量瘤旁组织391.00±0.071.00±0.06RB组织392.56±0.230.44±0.04t值40.52248.497P值<0.01<0.01 注:(配对t检验) RB:视网膜母细胞瘤;ADPGK-AS1:二磷酸腺苷依赖的葡萄糖激酶反义RNA1;miR:微小RNA Note:(Paired t test) RB:retinoblastoma;ADPGK-AS1:adenosine diphosphate-dependent glucokinase antisense RNA 1;miR:microRNA
2.2 不同siRNA转染组Y-79细胞增生相关指标变化
Western blot检测发现,siRNA-ADPGK-AS1组细胞中Ki-67蛋白表达条带强度较siRNA-NC组减弱(图2),Ki-67蛋白相对表达量明显低于siRNA-NC组,差异有统计学意义(t=26.833,P<0.01);与siRNA-NC组比较,siRNA-ADPGK-AS1组Y-79细胞增生A值明显降低,差异有统计学意义(t=18.522,P<0.01)(表2)。
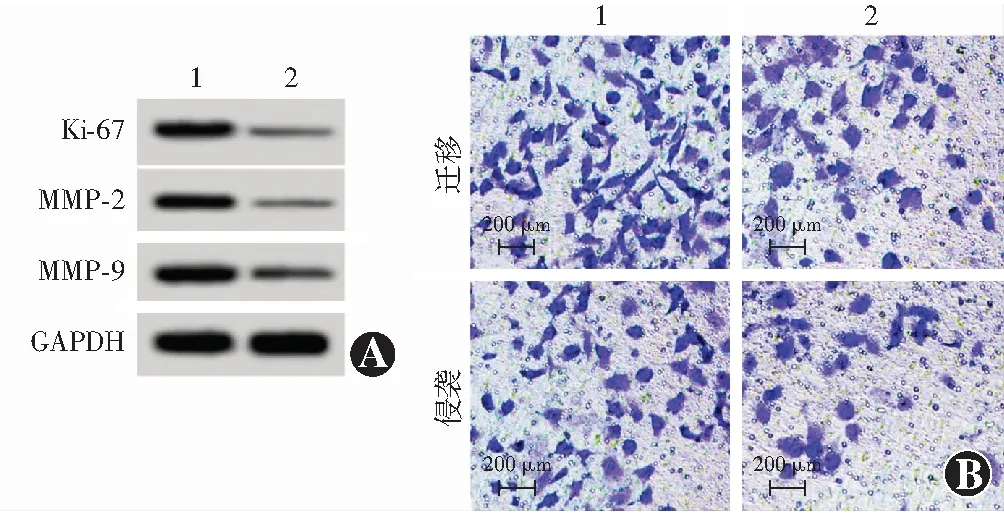
图2 不同siRNA转染组Y-79细胞增生及生物学行为相关指标比较 A:Western blot检测显示siRNA-ADPGK-AS1组细胞中Ki-67、MMP-2和MMP9蛋白表达条带明显弱于siRNA-NC组 B:不同质粒转染组迁移和侵袭情况(结晶紫 ×200,标尺=200 μm) siRNA-ADPGK-AS1组迁移和侵袭细胞数少于siRNA-NC组 1:siRNA-NC组;2:siRNA-ADPGK-AS1组 MMP:基质金属蛋白酶;GAPDH:磷酸甘油醛脱氢酶;siRNA:小干扰RNA;NC:正常对照;ADPGK-AS1:二磷酸腺苷依赖的葡萄糖激反义RNA1Figure 2 Comparison of Y-79 cells proliferation and biological behavior-related indicators in different siRNA transfection groups A:Ki-67,MMP-2 and MMP9 protein expression bands in the siRNA-ADPGK-AS1 group were significantly weaker than those in the siRNA-NC group B:The migration and invasion of different plasmid transfection groups (crystal violet ×200,scale bar=200 μm) The number of migrating and invading cells in the siRNA-ADPGK-AS1 group was less than that in the siRNA-NC group 1:siRNA-NC group;2:siRNA-ADPGK-AS1 group MMP:matrix metalloproteinase;GAPDH:glyceraldehyde phosphate dehydrogenase;siRNA:small interfering RNA;NC:normal control;ADPGK-AS1:adenosine diphosphate-dependent glucokinase antisense RNA 1
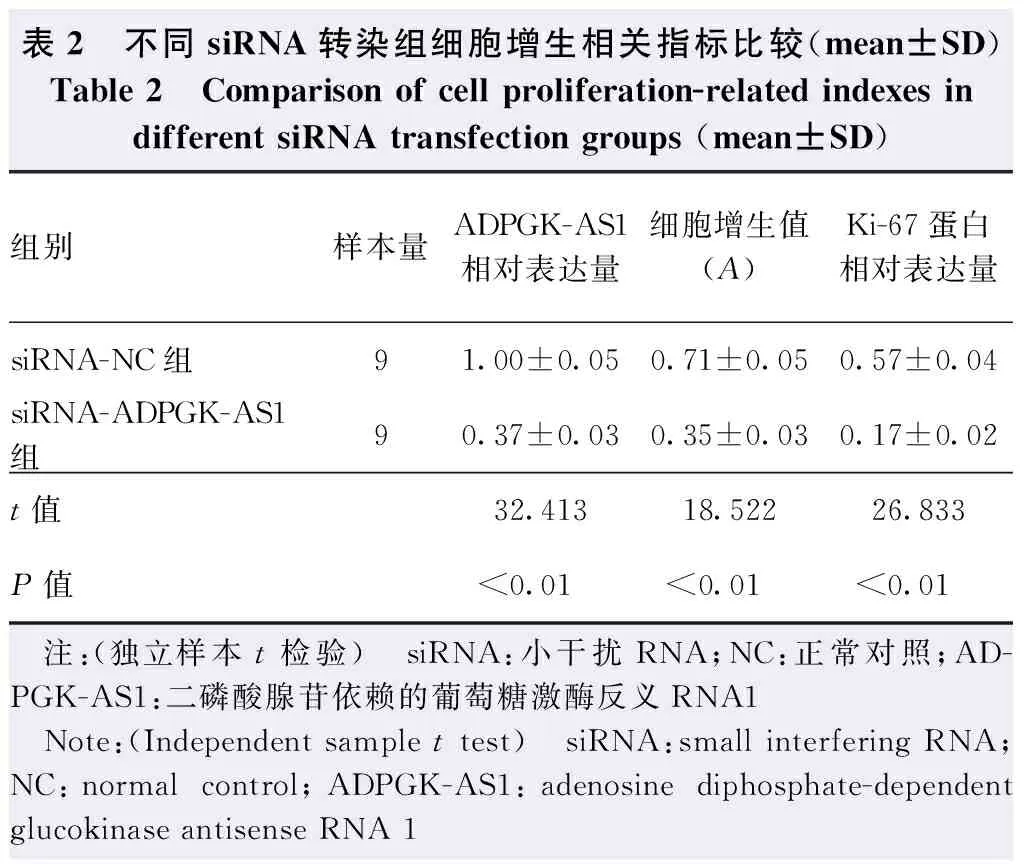
表2 不同siRNA转染组细胞增生相关指标比较(mean±SD)Table 2 Comparison of cell proliferation-related indexes in different siRNA transfection groups (mean±SD)组别样本量ADPGK-AS1相对表达量细胞增生值(A)Ki-67蛋白相对表达量siRNA-NC组91.00±0.050.71±0.050.57±0.04siRNA-ADPGK-AS1组90.37±0.030.35±0.030.17±0.02t值32.41318.52226.833P值<0.01<0.01<0.01 注:(独立样本t检验) siRNA:小干扰RNA;NC:正常对照;AD-PGK-AS1:二磷酸腺苷依赖的葡萄糖激酶反义RNA1 Note:(Independent sample t test) siRNA:small interfering RNA;NC:normal control;ADPGK-AS1:adenosine diphosphate-dependent glucokinase antisense RNA 1
2.3 不同siRNA转染组Y-79细胞生物学行为相关指标比较
Western blot检测结果显示,siRNA-ADPGK-AS1组细胞中MMP-2和MMP9蛋白表达条带强度均明显弱于siRNA-NC组,siRNA-ADPGK-AS1组Y-79细胞迁移数目和侵袭数目均少于siRNA-NC组(图2)。siRNA-ADPGK-AS1组细胞中MMP-2和MMP-9蛋白相对表达量均明显低于siRNA-NC组,差异均有统计学意义(t=22.123,P<0.01;t=26.183,P<0.01);Transwell小室实验结果显示,siRNA-ADPGK-AS1组迁移细胞数和侵袭细胞数均明显少于siRNA-NC组,差异均有统计学意义(t=12.385,P<0.01;t=19.201,P<0.01)(表3)。
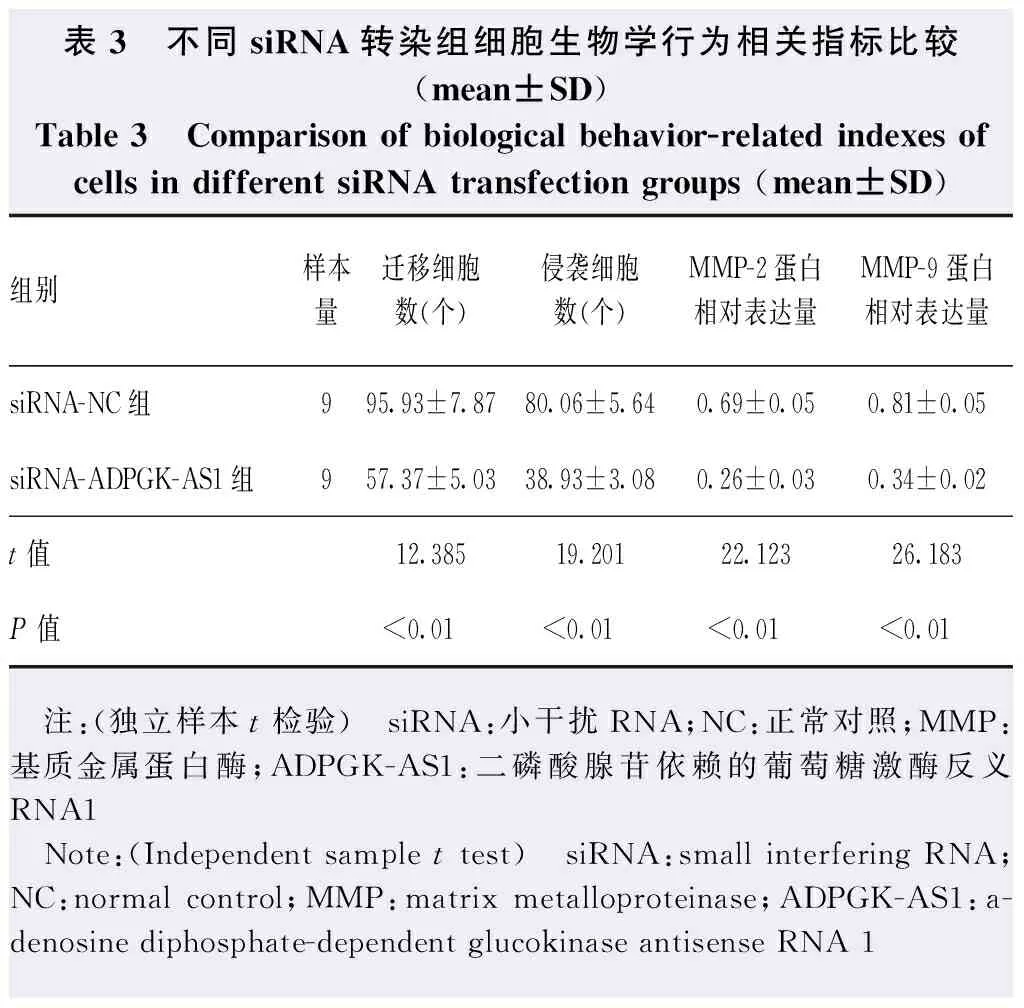
表3 不同siRNA转染组细胞生物学行为相关指标比较(mean±SD)Table 3 Comparison of biological behavior-related indexes of cells in different siRNA transfection groups (mean±SD)组别样本量迁移细胞数(个)侵袭细胞数(个)MMP-2蛋白相对表达量MMP-9蛋白相对表达量siRNA-NC组995.93±7.8780.06±5.640.69±0.050.81±0.05siRNA-ADPGK-AS1组957.37±5.0338.93±3.080.26±0.030.34±0.02t值12.38519.20122.12326.183P值<0.01<0.01<0.01<0.01 注:(独立样本t检验) siRNA:小干扰RNA;NC:正常对照;MMP:基质金属蛋白酶;ADPGK-AS1:二磷酸腺苷依赖的葡萄糖激酶反义RNA1 Note:(Independent sample t test) siRNA:small interfering RNA;NC:normal control;MMP:matrix metalloproteinase;ADPGK-AS1:a-denosine diphosphate-dependent glucokinase antisense RNA 1
2.4 ADPGK-AS1靶向调控miR-623的表达
与miR-NC组比较,miR-623组细胞中WT-ADPGK-AS1荧光素酶活性明显下降,差异有统计学意义(t=14.926,P<0.01),2个组间细胞中MUT-ADPGK-AS1荧光素酶活性比较差异无统计学意义(t=0.651,P=0.524)(表4)。与pcDNA组比较,pcDNA-ADPGK-AS1组miR-623的相对表达量降低,差异有统计学意义(P<0.05);与siRNA-NC组比较,siRNA-ADPGK-AS1组miR-623相对表达量升高,差异有统计学意义(P<0.05)(表5)。
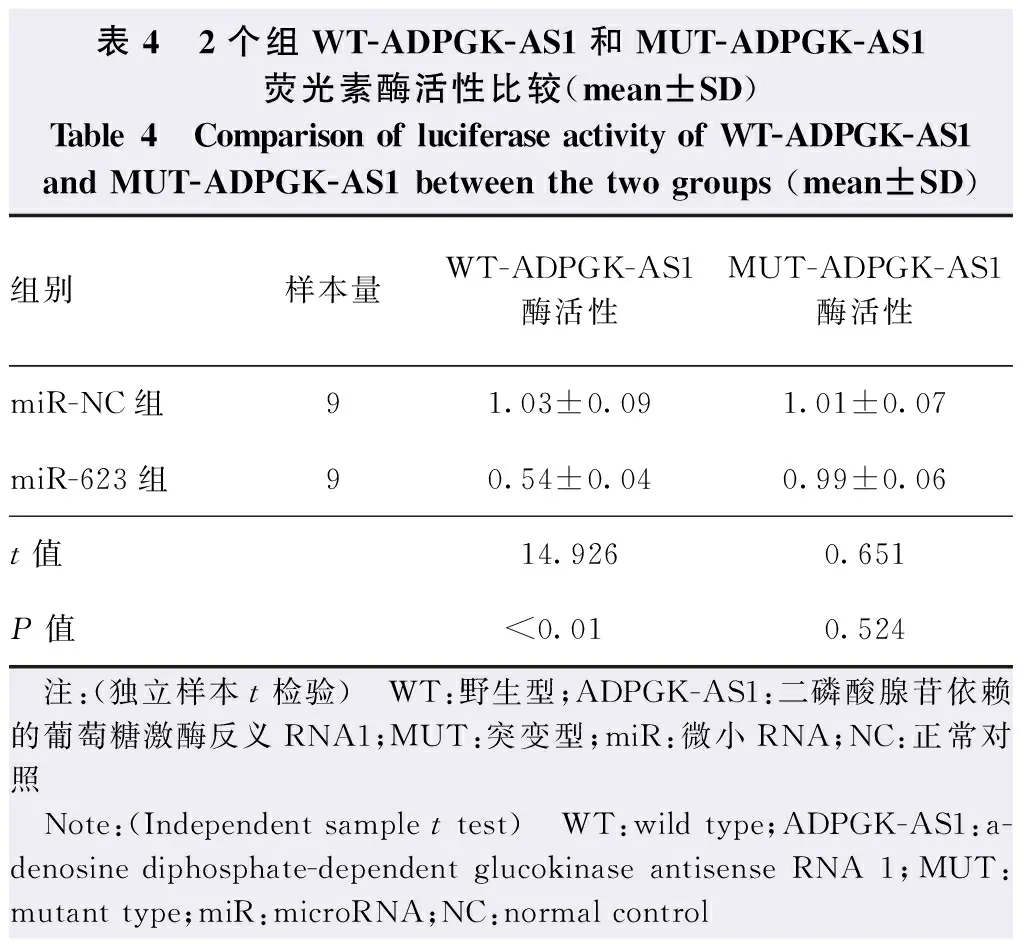
表4 2个组WT-ADPGK-AS1和MUT-ADPGK-AS1荧光素酶活性比较(mean±SD)Table 4 Comparison of luciferase activity of WT-ADPGK-AS1 and MUT-ADPGK-AS1 between the two groups (mean±SD)组别样本量WT-ADPGK-AS1酶活性MUT-ADPGK-AS1酶活性miR-NC组91.03±0.091.01±0.07miR-623组90.54±0.040.99±0.06t值14.9260.651P值<0.010.524 注:(独立样本t检验) WT:野生型;ADPGK-AS1:二磷酸腺苷依赖的葡萄糖激酶反义RNA1;MUT:突变型;miR:微小RNA;NC:正常对照 Note:(Independent sample t test) WT:wild type;ADPGK-AS1:a-denosine diphosphate-dependent glucokinase antisense RNA 1;MUT:mutant type;miR:microRNA;NC:normal control
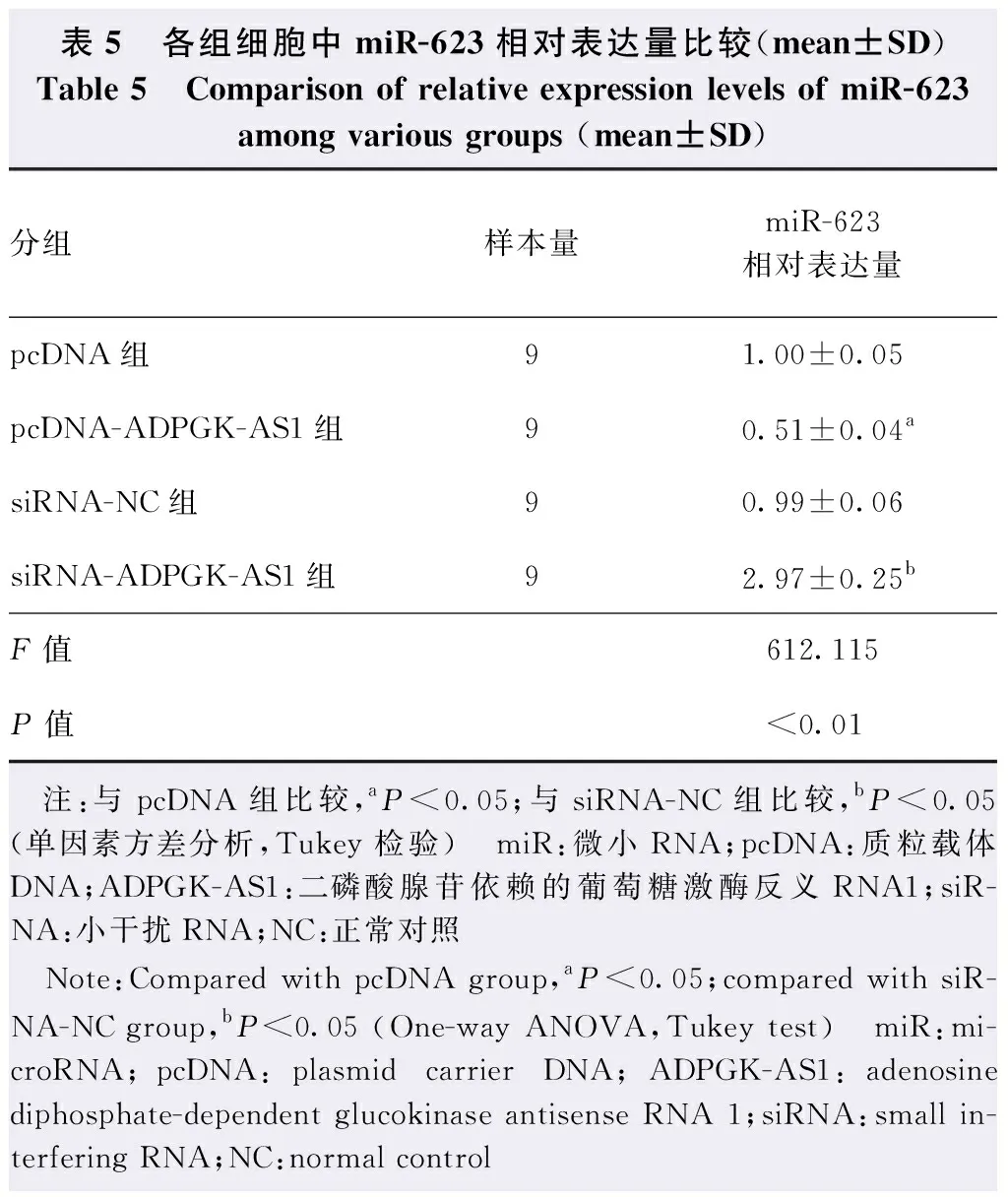
表5 各组细胞中miR-623相对表达量比较(mean±SD)Table 5 Comparison of relative expression levels of miR-623 among various groups (mean±SD)分组样本量miR-623相对表达量pcDNA组91.00±0.05pcDNA-ADPGK-AS1组90.51±0.04asiRNA-NC组90.99±0.06siRNA-ADPGK-AS1组92.97±0.25bF值612.115P值<0.01 注:与pcDNA组比较,aP<0.05;与siRNA-NC组比较,bP<0.05(单因素方差分析,Tukey检验) miR:微小RNA;pcDNA:质粒载体DNA;ADPGK-AS1:二磷酸腺苷依赖的葡萄糖激酶反义RNA1;siR-NA:小干扰RNA;NC:正常对照 Note:Compared with pcDNA group,aP<0.05;compared with siR-NA-NC group,bP<0.05 (One-way ANOVA,Tukey test) miR:mi-croRNA;pcDNA:plasmid carrier DNA;ADPGK-AS1:adenosine diphosphate-dependent glucokinase antisense RNA 1;siRNA:small in-terfering RNA;NC:normal control
2.5 不同miRNA转染组Y-79细胞活力比较
Western blot检测结果显示,miR-623组细胞中Ki-67、MMP-2、MMP-9蛋白表达条带明显弱于miR-NC组,miR-623组Ki-67、MMP-2、MMP-9蛋白相对表达量明显低于miR-NC组,差异均有统计学意义(t=22.137、22.200、21.094,均P<0.01);与miR-NC组比较,miR-623组细胞增生A值降低,差异有统计学意义(t=16.398,P<0.01)。Transwell小室实验结果显示,miR-623组迁移细胞数和侵袭细胞数均明显少于miR-NC组,差异均有统计学意义(t=11.400、17.846,均P<0.01)(图3,表6)。
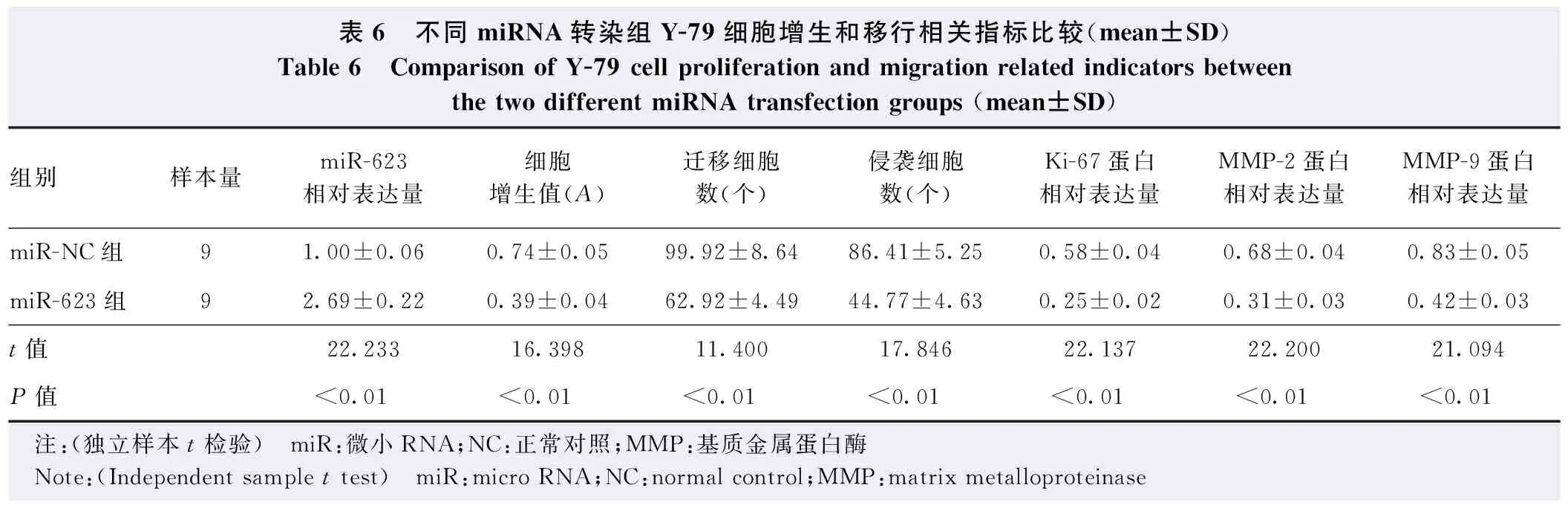
表6 不同miRNA转染组Y-79细胞增生和移行相关指标比较(mean±SD)Table 6 Comparison of Y-79 cell proliferation and migration related indicators between the two different miRNA transfection groups (mean±SD)组别样本量miR-623相对表达量细胞增生值(A)迁移细胞数(个)侵袭细胞数(个)Ki-67蛋白相对表达量MMP-2蛋白相对表达量MMP-9蛋白相对表达量miR-NC组91.00±0.060.74±0.0599.92±8.6486.41±5.250.58±0.040.68±0.040.83±0.05miR-623组92.69±0.220.39±0.0462.92±4.4944.77±4.630.25±0.020.31±0.030.42±0.03t值22.23316.39811.40017.84622.13722.20021.094P值<0.01<0.01<0.01<0.01<0.01<0.01<0.01 注:(独立样本t检验) miR:微小RNA;NC:正常对照;MMP:基质金属蛋白酶 Note:(Independent sample t test) miR:micro RNA;NC:normal control;MMP:matrix metalloproteinase
2.6 miR-623与ADPGK-AS1联合作用下Y-79细胞生物学行为变化
Western blot检测显示,siRNA-ADPGK-AS1+anti-miR-623组细胞中Ki-67、MMP-2和MMP-9蛋白相对表达量均明显高于siRNA-ADPGK-AS1+anti-miR-NC组,差异均有统计学意义(t=20.795、17.493、23.479,均P<0.01)。与siRNA-ADPGK-AS1+anti-miR-NC组比较,siRNA-ADPGK-AS1+anti-miR-623组A值明显升高,差异有统计学意义(t=15.600,P<0.01);siRNA-ADPGK-AS1+anti-miR-623组迁移细胞数及侵袭细胞数明显增多,差异均有统计学意义(t=14.495、17.855,均P<0.01)(图4,表7)。
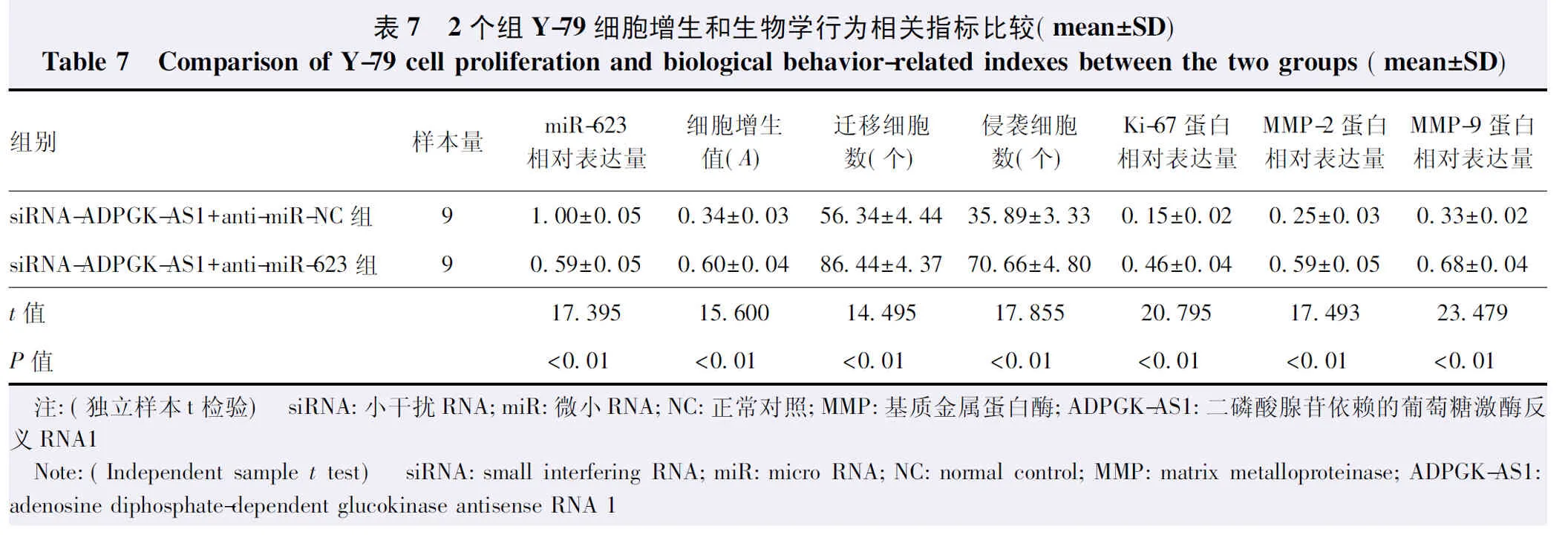
表7 2个组Y-79细胞增生和生物学行为相关指标比较(mean±SD)Table 7 Comparison of Y-79 cell proliferation and biological behavior-related indexes between the two groups (mean±SD)组别样本量miR-623相对表达量细胞增生值(A)迁移细胞数(个)侵袭细胞数(个)Ki-67蛋白相对表达量MMP-2蛋白相对表达量MMP-9蛋白相对表达量siRNA-ADPGK-AS1+anti-miR-NC组91.00±0.050.34±0.0356.34±4.4435.89±3.330.15±0.020.25±0.030.33±0.02siRNA-ADPGK-AS1+anti-miR-623组90.59±0.050.60±0.0486.44±4.3770.66±4.800.46±0.040.59±0.050.68±0.04t值17.39515.60014.49517.85520.79517.49323.479P值<0.01<0.01<0.01<0.01<0.01<0.01<0.01 注:(独立样本t检验) siRNA:小干扰RNA;miR:微小RNA;NC:正常对照;MMP:基质金属蛋白酶;ADPGK-AS1:二磷酸腺苷依赖的葡萄糖激酶反义RNA1 Note:(Independent sample t test) siRNA:small interfering RNA;miR:micro RNA;NC:normal control;MMP:matrix metalloproteinase;AD-PGK-AS1:adenosine diphosphate-dependent glucokinase antisense RNA 1
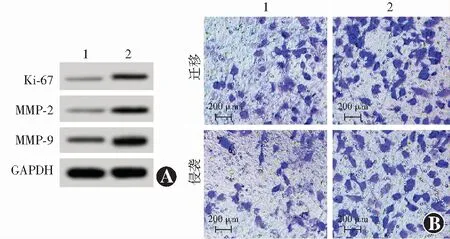
图4 2个组Y-79细胞增生和生物学行为相关指标比较 A:Western blot检测结果显示,siRNA-ADPGK-AS1+anti-miR-623组细胞中Ki-67、MMP-2和MMP-9蛋白表达条带明显强于siRNA-ADPGK-AS1+anti-miR-NC组 B:各组Y-79细胞迁移和侵袭情况比较(结晶紫,标尺=200 μm) siRNA-ADPGK-AS1+anti-miR-623组迁移和侵袭细胞数多于siRNA-ADPGK-AS1+anti-miR-NC组 1:siRNA-ADPGK-AS1+anti-miR-NC组;2:siRNA-ADPGK-AS1+anti-miR-623组 siRNA:小干扰RNA;miR:微小RNA;NC:正常对照;MMP:基质金属蛋白酶;GAPDH:磷酸甘油醛脱氢酶;ADPGK-AS1:二磷酸腺苷依赖的葡萄糖激酶反义RNA1Figure 4 Comparison of Y-79 cell proliferation and biological behavior-related indicators between the two groups A:Western blot assay showed that the protein expression bands of Ki-67,MMP-2 and MMP-9 in the siRNA-ADPGK-AS1+anti-miR-623 group were significantly stronger than those in the siRNA-ADPGK-AS1+anti-miR-NC group B:Y-79 cell migration and invasion between two groups (crystal violet ×200,scale bar=200 μm) The number of migrating and invading cells in the siRNA-ADPGK-AS1+anti-miR-623 group was more than that in siRNA-ADPGK-AS1+anti-miR-NC group 1:siRNA-ADPGK-AS1+anti-miR-NC group;2:siRNA-ADPGK-AS1+anti-miR-623 group siRNA:small interfering RNA;miR:micro RNA;NC:normal control;MMP:matrix metalloproteinase;GAPDH:glyceraldehyde phosphatede hydrogenase;ADPGK-AS1:denosine diphosphate-dependent glucokinase antisense RNA 1
3 讨论
lncRNA在RB细胞增生、迁移及侵袭等生物学过程中发挥重要的调控作用,敲低lncRNAPVT1基因可充当miR-488-3p的海绵分子而抑制RB的进展[18],lncRNA LINC00202通过充当miR-3619-5p的海绵分子而促进RB的进展[19]。沉默lncRNAANRIL基因可通过调节miR-99a/c-Myc而抑制RB细胞的生长并促进其凋亡[20]。LncRNA AFAP1-AS1是一种预后生物标志物,在RB的发生过程中起致癌作用[21]。LncRNA在RB发生及转移过程中的分子机制尚未完全阐明。
研究发现,ADPGK-AS1在骨肉瘤组织中的表达水平升高,并可通过靶向miR-542-3p而促进细胞的增生、侵袭和迁移并抑制其凋亡[22]。此外,ADPGK-AS1在乳腺癌组织中表达水平升高,并可通过调节miR-3196/OTX1分子轴而促进细胞增生、迁移及间质-上皮转化过程[23]。ADPGK-AS1通过充当miR-525的海绵分子而促进结直肠癌的进展[24]。本研究结果显示RB组织中ADPGK-AS1的表达水平明显高于瘤旁组织,进一步研究显示干扰ADPGK-AS1的表达可明显降低细胞活力及Ki-67蛋白水平,提示ADPGK-AS1在RB发生和发展过程中发挥重要调控作用。研究表明,Ki-67在肿瘤组织或细胞中表达水平升高可促进细胞增生[25-28],提示干扰ADPGK-AS1的表达可抑制RB细胞增生。肿瘤细胞迁移及侵袭与细胞外基质沉积有关,MMP-2和MMP-9可降解细胞外基质从而促进细胞迁移及侵袭[29-32]。本研究结果显示,干扰ADPGK-AS1表达后RB细胞迁移及侵袭细胞数明显减少,并可抑制MMP-2、MMP-9的表达,提示干扰ADPGK-AS1表达可抑制RB细胞迁移及侵袭。
本研究证实ADPGK-AS1可竞争性结合miR-623,并可负向调控miR-623的表达。miR-623可抑制肺腺癌的进展[33];其还可抑制乳腺癌细胞增生、迁移及侵袭[34];miR-623靶向细胞周期蛋白D1抑制胃癌中的细胞增生[35]。本研究结果显示,RB组织中miR-623的表达水平降低,miR-623过表达可抑制RB细胞增生、迁移及侵袭,提示miR-623在RB发生和发展过程中发挥重要调控作用。本研究将siRNA-ADPGK-AS1与anti-miR-623共转染至RB细胞,结果显示细胞活力增强,迁移及侵袭细胞数增多,并可促进Ki-67、MMP-2、MMP-9表达,提示抑制miR-623表达可明显逆转干扰ADPGK-AS1表达对RB细胞生物学行为的作用。
综上所述,ADPGK-AS1在RB组织中表达水平升高,而miR-623的表达水平降低,敲低ADPGK-AS1基因可通过靶向上调miR-623的表达而抑制Y-79细胞增生、迁移及侵袭,可能成为RB分子治疗的潜在靶点,还可为进一步揭示RB发生及发展的分子机制提供实验基础。但是,ADPGK-AS1-miR-623的靶基因以及详细调控机制仍需深入研究。
利益冲突所有作者均声明不存在任何利益冲突
作者贡献声明张俊参与研究实施、资料收集、论文写作和修改;刘彩林参与研究实施、文章撰写和修改;卜战云提供课题支持,参与研究选题、研究设计、研究过程指导和论文主要内容的修改和定稿
