黄葵素对糖尿病肾病大鼠氧化应激、炎症反应和TGF-β1/Smad2信号通路的影响
2021-04-10岳薇薇王卫群
岳薇薇,叶 婷,王卫群
(新疆维吾尔自治区中医医院,新疆 乌鲁木齐 830001)
糖尿病肾病的患病率随着全球糖尿病人群规模的扩大而增高。据报道,1/3的糖尿病患者会发展为糖尿病肾病[1]。糖尿病肾病的现有治疗方法主要为控制血糖、血脂、血压以及改变生活方式,但近50%的糖尿病肾病患者不可避免地会发展为终末期肾病,这不仅给患者带来身体上的痛苦,而且导致沉重的经济负担[2-3]。因此,迫切需要探索糖尿病肾病的发病机制和新的治疗方法。TGF-β1是导致纤维化的关键细胞因子,可通过增加细胞外基质的形成促进肾小球硬化和肾小管间质纤维化[4],Smad2是TGF-β信号通路的下游效应转录因子[5]。研究表明,TGF-β/Smad信号通路参与了糖尿病肾病的发病,可能是治疗糖尿病肾病的有效靶点[6-7]。黄葵素为黄蜀葵花的提取物,具有清热利湿、活血通络的功效,其可通过减少肾组织内巨噬细胞浸润及抑制促炎的M1型巨噬细胞极化缓解db/db小鼠肾脏炎症反应,改善肾功能及肾纤维化[8]。本研究探讨了黄葵素对糖尿病肾病大鼠氧化应激、炎症反应和TGF-β1/Smad2信号通路的影响,旨在进一步明确其作用机制。
1 实验材料与方法
1.1动物 60只成年雄性Wistar大鼠,SPF级,体重200~220 g,购自北京维通利华实验动物技术有限公司[实验动物许可证号:SCXK(京)2012-0001]。实验大鼠饲养于标准动物房中,正常饮食饮水,实验动物设计严格经过我院伦理委员会审查。大鼠适应环境2周后进行实验。
1.2试剂 黄葵素购自湖南省中医药研究院。链脲佐菌素(STZ)购自美国Sigma公司。血清肌酐(SCr)和尿素氮(BUN)测定试剂盒购自瑞士罗氏公司。尿蛋白定量试剂盒购自南京建成生物工程研究所。白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)检测试剂盒购自南京凯基生物科技有限公司。丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)检测试剂盒购自南京凯基生物科技有限公司。HE染色试剂盒、DAB显色试剂盒、Masson染色试剂盒和免疫组织化学试剂盒购自北京索莱宝生物科技有限公司。RIPA裂解液和BCA试剂盒购自美国promega公司。兔抗TGF-β1抗体、兔抗p-Smad2抗体、兔抗Smad1抗体、β-actin抗体和山羊抗兔IgG抗体购自美国Cell Signaling Technology公司。
1.3实验方法 将Wistar大鼠随机分为对照组、糖尿病肾病组、黄葵素低剂量组和黄葵素高剂量组,每组15只。对照组饲喂普通饲料,其余组参考文献[9]方法,经腹腔注射STZ 30 mg/kg,72 h后从尾静脉收集血液并测定血糖,如果血糖≥16.7 mmol/L则认为糖尿病模型成功。大鼠继续喂食高糖高脂饮食,定期测量血糖,4周后,如果24 h尿蛋白>20 mg且尿液葡萄糖呈阳性,则认为糖尿病肾病模型成功。造模成功后第2天,黄葵素低剂量组和黄葵素高剂量组分别给予黄葵素75 mg/kg和150 mg/kg灌胃(给药剂量换算参考文献[10]),对照组和糖尿病肾病组给予生理盐水灌胃,均4mL/kg,1次/d,连续8周。
1.4检测指标与方法
1.4.1空腹血糖(FPG)、24 h尿蛋白测定 末次灌胃结束后,各组大鼠禁食(自由饮水)一晚,第2天早晨取大鼠尾静脉血,使用血糖仪测定FPG;使用代谢笼收集各组大鼠24 h尿液,采用双缩脲法测定24 h尿蛋白量,24 h尿蛋白量=尿蛋白浓度×24 h尿量。
1.4.2血清SCr、BUN及炎症因子水平测定 末次灌胃结束,各组大鼠经3%戊巴比妥钠麻醉后,于腹主动脉取血,置于离心管中,3 000 r/min离心15 min,吸取上层血清,应用全自动生化分析仪检测血清SCr和BUN水平,按照ELISA试剂盒说明书检测血清IL-1β、TNF-α、IL-6水平。
1.4.3肾组织HE染色病理观察 取大鼠肾组织,在10%中性甲醛溶液中固定至少24 h,常规脱水、二甲苯透明、浸蜡、石蜡包埋,并制成4 μm的石蜡切片。切片放入苏木素染液中5 min,自来水清洗后,置于1%的盐酸酒精分化数秒,并用流水冲洗。切片放入伊红染液中染色3 min,流水稍洗。之后切片置于梯度乙醇中脱水,各5 min,再放入二甲苯Ⅰ、Ⅱ中透明,分别5 min。将切片取出,用滤纸轻轻拭干切片上残余的二甲苯,在组织上滴加中性树胶封片,使用莱卡显微镜进行拍摄。
1.4.4肾组织Masson染色观察 取大鼠肾组织,经OCT包埋,制成6 μm的冰冻切片;切片置于苏木素中染色5 min,纯净水清洗;再滴加Masson蓝化液返蓝3~5 min,纯净水清洗;滴加一滴磷钼酸染液染色12 min,用滤纸吸去多余染液;滴加一滴苯胺蓝染色8 min后,纯净水清洗切片2 min;滴加一滴1%的醋酸孵育4 min。冲洗,用中性树胶封片,显微镜观察并拍照。蓝色组织表示肾组织纤维化,红色组织表示肾组织正常。
1.4.5肾组织免疫组织化学染色观察 取大鼠肾组织石蜡切片,脱水,缓冲液清洗,3%过氧化氢溶液去除内源性过氧化物酶,滴加非免疫动物血清20 min,滴加一抗,PBS冲洗,滴加二抗,冲洗后加ABC复合物,DAB显色,中性树胶封片。在显微镜下观察,用MIAS图像分析系统分析,按照免疫组化染色阳性细胞数在每一高倍视野中所占比例依次统计。目标蛋白呈棕黄色则为阳性表达。
1.4.6肾组织中氧化应激指标表达水平测定 将大鼠肾组织放入到9倍体积的PBS中,用匀浆器分散到匀浆中,在4 ℃下以3 000 r/min 离心15 min,收集上清液。按照ELISA试剂盒说明书进行操作,用酶联仪在450 nm波长处测定各孔的光密度(OD值),根据OD值所绘制的标准曲线查出肾组织中MDA、SOD和GSH表达水平。
1.4.7肾组织中TGF-β1和p-Smad2蛋白表达Western blot检测取大鼠肾组织100 mg,用RIPA裂解提取总蛋白,用BCA法测定总蛋白含量。用SDS-聚丙烯酰胺凝胶电泳分离蛋白,并转移到PVDF膜上。在室温下用5%脱脂奶封闭1 h后,将PVDF膜与以下抗体在4 ℃孵育过夜:兔抗TGF-β1抗体(1∶1 000)、兔抗p-Smad2抗体(1∶1 000)、兔抗Smad2抗体(1∶1 000) 和兔抗β-actin抗体(1∶2 000)。随后,将PVDF膜用TBST洗涤3次,持续5 min,并与山羊抗兔IgG-HRP(1∶5 000)孵育1 h,用TBST洗涤3次,持续5 min。最后显影曝光,用Image-Pro Plus图像分析系统对蛋白条带的灰度值进行分析。
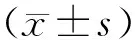
2 结 果
2.1各组大鼠FPG、SCr、BUN水平和24 h尿蛋白量比较 在实验过程中糖尿病肾病组1只大鼠死亡。与对照组比较,糖尿病肾病组大鼠FPG、SCr、BUN水平及24 h尿蛋白量均明显升高(P均<0.05);与糖尿病肾病组比较,黄葵素低、高剂量组大鼠FPG、SCr、BUN水平及24 h尿蛋白量均明显降低(P均<0.05),且黄葵素高剂量组均明显低于黄葵素低剂量组(P均<0.05)。见表1。
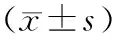
表1 各组大鼠FPG、SCr、BUN水平和24 h尿蛋白量比较
2.2各组大鼠血清中炎性因子水平比较 与对照组比较,糖尿病肾病组大鼠血清中IL-1β、TNF-α、IL-6水平明显升高(P均<0.05);与糖尿病肾病组比较,黄葵素低、高剂量组大鼠血清中IL-1β、TNF-α、IL-6水平均明显降低(P均<0.05),且黄葵素高剂量组均明显低于黄葵素低剂量组(P均<0.05)。见表2。
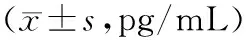
表2 各组大鼠血清中IL-1β、TNF-α、IL-6水平比较
2.3各组大鼠肾组织病理表现 HE染色显示,对照组大鼠肾小球结构完整,基质和系膜未见异常变化,肾小管结构完整;糖尿病肾病组大鼠肾组织坏死明显,肾小球萎缩,肾小管上皮细胞大量变性,并可见大量炎性细胞;黄葵素低、高剂量组大鼠肾小球基底膜增厚程度明显改善,肾小球系膜基质增生程度明显减轻。见图1。
2.4各组大鼠肾组织纤维化情况 Masson染色显示,对照组大鼠肾小球基底膜和肾小管间质中可见微量胶原;糖尿病肾病组大鼠肾小球和肾小管中观察到大量蓝色的胶原纤维;黄葵素低、高剂量组大鼠的肾小球和肾小管间质中的胶原纤维均少于糖尿病肾病组。见图2。
2.5各组大鼠肾组织中TGF-β1表达情况 免疫组织化学染色显示,对照组、糖尿病肾病组、黄葵素低剂量组、黄葵素高剂量组大鼠肾组织中TGF-β1阳性表达率分别为4.37%、43.18%、37.51%、28.94%,糖尿病肾病组明显高于对照组(P<0.05),黄葵素低、高剂量组明显低于糖尿病肾病组(P均<0.05),且黄葵素高剂量组明显低于黄葵素低剂量组(P<0.05)。见图3。
2.6各组大鼠肾组织中氧化应激指标表达水平比较 与对照组比较,糖尿病肾病组大鼠肾组织中MDA表达水平明显升高(P<0.05),SOD和GSH表达水平明显降低(P均<0.05);与糖尿病肾病组比较,黄葵素低、高剂量组大鼠肾组织中MDA表达水平均明显降低(P均<0.05),SOD和GSH表达水平均明显升高(P均<0.05),且黄葵素高剂量组各指标较黄葵素低剂量组变化更明显(P均<0.05)。见表3。
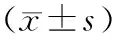
表3 各组大鼠肾组织中MDA、SOD和GSH表达水平比较
2.7各组大鼠肾组织中TGF-β1和Smad2蛋白表达水平比较 与对照组比较,糖尿病肾病组大鼠肾组织中TGF-β1蛋白表达水平和Smad2蛋白的磷酸化水平均明显增高(P均<0.05);与糖尿病肾病组比较,黄葵素低、高剂量组大鼠肾组织中TGF-β1蛋白表达水平和Smad2蛋白的磷酸化水平均明显降低(P均<0.05),且黄葵素高剂量组均明显低于黄葵素低剂量组(P均<0.05)。见图4。
3 讨 论
糖尿病肾病的主要特征为蛋白尿、肾小球滤过减少、肾肥大和肾小管间质纤维化[11-12],其发生机制仍不明确,目前干预措施不能有效阻止疾病进展,因此研究糖尿病肾病的分子机制并寻找有效的治疗方法至关重要。
目前研究证实炎症和氧化应激与该病的发生发展密切相关,其中炎症因子IL-1β、TNF-α、IL-6在糖尿病肾病发病中起重要作用[13]。氧化应激标记物可反映体内氧化应激水平,氧化应激标志物的测定在揭示糖尿病的发生和发展与氧化应激的相关性中起着重要作用[14-15]。TGF-β1是致器官纤维化作用最强的促纤维化始动因子,是糖尿病肾病发病发展过程中起关键作用的重要信号通路之一[16]。研究发现,TGF-β/Smads信号通路在糖尿病肾病中被过度激活,TGF-β1激活受体调节的Smad2,后者与Smad4相互作用并易位至细胞核以调节靶基因的表达,在肾小球膜细胞增殖和细胞外基质沉积中起着重要作用[17-19]。
本实验中发现,糖尿病肾病大鼠血清IL-1β、TNF-α、IL-6水平明显升高,肾组织坏死明显,肾小球萎缩,肾小管上皮细胞大量变性,并可见大量炎性细胞,且肾小球和肾小管中观察到大量蓝色的胶原纤维,肾组织中大量TGF-β1阳性表达,肾组织中MDA水平、TGF-β1蛋白表达水平和Smad2蛋白的磷酸化水平显著升高,而SOD和GSH水平明显降低。说明糖尿病肾病大鼠存在明显炎症反应和氧化应激反应,肾组织损伤,与上述文献报道一致。
黄葵素是由黄蜀葵花醇提获得,主要成分为黄蜀葵花总黄酮。既往研究发现,黄葵素可减轻糖尿病肾病尿蛋白,具有明显肾保护作用,机制可能与抑制NF-κB p65炎性反应信号通路及促炎因子释放有关[10]。钱晓翠[20]研究报道,黄葵素干预可降低糖尿病肾病大鼠血糖、尿蛋白含量,其可能通过抑制肝素结合表皮生长因子样生长因子(HB-EGF)的表达而发挥肾保护作用 。本实验研究发现,黄葵素干预后,糖尿病肾病大鼠FPG、SCr、BUN、24 h尿蛋白量、IL-1β、TNF-α、IL-6水平及肾组织中MDA水平、TGF-β1蛋白表达水平、Smad2蛋白的磷酸化水平均明显降低,而SOD和GSH水平均明显升高,提示黄葵素能改善糖尿病肾病大鼠肾功能,减轻炎症反应和氧化应激损伤,抑制TGF-β1/Smad2通路的激活。
综上所述,TGF-β1/Smad2信号通路与糖尿病肾病之间存在相关性,黄葵素可减轻炎症反应、氧化应激,抑制TGF-β1/Smad2通路的激活,从而改善糖尿病肾病的病情,保护肾功能。
利益冲突:所有作者均声明不存在利益冲突。
