甘草与厚朴复配物对变异链球菌及生物膜形成的抑制作用
2021-04-10蔡昀盈吴梦琪宋金星张文清
蔡昀盈, 吴梦琪, 夏 玮, 宋金星, 张文清
(华东理工大学化学与分子工程学院,上海 200237)
甘草是豆科植物,属多年生草本,是一种补益中草药,种类以光果甘草(Glycyrrhiza glabra)和乌拉尔甘草(Glycyrrhiza uralensis Fisch)为代表,甘草中含量较高的有效成分[1]主要分为皂苷类、黄酮类、异黄酮类、查耳酮类和香豆素类化合物,表现为抗菌、抗感染、抗溃疡及抗肿瘤[2]等活性。
厚朴是木兰科、木兰属植物,化学成分复杂,以木脂素及其衍生物为主,其中厚朴酚(Magnolol)与和厚朴酚(Honokiol)的含量最高。诸多研究表明,厚朴酚与和厚朴酚[3]具有促进肠胃蠕动、缓解焦虑、抗菌[4]、抗炎、抗肿瘤等功能,对心脑血管疾病等有一定的疗效。
龋病是一种慢性疾病,细菌定植于牙面过程中,牙面的牙菌斑内部多种细菌协调共生形成细菌群,这种群体称为生物膜[5]。早期采用抗生素治疗龋病和抑制生物膜形成虽有一定效果,但长期使用易引起耐药和菌群失调而诱发其他疾病,故中草药及其活性成分的抗龋和抑制生物膜形成效果引起了人们的关注。
近年来的研究表明,甘草中的某些活性化合物对与口腔感染相关的多种疾病具有明确的治疗效果。例如,甘草次酸[6]对口腔念珠菌病和牙周组织病有明显的疗愈作用,可降低口腔疾病的发病频率。紫檀烯类物质甘草茎醇A 已被证实对龋病有明显的抑制作用[1],它对链球菌的抑菌情况极好。研究发现,厚朴中的厚朴酚及和厚朴酚[7]对致龋菌变异链球菌有很强的抑制作用。但目前,甘草和厚朴针对口腔疾病的研究[8]大多集中于有效成分的筛选和抑菌情况的测定,两者复配效果及其对牙齿上生物膜形成的抑制功效鲜见研究。
本文考察了甘草和厚朴的乙醇提取物对常见致龋菌变异链球菌的抑菌活性,以及醇提物复配后的抑菌效果、对乳酸脱氢酶(Lactic Dehydrogenase, LDH)活性的影响和生物膜形成的抑制作用,为甘草和厚朴的复配物能够应用于防龋功效型口腔膏提供理论依据。
1 材料与仪器
1.1 原料与试剂
乌拉尔甘草(Glycyrrhiza uralensis Fisch),购于康美药业股份有限公司,产自内蒙古;厚朴(Magnolia officinalis),购于康美药业股份有限公司,产自四川;茶多酚,试剂级,天津希恩思生化科技有限公司;乙醇、氯化钠,均为分析纯,上海科化实验器材有限公司;乳酸脱氢酶活性检测试剂盒,北京索莱宝科技有限公司;结晶紫,分析纯,阿拉丁试剂(上海)有限公司;pH=7.4 磷酸盐缓冲液,上海麦克林生化科技有限公司;营养琼脂,生物试剂,北京三药科技开发公司;脑心浸出液肉汤培养基(Brain Heaet Infusion, BHI),生物试剂,Oxiod CM225。
1.2 仪器
EA104 分析天平,梅特勒-托利多仪器(上海)有限公司;DK-S24 电热恒温水浴锅,上海精宏实验设备有限公司;SYQ-DSX-280B 手提式压力蒸汽灭菌器,上海申安医疗器械厂;LRH-150 生化培养箱,上海一恒科学仪器有限公司;SW-CJ-2F 超净工作台,苏州净化设备有限公司;Thermo Scientific1029厌氧培养箱,赛默飞世尔科技公司;THZ-98AB 恒温振荡器,上海一恒科学仪器有限公司。
1.3 实验菌种
变异链球菌(Streptococcus mutans,SM,UA159),购自Microbiologics 公司。
2 实验方法
2.1 甘草和厚朴提取物的制备
甘草与厚朴药材分别在40 ℃烘干,过60 目(250 μm)筛子。称取20 g 中草药粉,按料液比1∶8(g/mL)加入纯乙醇[9-14]作为提取剂,经55 ℃、1.5 h水浴回流提取,趁热过滤,再加入相同体积提取剂,在100 Hz、55 ℃条件下超声20 min,过滤合并两次滤液,旋蒸、浓缩、冷冻、干燥,得到甘草乙醇提取物(G-EA)和厚朴乙醇提取物(M-EA),置于4 ℃冰箱中备用。
2.2 菌悬液的制备
用接种环取保存于−80 ℃的变异链球菌菌种适量,以“Z”字形轻轻地均匀涂布在已消毒灭菌的BHI 琼脂固体培养基上,于37 ℃下厌氧培养48 h,待平板上长出淡黄色链球菌[15],用灭菌的接种环取单菌落置于10 mL BHI 液体培养基中,于37 ℃下厌氧培养24 h,取适量培养液与BHI 液体培养基以1∶19 的体积比混合,配制成5%(体积分数)的变异链球菌混合液,再于37 ℃下厌氧培养15 h,即得1×108CFU/mL 的菌液,备用。
2.3 抑菌活性测定
采用牛津杯法测定提取物的抑菌活性[16]。取菌悬液加至已灭菌的BHI 固体培养基中并摇匀,使最终菌浓度约为106CFU/mL。将培养基倒入培养皿中,在超净台中冷却至完全凝固,放置适量直径为9 mm的牛津杯,选用纯乙醇作溶剂,采用倍半稀释法配制一系列质量浓度分别为0.5、1.0、2.0、4.0 g/L 的G-EA和M-EA,以及两者以质量比1∶1 复配成的甘草-厚朴复配物(G-M1∶1),向牛津杯中加入200 μL 待测样品,在37 ℃下厌氧培养24 h,用十字交叉法测定抑菌圈直径,以“x ± s(平均值±标准差)”表示数据。以纯乙醇为空白对照,重复3 次平行实验。
2.4 最小抑菌浓度(MIC)测定
用牛津杯法测定最小抑菌浓度(Minimum Inhibitory Concentration, MIC)[17]。将甘草提取物用纯乙醇进行逐级稀释,配制最终质量浓度为4.60、2.30 、1.15、0.58 g/L 的样品;将厚朴提取物用纯乙醇进行逐级稀释,配制最终质量浓度为2.20、1.10、0.55 、0.28 g/L 的样品。将备用的质量浓度为108CFU/mL的变异链球菌菌悬液与BHI 培养基以1∶999 体积比混合,在超净台中冷却至完全凝固,放置适量牛津杯,注入200 μL 样品,在37 ℃下厌氧培养24 h。以溶剂为空白对照,重复3 次平行实验。
2.5 联合药敏试验
采用棋盘法在培养皿中进行联合药敏试验[18],如图1 所示。用纯乙醇溶解G-EA,配制浓度为2 MIC,逐级稀释至最终浓度为1/32 MIC,从最右列开始往左分别加药;用纯乙醇溶解M-EA,配制浓度为2 MIC,逐级稀释至最终浓度为1/32 MIC,从最上排开始向下分别加药,加药时按1∶1 质量比取甘草和厚朴提取物溶液。将108CFU/mL 菌悬液与BHI 培养基以1∶999体积比混合,在超净台中冷却至完全凝固,放置于适量牛津杯中,注入200 μL 混合液,在37 ℃下厌氧培养24 h,观察抑菌情况。重复3 次平行实验。
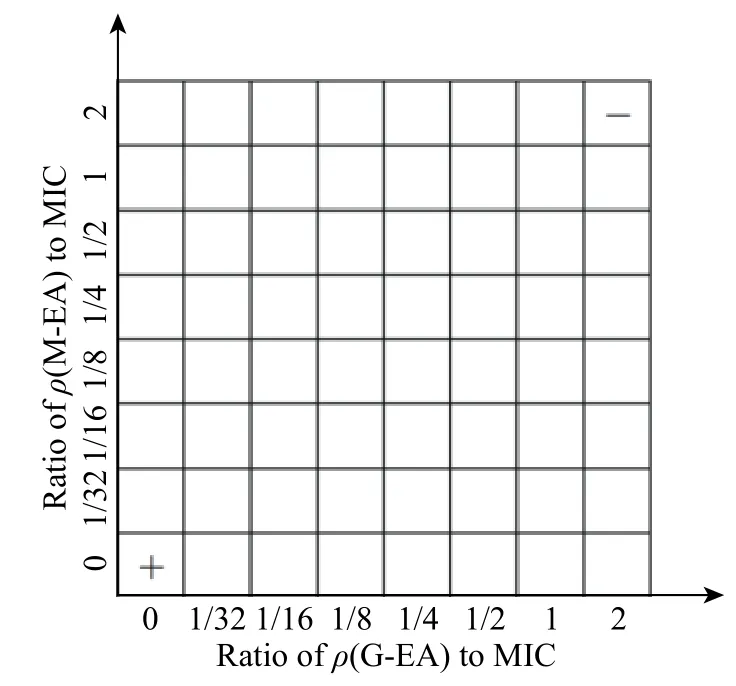
图1琼脂棋盘稀释法简易示意图Fig.1Schematic diagram of simplified checkerboard testing technique
2.6 不同质量比的甘草和厚朴提取物复配
G-EA 和M-EA 按照不同质量比(m(G-EA)∶m(M-EA)=3∶1、2∶1、1∶1、1∶2、1∶3)进行复配,分别得到5 种甘草与厚朴复配物G-M3∶1,GM2∶1,G-M1∶1,G-M1∶2,G-M1∶3,将每种复配物逐级稀释,使其最终总质量浓度分别为2.56、1.28、0.64、0.32、0.16 g/L,测定不同质量比复配物的MIC。
2.7 G-M1∶2 对变异链球菌生长的影响
将培养至对数生长期的变异链球菌菌悬液,调节至约107CFU/mL。茶叶中的茶多酚是天然防龋物质[19-21],具有抑菌作用和防龋效果,故选择茶多酚作为阳性实验材料。准备3 份2 mL 菌悬液与18 mL 已灭菌的BHI 液体培养基[18]的混合液,一份加入3.2 mg G-M1∶2使其最终质量浓度为0.5 MIC,另一份加入3.2 mg 茶多酚作阳性对照试验,最后一份不加任何抑菌物质作为空白对照组。在37 ℃的恒温振荡器中厌氧培养,分别于培养0、3、6、9、12、24 h 时刻通过平板计数法测定菌浓度,绘制变异链球菌生长曲线。重复3 次平行实验。
2.8 G-M1∶2 对变异链球菌中乳酸脱氢酶LDH 的活性影响
用消毒灭菌的BHI 液体培养基作为溶剂,配制质量浓度分别为0.16 g/L(1/2 MIC)、0.08 g/L(1/4 MIC)和0.04 g/L(1/8 MIC)的G-M1∶2溶液。设置消毒灭菌的BHI 液体培养基(不含任何药物)作为对照组。每组实验设置3 个平行管[22]。
将培养至对数生长期的菌悬液,调节至约107CFU/mL,取1 mL 菌悬液加入10 mL 不同质量浓度的G-M1∶2培养基溶液中,在37 ℃下厌氧培养18 h。收集细菌混合液到离心管内,离心后弃上清液,按照细菌数量与提取液体积的比例为5×106∶1(即500 万细菌加入1 mL 提取液)加入提取液。超声破碎细菌(冰浴,功率200 W,超声3 s,间隔10 s,重复30 次);在8000r/min、4 ℃下离心10 min,取上清液,置冰上待测[23]。取100 μL 丙酮酸钠标准溶液(2 μmol/mL),倍比稀释得浓度为1、0.5、0.25、0.125、0 μmol/mL 的系列溶液。
按照乳酸脱氢酶活性测试试剂盒说明书进行操作,充分混匀,室温下静置3 min,取200 μL 转移至96 孔板,用酶标仪在450 nm 下测定吸光度(OD),记录不同浓度标准管的吸光度;记录测定管、对照管的吸光度(每个测定管需要设一个对照管),计算△OD=OD测定管−OD对照管。将计算得到的△OD 代入丙酮酸钠标准溶液回归方程中的x,计算y 值,即为样品中丙酮酸的含量。
细菌中LDH 活力的计算公式如下:

式中:Vsample为反应体系中加入的样本体积,10 μL;VNAD为加入的提取液体积,1 mL;t 为反应时间,15 min。每1 万个细菌每分钟催化产生1 nmol 丙酮酸定义为一个酶活力单位。
2.9 G-M1∶2 对变异链球菌生物膜形成的抑制作用
鉴于四氟乙烯磁性搅拌子表面光滑,侧面有棱,形状和表面特性似牙齿,故选用与牙齿大小相似的直径为5 mm、长度为10 mm 的搅拌子模拟牙齿。
取6 个长度为10 mm、直径为5 mm 的磁性搅拌子模拟牙齿[15],在无菌水中煮沸、灭菌、冷却后风干,放入1.5 mL 离心管中。准备适量唾液,在4 ℃,6000r/min转速下离心15 min,用0.22 μm 水相无菌滤头过滤,取上清液,在每个1.5 mL 离心管中加入400 μL唾液上清液,在室温下振荡孵育4 h。
取出磁性搅拌子,在0.01 mol/L、pH=7.4 的磷酸盐缓冲液(PBS)中轻轻刷洗2~3 次,待其风干后放入24 孔板,加入1.6 mL BHI 培养液、200 μL变异链球菌液(108CFU/mL)和400 μL 不同质量浓度(1.28、0.64、0.32、0.16、0.08、0.04、0.02、0.01 g/L)的G-M1∶2水溶液,此为药物组。以无菌水取代G-M1∶2水溶液,此为对照组。将24 孔板放至37 ℃培养箱中厌氧培养24 h。
24 h 后取出磁性搅拌子,在PBS 中轻轻刷洗2~3 次,待其风干后放入干净的24 孔板,加入2 mL、w=0.1%结晶紫溶液,染色15 min,取出磁性搅拌子,在PBS 中轻轻刷洗至表面只余少量结晶紫,待其风干后放至1.5 mL 离心管中,加入350 μL 无水乙醇,浸没15 min;放置涡旋振荡仪上高速旋转,取出磁性搅拌子,转移200 μL 液体至96 孔板,在570 nm 波长下用酶标仪测OD 值。
以上实验平行做3 次。
DOU Hong-wei, WANG Guo-wei, CHEN Liang, LI Pan, KAN Tong, QIN Yong-wen
3 结果与讨论
3.1 甘草和厚朴提取物对变异链球菌的抑菌效果
如图2 所示,当质量浓度为0.5 g/L 时,G-EA 和M-EA 的抑菌圈直径为9 mm,与牛津杯外径保持一致,说明牛津杯外无抑菌区域,故0.5 g/L 的G-EA 和M-EA 无抑菌性。当质量浓度增加至1 g/L 时,M-EA抑菌圈直径为(11.4±0.3)mm,直径大于牛津杯外径,开始出现抑菌性,相同质量浓度下G-EA 抑菌圈直径为9 mm,仍无抑菌性。当质量浓度增加至2 g/L 时,G-EA开始出现抑菌性,证明M-EA 抑菌性略优于G-EA。
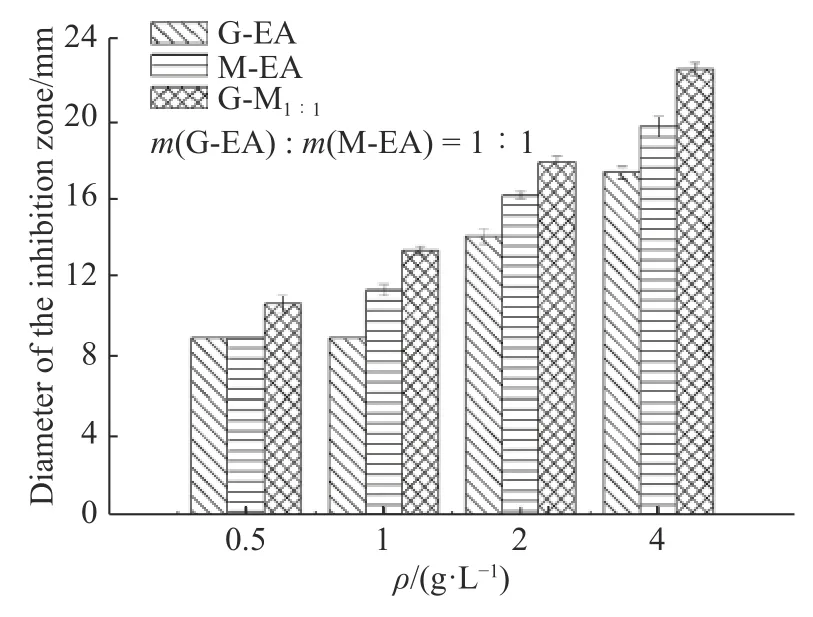
图2厚朴、甘草的提取物和复配物的抑菌效果Fig.2Inhibitory effects of different extracts and compounds of Glycyrrhiza uralensis Fisch and Magnolia officinalis
将相同质量浓度的G-EA、M-EA 和1∶1 复配得到的复配物G-M1∶1进行抑菌活性比较,结果表明相同质量浓度下,G-M1∶1对变异链球菌的抑菌圈直径均大于单独使用的G-EA 和M-EA,证明复配物抑菌性更佳。
3.2 甘草和厚朴提取物的协同作用
MIC 能直观反映抑制细菌生长的最低质量浓度。实验测得G-EA 和M-EA 单独对变异链球菌抑菌的MIC 分别为1.15 g/L 和0.55 g/L,证明两种提取物均具有良好的抑菌活性。空白对照菌体生长良好。
对G-EA 和M-EA 这两种提取物进行体外联合药敏试验,按照2.5 节中的棋盘法读取无菌生长的最低浓度点,由此点对应的X 和Y 轴浓度分別为MICa和MICb,表示G-EA 与M-EA 复配时各自的MIC 值。而G-EA 和M-EA 单独抑菌时的MIC 值记为A 和B,通过部分抑菌浓度指数(Fractional Inhibitor Concentration,FIC)的计算判断提取物间的相互作用结果,公式如下:
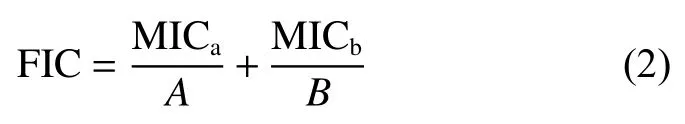
当FIC<1 时,G-EA 和M-EA 之间为协同作用;当FIC=1 时,G-EA 和M-EA 之间为相加作用;当1
通过计算FIC 值可评估两种物质之间的相互关系。由表1 可知,G-EA 与M-EA 复配时G-EA 的MIC为0.288 g/L, M-EA 的MIC 为0.069 g/L;G-EA 和MEA 单独抑菌时MIC 分别为1.15 g/L 和0.55 g/L,即A 和B 分别为1.15 g/L 和0.55 g/L。通过FIC 的计算公式可得G-EA 和M-EA 对变异链球菌的FIC 值为0.375,FIC 小于1 证明G-EA 和M-EA 之间具有协同作用。

表1G-EA 和M-EA 联合药敏试验的MICTable1MIC of G-EA and M-EA in FIC test
表2 所示为甘草和厚朴质量比不同时复配物的MIC。由表2 可知,G-EA 和M-EA 的质量比为1∶2时得到的复配物对变异链球菌的MIC 最小,为0.32 g/L。故综合来看,复配时G-EA 和M-EA 的最佳质量比为1∶2。
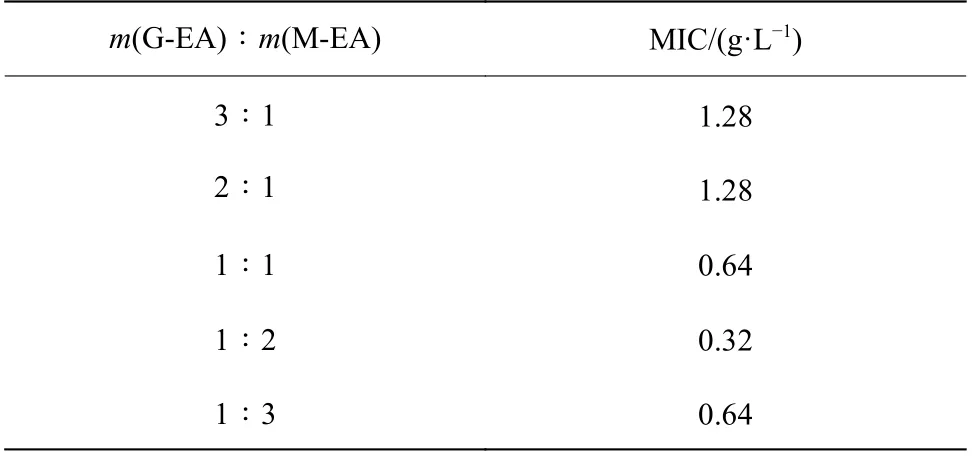
表2甘草和厚朴质量比不同时复配物的MICTable2MIC of different mass ratios of G-EA and M-EA
3.3 G-M1∶2 对变异链球菌生长的影响
为了研究G-M1∶2对变异链球菌生长周期的影响,考察了质量浓度为1/2 MIC(0.16 g/L)时的G-M1∶2和相同浓度的茶多酚对变异链球菌的生长抑制曲线,初步说明其主要抑制阶段。如图3 所示,0~3 h 是细菌的对数生长期,空白组细菌快速增殖,药物组和阳性对照组中细菌也有增殖,但生长速度明显低于空白组,说明G-M1∶2和茶多酚能有效抑制细菌生长;3~24 h 是细菌生长的稳定期,空白组中细菌数量缓慢增长,药物组和阳性对照组中细菌数量逐渐下降,证明在后期G-M1∶2和茶多酚也能很好地抑制细菌生长,但0.16 g/L 的G-M1∶2对变异链球菌的抑菌效果明显优于0.16 g/L 茶多酚对照组。
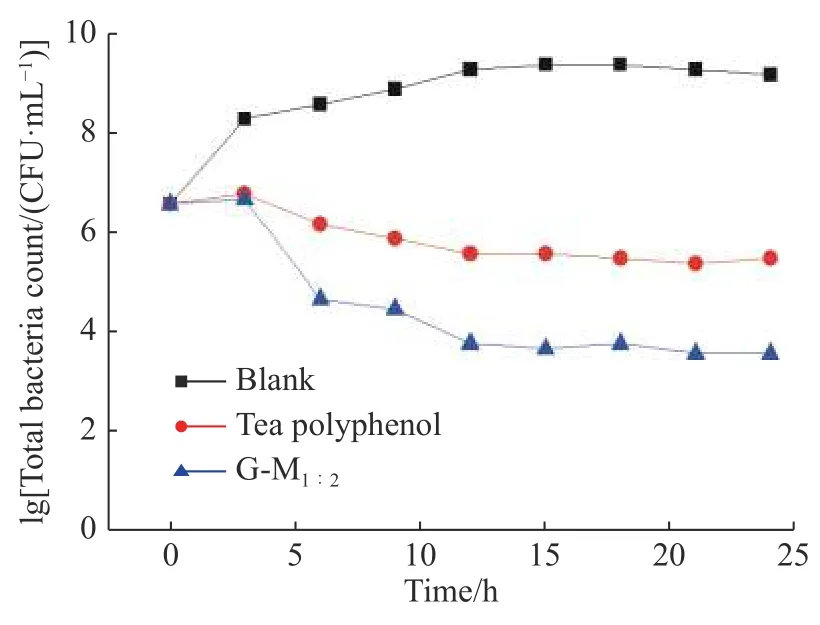
图3G-M1∶2 和茶多酚对变异链球菌的生长抑制曲线Fig.3Effects of G-M1∶2 and tea polyphenol on the growth of Streptococcus mutans
3.4 G-M1∶2 对变异链球菌中乳酸脱氢酶(LDH)活性的影响
乳酸脱氢酶由ldh 基因编码,是参加糖代谢的关键酶。当变异链球菌与外源性糖接触时,丙酮酸在LDH 的催化下反应生成乳酸,乳酸腐蚀牙齿引起牙釉质脱矿,最终致龋[24]。因此LDH 在龋齿的防治上有重要的意义,如果能降低LDH 活性,就可有效抑制牙齿菌斑上乳酸的产生和釉质的脱矿,从而达到防龋的目的。
在一定质量浓度范围内,吸光度与吸光物质的浓度成正比,故以丙酮酸标准溶液浓度为纵坐标,吸光度为横坐标作图,标准曲线如图4 所示,得到标准曲线的回归方程为y=5.668 3x−0.0296(R2=0.999)。
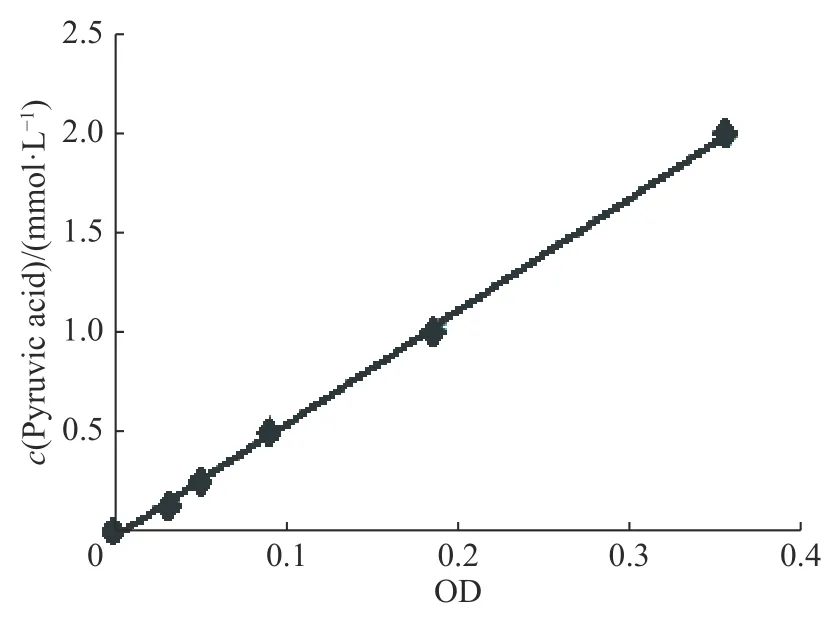
图4丙酮酸标准溶液曲线Fig.4Standard curve of pyruvic acid
将实验数据OD 值结合公式(1)和标准曲线方程进行计算后得到LDH 活性,如表3 所示,与空白组相比,G-M1∶2药物组能有效抑制变异链球菌中乳酸脱氢酶(LDH)的活性,且随着G-M1∶2质量浓度由0.04 g/L (1/8MIC)增大至0.16 g/L(1/2MIC),LDH 酶活性持续减弱。
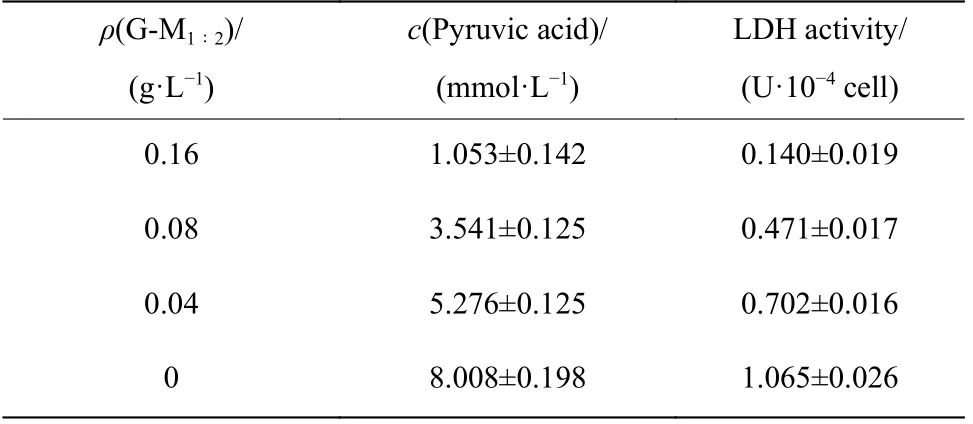
表3G-M1∶2 对变异链球菌中乳酸脱氢酶活性的影响Table3Effects of G-M1∶2 to LDH of Streptococcus mutans
3.5 G-M1∶2 对变异链球菌生物膜形成的抑制作用
口腔细菌通过特定的分子作用附着到牙釉质上,形成牙获得性膜,在外源性糖的作用下慢慢形成牙菌斑生物膜,内源性细菌如变异链球菌与生物膜内的微生物相互作用,在多种致病因素的驱使下生物膜生态开始失衡,细菌开始对牙齿周围组织造成侵害,引发各类口腔疾病,如龋病和牙周炎。同时产生弱有机酸代谢物,导致局部pH 值下降,最终引起牙齿脱矿导致龋病[25]。因此有效抑制生物膜形成、抑制致病菌对于防龋治龋具有重要意义。
生物膜抑制率等于对照组与药物组吸光度的差值除以对照组的吸光度,图5 示出了根据实验数据及上述计算得到的不同质量浓度G-M1∶2抑制生物膜形成的情况。如图所示,G-M1∶2质量浓度越高,抑制生物膜形成的能力越强,当G-M1∶2质量浓度为MIC即0.32 g/L 时,仍可抑制61.70%的生物膜形成,而在G-M1∶2质量浓度低于MIC 时仍然具有较强的生物膜抑制率。抑制50%及以上生物膜形成的G-M1∶2最低质量浓度(MBIC50)为0.08 g/L(1/4 MIC)。目前控制牙菌斑生物膜的主要方法是外用和内服药物,如使用氟化物和抗生素清除生物膜以达到保护牙釉质的目的,但长期使用容易产生耐药性[5],中草药与上述药物相比在生物安全性和持续抑菌效能上具有优势,在防龋治龋产品市场具有巨大潜力。
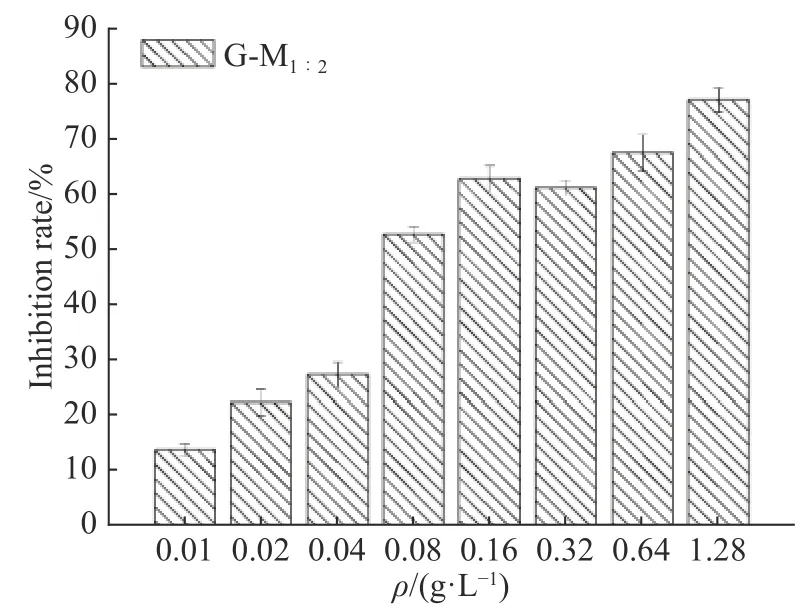
图5G-M1∶2 对变异链球菌生物膜清除效果Fig.5Clearing effects of G-M1∶2 to the biofilm formed by Streptococcus mutans
4 结 论
考察了甘草和厚朴的乙醇提取物的抑菌性,比较了G-EA、M-EA 和G-M1∶1复配物对变异链球菌的抑菌效果,结果显示复配物的抑菌性优于单独使用的G-EA 和M-EA。
通过牛津杯法分别测定甘草和厚朴提取物对变异链球菌的最小抑菌浓度和两种提取物之间的相互作用关系。结果显示G-EA 和M-EA 联合使用时的FIC<1,具有协同作用,当两者的质量比为1∶2 时,复配物的抑菌效果最佳,G-M1∶2对试验菌的MIC 值为0.32 g/L。通过生长抑制曲线探究G-M1∶2复配物对变异链球菌的抑菌时期,结果显示其主要抑制发生在对数生长期及稳定期,且G-M1∶2抑菌性能优于同浓度的茶多酚的抑菌性能。
探究了G-M1∶2对变异链球菌中LDH 的活性影响和牙齿表面生物膜的抑制作用,结果显示G-M1∶2能有效抑制LDH 的活性和生物膜的形成,其中对生物膜的MBIC50为0.08 g/L。
综上所述,甘草与厚朴乙醇提取物对变异链球菌的抑菌能力和抑制生物膜形成的能力较强,复配物G-M1∶2的抑菌能力优于两种中草药单独使用和同浓度下茶多酚的抑菌能力。说明中草药与目前常见的防龋治龋药物相比在生物安全性和持续抑菌效能上具有优势,在防龋治龋产品市场具有巨大潜力。
