BoneCeramic和Bio-Oss骨粉对狗骨髓间充质干细胞体外成骨分化能力影响的比较研究
2021-04-09路佳佳李伟琼朱友明徐建光张红艳
路佳佳,李伟琼,许 敏,徐 涛,朱友明,徐建光,张红艳
(1. 安徽医科大学附属口腔医学院,安徽省口腔疾病研究中心实验室,2.安徽医科大学药学院,安徽 合肥 230032)
自体骨移植一直被认为是治疗颌面骨组织缺损的金标准[1],但是自体骨的采集需要开辟二次术区,导致额外的并发症,患者常常难以接受[2],因此,人们对骨移植替代物的关注越来越大。“最佳”的骨移植替代物不仅要有良好的生物相容性和促成骨分化性能,还需具有合适的降解速率[3]。临床上最常见的修复口腔颌面部缺损的骨移植替代物是Bio-Oss (Geistlich Pharma,Wolhusen,Switzerland)。Bio-Oss属于天然的异质骨移植物,是一种商品化的去蛋白牛骨矿物质,由高孔隙率的羟基磷灰石晶体组成,它提供了充足的表面积,为成骨细胞的迁移和粘附提供了良好的相容性和机械稳定性[4-5]。但在移植后,Bio-Oss的降解速率非常缓慢。文献报道在植入后数年,体内仍可观察到Bio-Oss骨粉材料残留[6]。临床上Bio-Oss骨粉通常被用在口腔种植领域,以减少术后骨重建所导致的骨质丧失。
近年来,随着组织工程学的不断发展,一种新的100%合成骨移植替代物BoneCeramic(Straumann,Basel,Switzerland)已正逐渐用于骨缺损的修复治疗[7]。BoneCeramic是一种双相磷酸钙,由60%的羟基磷灰石(hydroxyapatite,HA)和40%的β-磷酸三钙组成,孔隙率高达90%,相互连通的孔直径为100-500μm。文献报道[8-9],移植后,β-磷酸三钙可以迅速地吸收并被再生骨完全取代,与此同时,吸收速度缓慢的HA可作为新血管向内生长和成骨细胞附着的良好支架。
骨髓来源的间充质干细胞因其强大的增殖能力、卓越的成骨分化潜能等[10], 成为目前骨组织工程首选的种子干细胞[11]。其中,狗骨髓间充质干细胞(dog bone marrow mesenchymal stem cells,DBMSCs)具有取材方便, 能够迅速扩增,并在扩增过程中保持多向分化潜能,同时在特定的环境下能分化为成骨细胞、软骨细胞及脂肪细胞等优点,因此,本研究选择了狗骨髓间充质干细胞。
目前,由于缺乏对这两种骨粉材料之间标准化的直接科学比较,合成骨移植材料的促成骨分化性能是否优于天然骨移植材料仍然值得探究。因此,本研究旨在比较BoneCeramic骨粉与现今临床上广泛使用的Bio-Oss骨粉对DBMSCs体外成骨分化能力的影响,为骨替代材料的临床选择和应用提供一定的指导和建议。
1 材料与方法
1.1 动物、仪器和试剂♂健康比格犬,购于仪征安立卯生物科技有限公司(No 20201207)。BoneCeramic (Straumann,Switzerland,VR294);Bio-Oss(Geistlich Pharma, Switzerland,81901307);胎牛血清((杭州四季青生物科技公司,18120502);胰酶消化液(上海碧云天生物技术有限公司,121920191228)、DMEM培养液(美国Gibco公司,AF29498406);PBS缓冲剂(美国Solarbio公司,AF29561133);CCK-8试剂(日本同仁公司,SD787);CO2恒温孵箱(美国Therno公司);茜素红(美国Sigma公司,MKCF4917);油红O(美国Sigma公司, 20190424);碱性磷酸酯酶试剂盒(上海碧云天生物技术有限公司,061820200929) ;PCR引物(上海生物工程股份有限公司);实时荧光定量PCR仪(美国Stratagene公司);酶标仪(美国Bio-tek公司);
1.2 方法
1.2.1比格犬骨髓干细胞(DBMSCs)的体外分离培养 比格犬经3%戊巴比妥钠静脉麻醉后,选取髂后脊为穿刺点,碘伏消毒,16号骨穿刺针穿刺,回抽见混有脂滴的血液,证实为骨髓,内盛500 uL肝素溶液的20 mL注射器抽取10 mL骨髓,加入PBS缓冲液1 ∶1混匀后,置于37 ℃、5% CO2的饱和湿度培养箱中,用密度梯度离心法培养原代细胞,该细胞记为P0代。每隔3 d换液,待细胞达到80%-90%融合,加入0.25%胰酶消化细胞进行传代培养,此传代细胞记为P1代,细胞代数标记以此类推。
1.2.2DBMSCs成骨、成脂诱导分化 P3代DBMSCs以5×105个/孔接种于6孔板中,将培养基更换为相应的成骨、成脂诱导培养基。培养21 d后,弃掉上清液,4%甲醛固定30 min,PBS清洗2次,分别进行茜素红染色,显微镜下观察细胞矿化结节的形成;进行油红O染色,显微镜下观察细胞中脂滴的形成。
1.2.3CCK-8检测两种骨粉浸提液对DBMSCs细胞增殖的影响 无菌条件下分别取Bio-Oss和BoneCeramic两种骨粉颗粒,将颗粒加入含10% FBS的DMEM培养基浸泡(浓度为0.1 kg· L-1),浸泡48 h后获得浸提原液,过滤后备用。将DBMSCs以4×107个·L-1的密度接种在96孔板中,培养24 h细胞贴壁后,将原培养液更换为浸提原液,对照组不更换培养液,每3 d换液。分别在培养1、3、5 d,加入CCK-8工作液,置于恒温培养箱2 h,随后在450 nm波长处检测各孔的吸光度。每组设8个复孔,实验重复3次。
1.2.4SEM观察DBMSCs在骨粉表面黏附的情况 无菌环境下,将Bio-Oss和BoneCeramic颗粒分别放入15 mL离心管中,加入密度为1×109个·L-1的DBMSCs,培养3 d后,小心吸出培养液,加入2.5%扫描电镜专用戊二醛,4 ℃固定细胞12 h后,去除戊二醛,PBS洗涤3次。采用60%、70%、80%、90%和100%的无水乙醇对细胞进行梯度脱水,每步脱水20 min,临界点干燥,完成后镀金90 s,将镀金后的颗粒于扫描电子显微镜下进行观察。
1.2.5ALP定量检测 无菌环境下,将Bio-Oss和BoneCeramic颗粒分别平铺于6孔板皿底中,DBMSCs以5×105个/孔的密度滴入其中,培养1 d后,将生长培养基(growth medium,GM)更换为成骨培养基(osteogenic medium,OM),每2 d换液。Bio-Oss植入细胞(OM):A组,BoneCeramic植入细胞(OM):B组,纯DBMSCs(OM):C组,纯DBMSCs(GM):D组。应用碱性磷酸酶试剂盒检测成骨诱导4、7、10 d后细胞培养上清中碱性磷酸酶的水平。按照碱性磷酸酶测定试剂盒操作说明,于酶标仪405 nm检测各孔吸光光度值,按照公式计算细胞培养上清碱性磷酸酶的含量。实验重复3次。
1.2.6qRT-PCR检测 如上,按照ALP定量检测的分组方法和操作步骤,分别于7、14 d后提取细胞总RNA,进行RT-PCR定量检测核心结合因子2 (RUNX2)、碱性磷酸酶(ALP)、骨钙素( OCN)、骨桥蛋白(OPN)基因表达水平。按TRIzol试剂盒说明书提取各组细胞总RNA,使用PrimeScriptTM-PC R kit逆转录试剂盒合成cDNA,以此为模板,用目的基因的引物进行扩增和检测。实验重复3次。PCR引物序列见Tab 1,其中GAPDH为内参。
Tab 1 Primers used for quantitative real time PCR

2 结果
2.1 DBMSCs的体外分离培养密度梯度离心法培养DBMSCs,约3-6 d光镜下可观察到原代细胞开始贴壁,为椭圆形或短梭形,有伸展突起,随着培养时间增加,细胞开始变为长梭形或多角形,经2次传代后即可获得细胞形态均一、贴壁能力强、易于消化的梭形DBMSCs。见Fig 1。

Fig 1 Microscopic morphology of DBMSCs A: DBMSCs on day 5; B-C: DBMSCs of the P2, Magnification: B ×8; C ×16
2.2 DBMSCs的成骨、成脂分化DBMSCs成骨诱导显示诱导21 d后茜素红染色可见大量红染的矿化钙盐结节沉积;成脂诱导显示诱导21 d后细胞内可形成脂滴团, 油红O染色后呈鲜红色脂滴泡。见Fig 2。
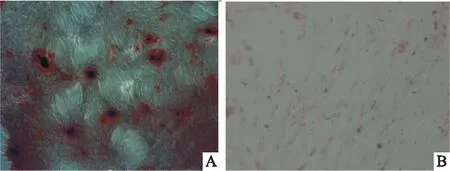
Fig 2 Osteogenic and lipogenic differentiation of DBMSCs(50×)A: Alizarin red staining; B: Oil red O staining
2.3 CCK-8检测两种骨粉浸提液对DBMSCs细胞增殖的影响在加入浸提液的d 1、3、5,Bio-Oss组和BoneCeramic组细胞OD值相较于对照组均有增高,差异有统计学意义(P<0.05),BoneCeramic组的细胞数量要比Bio-Oss组略高,但差异没有统计学意义(P>0.05)。见Fig 3。
2.4 扫描电子显微镜(SEM)检测Fig 4是DBMSCs接种3 d后在Bio-Oss和BoneCeramic两种骨粉支架材料上的典型扫描电镜图像。在Bio-Oss表面观察到少数分离的DBMSCs,与Bio-Oss相比,DBMSCs在BoneCeramic骨粉表面分布的更加广泛。见Fig 4。
2.5 ALP定量检测d 4,A组、B组、C组ALP活性均高于D组,差异有统计学意义(P<0.05),A组、B组、C组3组之间无明显差异; d 7, A组、B组、C组ALP 活性均高于D组,A组、B组活性高于C组,B组高于A组,差异有统计学意义(P<0.05);d 10, A组、B组、C组ALP 活性均高于D组,A组、B组活性高于C组,B组高于A组,差异有统计学意义(P<0.05)。见Fig 5、Tab 2。
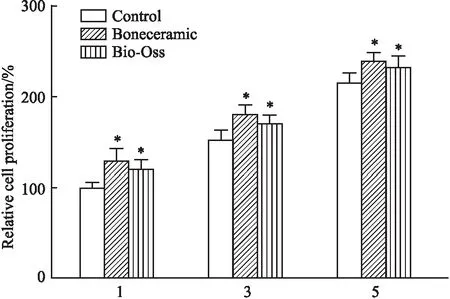
Fig 3 Effect of bone powder extracts on proliferation of *P<0.05 vs control group
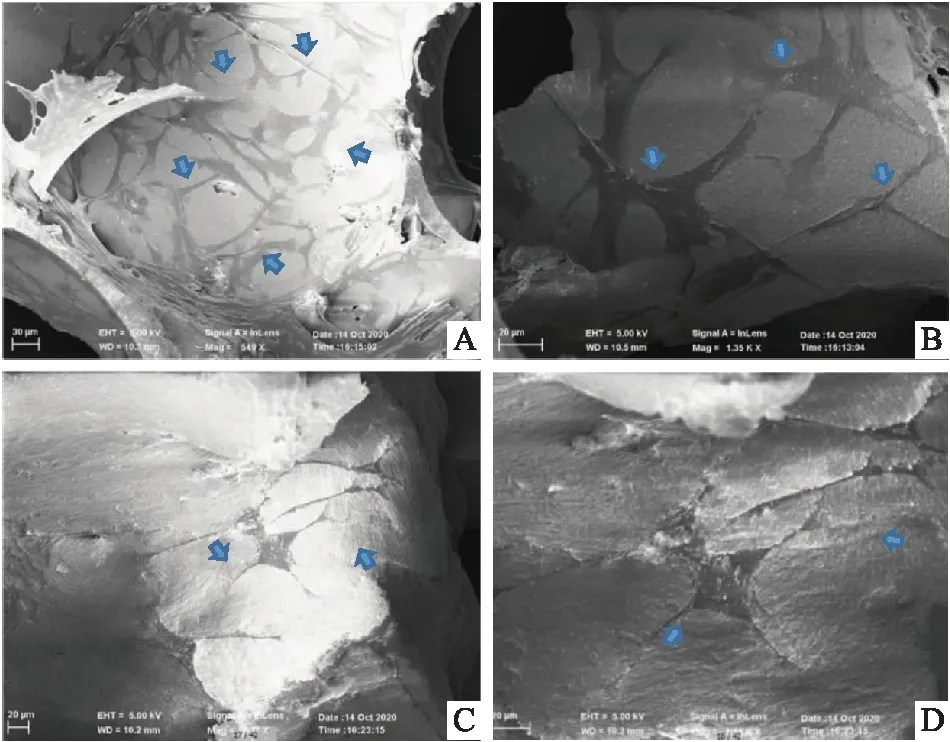
Fig 4 Scanning electron microscopy (SEM)Distribution of DBMSCs on the surfaces of Bio-Oss and BoneCeramic after 3 days of inoculation, the blue arrow points to the cell. Magnification:× 500(a,c);×1000(b,d)
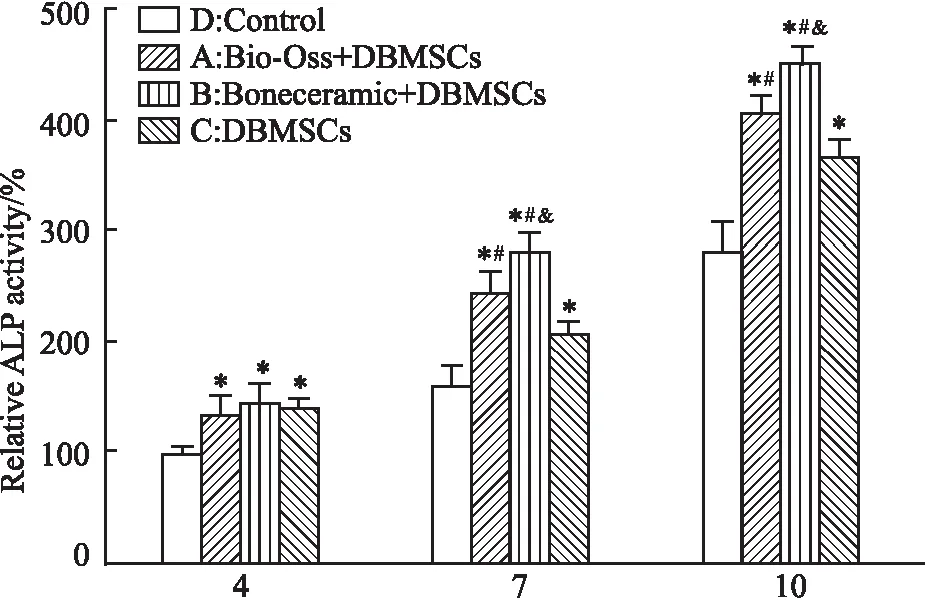
Fig 5 ALP quantitative detection n=6)Group A: Bio-OSS+DBMSCs (OM), Group B: BoneCeramic+DBMSCs (OM), Group C: DBMSCs(OM), group D: DBMSCs(GM) . *P<0.05 vs Group D; #P<0.05 vs Group C; &P<0.05 vs Group A
Tab 2 OD value in ALP quantitative
2.6 qRT-PCR检测检测成骨相关基因(OPN、OCN、RUNX-2、ALP)在d 7、14的相对表达水平。结果表明:与对照D组相比,A、B、C 3组的mRNA水平在这几种成骨相关基因中都要显著增高,同时,B组(BoneCeramic+细胞)要高于A组(Bio-Oss+细胞),差异有统计学意义(P<0.05)。也就是说明DBMSCs在BoneCeramic表面要比Bio-Oss更加有利于其成骨分化。见Fig 6。
3 讨论
目前,临床上最常见的骨移植材料包括自体骨、同种异体骨、异质骨以及合成骨移植材料[12],自体骨是骨移植的金标准,但由于需要二次手术,限制了其使用,同种异体骨可以很好的避免二次手术的问题,但存在着免疫原性的问题[13],非人类源性的异质骨则会比同种异体骨导致更明显的免疫学问题,比如疯牛病或牛海绵状脑炎(BSE)[14]。这使得合成骨移植材料在临床上的运用越来越广泛,BoneCeramic是一种新型的纯合成骨移植材料,在临床上投入广泛使用之前,必须先在体外细胞实验中进行测试。这项研究的目的是比较Bio-Oss和BoneCeramic两种骨粉材料对DBMSCs成骨分化的影响。
CCK-8细胞增殖实验表明,浸泡了48h的Bio-Oss和BoneCeramic骨粉浸提液对DBMSCs的增殖没有抑制作用(Fig 3);扫描电子显微镜(SEM)结果显示,相较于Bio-Oss,DBMSCs在BoneCeramic表面分布的更加广泛(Fig 4)。ALP碱性磷酸酶定量检测的结果得出(Fig 5,Tab 2),A组(Bio-Oss植入细胞)和B组(BoneCeramic植入细胞)与没有加入骨粉支架的C组相比,ALP的活性明显增高,说明DBMSCs黏附在骨粉支架表面要比单独的细胞更有利于其成骨分化,这主要是由于骨粉材料的空间结构和三维支架结构拓展了细胞的生长空间,使得细胞和材料的接触面积变大,减少了接触抑制,从而更加有利于DBMSCs的成骨分化。同时B组的ALP活性高于A组,说明在DBMSCs黏附在BoneCeramic表面更有利于成骨分化。qRT-PCR检测第4、7、10天相关成骨基因(OPN、OCN、RUNX-2、ALP)的相对表达水平也证实了ALP的结果(Fig 6)。综上所述,Bio-Oss和BoneCeramic这两种骨粉材料对狗骨髓干细胞的细胞毒性均很低,同时,相较于Bio-Oss,BoneCeramic能更加的促进狗骨髓干细胞的增殖和成骨分化。
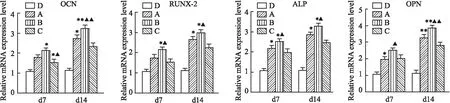
Fig 6 Expression of genes related to osteogenic differentiation detected by RT-PCR(n=5)A: Bio-OSS+DBMSCs (OM); B: BoneCeramic+DBMSCs (OM) ; C: DBMSCs (OM); D: DBMSCs (GM) . *P<0.05 , **P<0.001 vs Group C; ▲P<0.05,▲▲P<0.001 vs Group A.
除了生物相容性和成骨性之外,材料的降解也是组织工程学的重点[15]。BoneCeramic是一种双相磷酸钙,由60%的羟基磷灰石(HA)和40%的β-磷酸三钙组成。HA有着与人体骨骼高度相似的生物相容性和较低的溶解度,因此,广泛的运用在组织工程学中作为细胞附着的良好支架。β-磷酸三钙是一种生物相容性磷酸钙,已被成功的运用到口腔种植上颌窦提升术中,β-磷酸三钙它有一个相对较晚的重塑期,它的降解主要是通过物质的化学溶解而不是破骨细胞的再吸收。BoneCeramic结合了HA的生物相容性和β-磷酸三钙的良好吸收性,在促进骨再生的同时,BoneCeramic可以在较短的时间内完全被吸收并被再生骨所取代[16]。因此,在需要材料降解的骨组织工程里,也许BoneCeramic会是一种很好的材料。
本文主要研究一种新型的纯合成骨粉材料BoneCeramic,经过一系列体外实验的结果表明,BoneCeramic与临床广泛使用的Bio-Oss相比,有着同样优异的生物相容性,在成骨性能方面甚至要高于Bio-Oss。在未来,应该测试Bio-Oss和BoneCeramic的体内生物相容性和成骨性。目前尚不清楚BoneCeramic是如何支持DBMSCs的增殖的,也许应该进行一些研究以了解其中的机制作用,这会更加有利于BoneCeramic在临床上的广泛运用。
