Nampt对ERK1/2的调控在病理性心肌肥大中的作用研究
2021-04-09陈建杏王盼霞胡粤怀刘培庆
陈建杏,王盼霞,胡粤怀,路 静,刘培庆
(中山大学药学院,广东 广州 510006)
病理性心肌肥大是心脏在应对各种病理刺激时表现出的适应性反应,整体主要表现为心脏增大、心腔缩小、心室壁增厚。心肌细胞典型肥大特征包括:胚胎基因重新激活和心肌细胞表面积增大。病理性心肌肥大开始是代偿性的增大,但持续发展到不可逆转时,会导致严重的心功能下降,甚至心力衰竭[1-2]。心肌肥大的发病机制尤为复杂,因此,深入研究其病理机制及关键调节因子,在病程初期进行有效干预,可延缓心衰进程,为其防治提供重要的理论依据。
细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK1/2),属于促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族成员,其磷酸化与病理性心肌肥大有关。在受到胞外肥大信号刺激时,心肌细胞膜上的G蛋白偶联受体激活,进而激活了RAS-RAF-MEK-ERK1/2 级联信号系统,使得ERK1/2发生磷酸化转位入核,从而增加肥厚相关转录因子的表达[3]。有研究表明,G蛋白信号调节10可抑制ERK1/2信号传导,从而减轻心肌肥大[4]。因此,抑制ERK1/2的异常激活可减缓心肌肥大发生发展进程。
烟酰胺腺嘌呤二核苷酸(nicotinamide adenine denucleotide,NAD)是传递氢离子的辅酶,能接受氢化物,形成还原型NADH,为线粒体电子传递链提供还原等价物,从而参与线粒体三羧酸循环。烟酰胺磷酸核糖基转移酶(nicotinamide phosphoribosyltransferase,Nampt),长度约52 ku,结构高度保守,在心脏中含量丰富[5]。在哺乳动物中,Nampt主要调控细胞内以烟酰胺(NAM)为原料合成的NAD+补救生物合成途径,且是NAD+合成过程中的关键限速酶[6]。研究表明,Nampt可以保护心肌细胞免受PARP1诱导的凋亡损伤[7],其竞争性抑制剂FK866可导致线粒体功能障碍[8]。NAD+可作为Ⅲ类去乙酰化酶(Sirtuins)和PARPs等多种调节蛋白家族的底物,调控基因表达、DNA修复、凋亡、线粒体生物合成及蛋白折叠反应等。研究表明,Nampt可能对心脏具有保护作用,但Nampt是否参与了ERK1/2调控的病理性心肌肥大,尚未见明确报道。
基于以上研究背景,本文探究了Nampt对ERK1/2的调控作用及与病理性心肌肥大的关系,为心肌保护新靶点的寻找提供理论依据。
1 材料与方法
1.1 试剂PE粉末(纯度>99%,英国,Bristol);ISO粉末(纯度>99%,美国,Sigma,I5627-5G);组织用胰酶粉末(美国,Sigma,B5002-250 mg);细胞用血清(美国,Gibco,10099-141);Nampt抗体(66385-1-Ig-100 uL)和GAPDH抗体(10494-1-AP),品牌均为美国Proteintech;ERK1/2抗体(9102S)、p-ERK1/2抗体(5726S)、Lamin B1抗体(68591S)、兔二抗(8889S)和鼠二抗(4410S),品牌均为美国CST;ANF抗体(美国,Santa Cruz,sc-515701);BNP抗体(美国,Millipore);α-Tubulin抗体(美国,Sigma,T8328-200 UL);核蛋白提取试剂盒(美国,Active Motiff,40010);BCA蛋白定量试剂盒(美国,Thermo,23227);TRIzol(日本,TaKaRa);RNA逆转录试剂盒(美国Thermo,K1622);NAD+/NADH测定试剂盒(英国,Abcam,ab65348)。
1.2 仪器细胞用CO2培养箱、全自动高内涵筛选分析系统和实时荧光定量PCR仪均购于美国Thermo;单人单面超净工作台购买于中国苏州;恒温水浴锅来自德国Memmert;显微成像系统使用的是美国Invitrogen品牌;移液枪、冷冻高速离心机和常温低速离心机则出自德国Eppendorf;蛋白电泳仪和蛋白电转仪均购于美国BioRad;全自动化学发光图像分析系统是美国Waukesha品牌的产品。
1.3 方法
1.3.1原代心肌细胞培养 用酒精棉擦拭SD大鼠乳鼠(1-3 d)胸腹部表面,开胸并小心分离出心脏,修剪干净后心脏对称剪碎4-6块至均匀大小,转至提前高压灭菌锥形瓶。加入适量0.8 g·L-1的胰酶,冷消化20 min。中途轻轻晃动瓶子,使冷消充分。然后在磁力搅拌器37 ℃水浴搅拌消化,每次5 min。小心吸取上清至新的15 mL离心管,加含胎牛血清的培养基终止消化。锥形瓶另加胰酶继续消化至完全。重悬离心收集到的细胞,种植在150 mm的大皿(按10-14只乳鼠的量计算),将培养皿置于细胞培养箱孵育1 h,然后收集上层培养基。以一定密度将细胞均匀种在细胞培养皿/孔板中,并加入双抗和5-溴脱氧尿嘧啶核苷。继续培养24 h,待心肌细胞贴壁后换液,并按实验需求进行不同处理。
1.3.2RT-qPCR 用TRIzol将细胞轻柔吹下并收集,加入氯仿,迅速上下颠倒几次至液体明显乳化分层,使蛋白质变性,并除去一些脂溶性杂质。静置离心后小心吸取上层透明水相至新的EP管中,加预冷异丙醇混匀,静置,离心,使RNA沉淀在EP管底部析出。沉淀中加体积分数为75%乙醇洗涤,离心后直接倒去上清,于纸巾上倒扣去除残液,或用小枪头进一步去除管壁残液,然后置通风橱中室温干燥。之后用适量DEPC水作为溶剂,于58 ℃水浴或空气浴辅助溶解RNA,然后用nanodrop测定其浓度和纯度。逆转录第一步体系为12 μL,PCR条件是:65 ℃,5 min,然后降温至4 ℃;第二步是基于第一步反应,总体系20 μL。PCR条件为:先42 ℃持续60 min,然后70 ℃反应5 min,最后降温至4 ℃。
1.3.3Western blot 原代心肌细胞经贴壁、换液、加药处理、继续培养完成后加适量RIPA裂解液,将细胞全部刮下于冰上孵育30 min,使细胞充分裂解,蛋白质释放出来。心脏组织经称重、洗涤、剪碎、离心等步骤,加入适量RIPA重悬,充分匀浆。得到的细胞/组织蛋白裂解液离心15 min(4 ℃、12 000×g),去除细胞碎片或组织不容物。取上清液5 μL和PBS溶液20 μL进行吸光度的测定。计算浓度并制样。用SDS-PAGE 凝胶进行蛋白样品电泳分离,经电泳,电转,封闭,一抗孵育过夜,二抗室温孵育并洗涤后,将切下的蛋白膜条带和显色液反应,然后进行化学发光显影检测。
1.3.4心肌肥大和心衰动物模型的建立 实验所用动物SPF 级Sprague-Dawley(SD)大鼠均购买并饲养于中山大学实验动物中心,体质量约为200 g,其质量合格编号:4400850000012196[9]。所有的实验操作均在动物中心实施完成。动物实验分为异丙肾上腺素(ISO)给药模型和腹主动脉缩窄(AAC)模型。
ISO诱导的模型组(雌雄不限,n=12)大鼠每天接受皮下注射ISO溶液(2.5 mg·kg-1),对照组则给予等体积量生理盐水。连续给药1周或3周。AAC模型(雄性,n = 10)的SD大鼠则经历了术前麻醉、术中迅速开腹、钝性分离肾动脉和腹主动脉,并用5/0丝线结扎腹主动脉,以及术后进行伤口缝合等过程。Sham组大鼠也进行了开腹手术但不束缚主动脉。所有动物于给药前后进行超声心动检测。AAC术后8周取材。
1.3.5细胞水平干预Nampt (1)过表达Nampt:用载体为pcDNA 3.1(+),携带大鼠Nampt编码区的质粒瞬时转染原代心肌细胞48 h,只转染pcDNA 3.1(+)质粒作为对照组。
(2)敲低Nampt:加入Nampt干扰序列降低其表达或加入抑制剂FK866抑制其酶活性。对几种siRNA进行筛选,选定敲低效率较高的siRNA进行后续实验。RNA干扰采用Lipo2000转染试剂,进行瞬时转染。转染后4-6 h换液,换成无血清培养基,使细胞增殖减缓,提高干扰效率。此外,我们也通过加入FK866来模拟Nampt敲低的效果。加入5 μmol·L-1FK866,与原代心肌细胞共同孵育24 h,然后提取蛋白或RNA。
1.3.6核蛋白提取 以150 mm大皿为例:开始收集细胞离心用500×g,其余均为14 000×g。
原代心肌细胞经贴壁、换液、加药处理、继续培养完成后用预冷PBS/PI洗涤并刮下,离心后用1×Hypotonic Buffer重悬并于冰上孵育15 min。孵育完成后以最大转速涡旋10 s,并用胰岛素针轻轻匀浆。短暂离心,上清即为胞质蛋白。用1×Hypotonic Buffer 清洗沉淀1次后加入Complete Lysis Buffer重悬,在摇床上摇摆孵育30 min。离心后的上清即为核蛋白。可用考马斯亮蓝和BCA定量法分别对核蛋白、胞质蛋白进行定量并制样。
1.3.7原代心肌细胞表面积测定 每次进行下一步操作处理前均先用37 ℃的PBS清洗3次。
(1)固定细胞:细胞处理完成经洗涤后,加入提前放至室温的4%多聚甲醛固定,以15-20 min为宜。
(2)透膜:弃去多聚甲醛,室温下开盖干燥5 min,去除残余多聚甲醛。加入体积分数为0.3%的Triton破膜10 min。
(3)细胞染色:加入罗丹明-鬼笔环肽于37 ℃避光孵育半小时,然后用DAPI染核5 min,最后用高内涵系统测定总体细胞表面积。
1.3.8SD大鼠心脏取材 用戊巴比妥钠(45 mg·kg-1)麻醉大鼠后迅速开胸,小心将心脏周围的组织血管等分离干净,然后从心尖处灌注氯化钾(0.1 mol·L-1)溶液至心脏停博。取出心脏,挤去残血并将结缔组织等修剪干净,但保留完整心耳。心脏进行称重并拍照,然后沿最大横截面分切,上半部分浸泡在多聚甲醛进行后续切片,下半部分冻存于-80 ℃冰箱或液氮中。处死后的大鼠丈量胫骨长后置放于黄色医疗袋,待实验结束后放置中山大学实验动物中心动物尸体房进行统一无害化处理。

2 结果
2.1 建立PE诱导的心肌细胞肥大模型及Nampt的表达变化首先使用PE(100 μmol·L-1)构建心肌细胞肥大模型。如Figure 1A-B所示,PE处理后的心肌细胞表面积明显大于对照组(Figure 1A),且心肌肥大相关指标ANF、BNP和β-MHC的mRNA表达也呈现明显上调的趋势(Figure 1B),提示成功构建PE诱导的原代心肌细胞肥大模型。进一步检测细胞内NAD+的变化,发现PE可时间依赖性地降低NAD+的含量(Figure 1C)。随后,我们考察了此模型下调控NAD+水平的关键蛋白Nampt的RNA和蛋白表达变化。如Figure 1D所示,与对照组相比,给予PE刺激12 h,Nampt的mRNA水平呈升高趋势。进一步检测Nampt的蛋白水平,发现给予PE不同时间点处理,Nampt的蛋白表达升高,且呈时间依赖性(Figure 1E)。
2.2 大鼠心肌肥大及心衰模型的建立及Nampt的表达变化为了在动物水平进一步验证Nampt的表达变化,分别构建了AAC及ISO诱导的大鼠心肌肥大和心衰模型。与对照组相比,AAC组或者ISO处理后,大鼠心脏体积明显增大、心肌细胞体积增大、排列紊乱(Figure 2A-D)。分别提取心脏组织mRNA和蛋白,检测Nampt的表达变化。如Figure 2E-F所示,RT-qPCR和 Western blot结果显示:与Sham组比,AAC组Nampt的mRNA及蛋白水平均明显升高。在ISO处理下,与对照组相比,无论是肥大还是衰竭的心脏中,Nampt的mRNA及蛋白水平均明显升高,且随病理模型的严重程度而越明显(Fugure 2G - H)。以上研究结果与细胞实验结果相一致,心肌肥大刺激能明显升高Nampt的表达,提示Nampt可能是重要的心肌肥大调控因子。
2.3 Nampt对PE诱导的心肌细胞肥大的影响为了探究Nampt在PE诱导的心肌肥大的作用,分别采用功能获得和缺失的手段干预其表达。首先在原代心肌细胞中转染载体为pcDNA 3.1(+)并携带大鼠Nampt编码区的质粒以过表达Nampt,并检测心肌肥大指标的变化情况。Figure 3A的结果显示,相较于对照组,PE处理组胚胎基因ANF和BNP 的蛋白表达明显增加,而过表达Nampt能明显抑制PE诱导的胚胎基因的蛋白表达升高。利用RNA干扰序列敲低心肌细胞中Nampt的表达。根据RT - qPCR和 Western blot结果(Figure 3B - C),第3和第4条干扰序列均能有效地降低Nampt的表达,故选用这两条siRNA进行后续实验。与对照组相比,单独敲低Nampt可升高胚胎基因ANF和BNP的mRNA水平(Figure 3D)。加入FK866抑制Nampt酶活性之后,其结果与敲低Nampt类似(Figure 3E)。以上结果提示,过表达Nampt在一定程度上可缓解由PE诱导的心肌肥大作用,Nampt是心肌肥大的负性调控因子。
2.4 Nampt对NAD+含量和ERK1/2 的调控作用为了进一步探讨Nampt发挥心肌保护作用的具体机制,通过采用功能获得和缺失的手段干预其表达,考察细胞内NAD+含量和ERK1/2的变化。结果显示,单独过表达Nampt会升高胞内NAD+的水平,但这一效应可被FK866逆转(Figure 4A)。进一步检测发现,PE刺激原代心肌细胞后明显降低细胞内NAD+含量,而这一效应可被过表达Nampt逆转(Figure 4B)。使用siRNA敲低Nampt或单独抑制其酶活性,均能明显降低心肌细胞内NAD+的水平(Figure 4C,D)。这些结果提示,Nampt可以酶活性依赖性地调控心肌细胞内NAD+水平,抑制PE诱导的心肌肥大反应。以往报道显示,ERK1/2在血管紧张素Ⅱ(AngⅡ)诱导的心肌肥大中发挥了重要作用[10]。根据我们的实验结果,PE处理后能明显增加ERK1/2的磷酸化水平,而过表达Nampt明显抑制了PE引起的ERK1/2的激活(Figure 4E)。敲低或抑制Nampt则可明显地诱导ERK1/2的激活(Figure 4E,F)。以上结果提示,Nampt通过增加心肌细胞内NAD+的含量及抑制ERK1/2的磷酸化,进而发挥抵抗心肌肥大的作用。
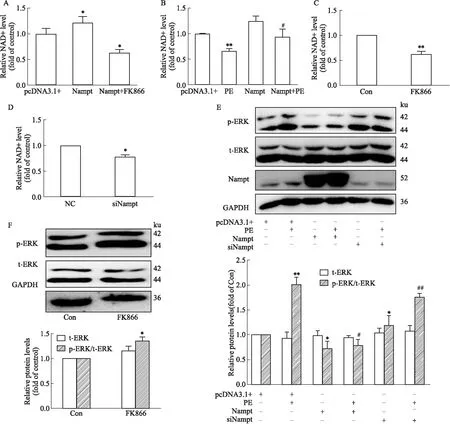
Fig 4 Effects of Nampt on NAD+ level and extracellular regulated protein kinases (ERK1/2) phosphorylation on PE-induced cardiomyocyte hypertrophy in NRCMsNRCMs were transfected with Nampt plasmid or siRNA,and co-incubated with PE (100 μmol·L-1) for 12 h (for mRNA extraction) or 24 h (for protein extraction); FK866 (5 μmol·L-1,24 h) was used to inhibit the enzyme activity of Nampt. (A,B,C and D) The NAD+ level was determined by NAD/NADH Assay Kit (colorimetric assay). (E and F) The protein expression levels of ERK1/2 including t-ERK1/2,p-ERK1/2,were determined by Western blot. *P<0.05 vs pcDNA 3.1 group or Control group;#P<0.05 vs pcDNA3.1+PE group,n=3.
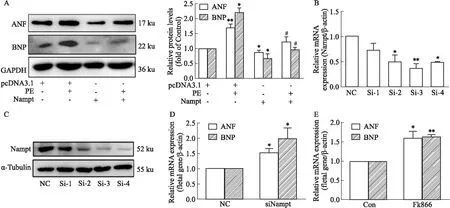
Fig 3 Nampt alleviated phenylephrine (PE)-induced cardiomyocyte hypertrophy in NRCMsNRCMs were transfected with Nampt plasmid or siRNA,and co-incubated with PE (100 μmol·L-1) for 12 h (for mRNA extraction) or 24 h (for protein extraction); FK866 (5 μmol·L-1,24 h) was used to inhibit the enzyme activity of Nampt. (A) Western blot analysis was conducted to show the total protein expression of ANF and BNP simultaneously. (B) RT-qPCR was used to detect the mRNA of Namptin in transcriptional level. (C) Western blot analysis was applied to present the protein changes of Nampt. (D and E) RT-qPCR was used to observe the mRNA levels of ANF and BNP. *P<0.05 vs pcDNA 3.1 group,#P<0.05 vs pcDNA 3.1+PE group,n=3.

Fig 1 Changes of nicotinamide phosphoribosyltransferase (Nampt) expression in phenylephrine (PE) -induced cardiomyocyte hypertrophy in primary neonatal rat cardiomyocytes(NRCMs)NRCMs were incubated with PE (100 μmol·L-1) for the indicated time point. A: The cell surface area was measured by high content screening analysis. Scale bar:100 μm; B: The mRNA levels of hypertrophic biomarkers including ANF,BNP and β-MHC,were determined by RT-qPCR; C: The nicotinamide adenine dinucleotide (NAD) level was determined by NAD+/NADH Assay Kit; D: RT-qPCR was used to determine the mRNA transcriptional level of Nampt; E: Western blot was conducted to detect the protein level of Nampt. *P<0.05, **P<0.01 vs control group (n=3).
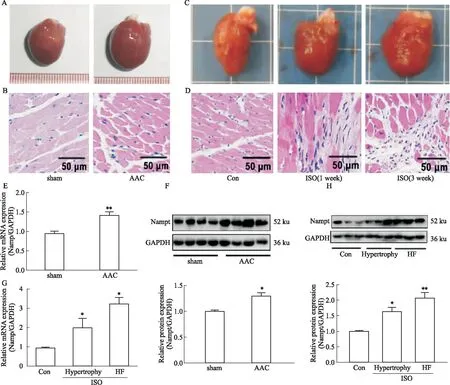
Fig 2 Changes of Nampt expression in cardiac hypertrophy caused by isopropylarterenol (ISO) and abdominal aortic constriction (AAC)Sprague-Dawley (SD) rats were intraperitoneally injected with ISO (2.5 mg·kg·d-1) for 1 or 3 weeks,or SD rats were subjected to AAC for 8 weeks. (A and C) Representative images of gross heart were shown. (B and D) Representative hematoxylin-eosin (HE) staining images of heart tissues were shown. Scale bar:50 μm. (E) The mRNA level of Nampt was detected by RT-qPCR in AAC-induced cardiac hypertrophy. (F) The protein changes of Nampt was measured by Western blot in AAC-induced cardiac hypertrophy. (G) The mRNA level of Nampt was detected by RT-qPCR in ISO-induced cardiac hypertrophy and heart failure. (H) The protein changes of Nampt were observed by Western blot in ISO-induced cardiac hypertrophy and heart failure. *P<0.05 vs control group,n=3.
3 讨论
心肌肥大通常最终会导致心力衰竭,目前其发病率及致死率仍是导致临床死亡的主要病因。因此,维持心脏功能处于代偿期及以前,使其免于发展为心力衰竭,可有效降低心血管疾病的死亡率。然而,病理性心肌肥大的发生发展过程极其复杂,涉及的信号通路和理化因子等仍需要进一步研究阐明[1]。研究表明,心肌细胞发生氧化应激时,线粒体内活性氧的升高会影响电子呼吸传递链,损害线粒体氧化磷酸化功能,进而导致一系列肥厚相关信号通路的改变,使心脏出现病理性肥大并引起心肌细胞凋亡[1,11]。
过量的儿茶酚胺会在体内和体外引起心肌肥大。而儿茶酚胺类主要是作用于肾上腺素能受体,从而参与了对心脏的调控作用。研究报道,心肌细胞中存在多种肾上腺素能受体,包括α1-肾上腺素能受体(α1A、α1B和α1D)和β-肾上腺素能受体(β1、β2和β3)[12]。PE一方面可以激动α1肾上腺素受体,另一方面是其也具有弱的β受体激动作用[13],所以PE是心肌细胞良好的肥大刺激剂。而ISO 则通过非选择性激动β受体,从而达到刺激心脏的效果。因此,我们分别选用PE和ISO作为心肌肥大的诱导剂。根据实验室前期研究基础[14],采用100 μmol · L-1的PE刺激原代心肌细胞,成功复制了PE诱导的心肌肥大模型。分别采用皮下ISO给药3周及AAC手术8周的方式,成功建立了SD大鼠心肌肥大和心衰模型。
细胞内NAD+的合成途径包括从头合成和补救合成。在原核生物和低等真核生物中,主要有利用喹啉酸经从头途径和利用烟酸经补救途径合成NAD+两种方式;在哺乳动物中,则主要是由色氨酸和天冬氨酸通过从头途径合成NAD+[6,15]。研究表明,扩张型心肌病(dilated cardiomyopathy,DCM)伴有心衰的患者心脏组织中NAD+水平和NAD+/ NADH比值均降低;在 AngⅡ 引起的高血压和ISO诱导的心衰模型中,也观察到NAD+水平的下降。外源添加的NAD+能激活SIRT1,减少心衰患者的氧化应激和细胞凋亡;能提高心衰患者SIRT3活性,从而改善心脏功能;能激活SIRT7,调节其转录活性并抑制肥大相关基因表达从而抑制心肌肥大[16]。这些表明NAD+在心脏中主要发挥保护作用,与我们的实验结果也是一致的。
Nampt在心脏保护中发挥了重要作用。内源性Nampt上调可以保护心脏免受缺血/再灌注的损伤,Nampt下调则明显增加了心肌细胞的凋亡,其潜在机制可能是通过增加细胞NAD+水平,从而激活与NAD+相关的蛋白信号通路[7]。在本实验中,我们发现心肌肥大刺激下Nampt的表达增加、NAD+含量降低,过表达Nampt一定程度上减轻了PE诱导的心肌肥大;相反地,干扰 Nampt表达或抑制其酶活性则会导致心肌细胞出现肥大效应。我们猜测,可能是Nampt酶活性依赖性地升高心肌细胞内NAD+含量,进而发挥抵抗心肌肥大的作用。
此外,ERK1/2 磷酸化可导致多种信号通路发生改变。研究表明,在AngⅡ 诱导的心肌肥大模型中,ERK1/2磷酸化水平明显升高[10]。而磷酸化的ERK1/2可能激活肥厚相关信号通路。本研究发现,过表达Nampt可以抑制PE诱导的ERK1/2的磷酸化水平,而干扰Nampt合成或抑制其酶活性则会诱导ERK1/2激活。据文献报道,胞内NAD+可增强SIRT1和SIRT3的去乙酰化酶活性。SIRT3可通过抑制MAPK、ERK1/2和PI3K/Akt通路来阻断心肌肥大反应[17];SIRT1可以NAD+依赖性地抑制与抗氧化损伤相关的Ras/ERK1/2通路[18]。本研究中,Nampt抑制ERK1/2磷酸化的具体机制并未详细阐明,基于上述研究背景及本实验室的前期研究基础,我们猜测Nampt可能通过调控细胞内NAD+含量进而改变了SIRTs(特别是SIRT1、SIRT3)的去乙酰化酶活性,进而间接调控了ERK1/2的磷酸化水平。
在本实验中,我们发现Nampt通过调控心肌细胞内NAD+含量及ERK1/2磷酸化水平,有效地抵抗病理性心肌肥大,为病理性心肌肥大的防治提供了科学的理论依据。
