荔枝核总黄酮联合紫杉醇对前列腺癌耐药细胞的增殖抑制作用
2021-04-09张维权李小兰郭宏伟
张维权,李小兰,薛 薇,常 明,郭宏伟
(1. 广西医科大学药学院,广西 南宁 530021;2. 长寿与老年相关疾病教育部重点实验室&广西医科大学转化医学研究中心,广西 南宁 530021;3. 广西中医药大学附属瑞康医院,广西 南宁 530011)
前列腺癌(prostate cancer,PCa)在美国男性恶性肿瘤的发病率居首位、死亡率居次位[1]。中国PCa患者发病率近年来呈明显上升趋势,而且发病年龄趋于年轻化[2]。紫杉醇(paclitaxel,PTX)是临床治疗前列腺癌的常用药物,但在治疗过程中多数患者会出现耐药,联合治疗是目前解决紫杉醇肿瘤耐药的主要手段[3]。我们课题组前期研究发现,荔枝核正丁醇提取物和荔枝核总黄酮(total flavonoids of litchi seed,TFLS)具有较好的抗PCa作用[4-5],但是TFLS对前列腺癌紫杉醇耐药细胞(prostate cancer paclitaxel resistance cells,PCa-Txr)细胞是否具有抑制作用,能否增强PCa-Txr细胞对PTX的敏感性,以及与PTX联合应用是否具有协同抑制作用,尚未得知。因此,本研究主要采用前列腺癌紫杉醇耐药株PC3-Txr和DU145-Txr细胞,探讨TFLS对PCa-Txr细胞的抑制作用、增敏作用以及TFLS与PTX联合应用是否存在协同抑制作用。
1 材料与方法
1.1 试验药物与试剂荔枝核,南宁生源中药饮片有限责任公司,批号181001;紫杉醇,MedChemExpress公司,批号37434;CCK-8试剂盒,博士德生物工程有限公司,批号14K16B99;胎牛血清,Gibco公司,批号2109290CP;RPMI 1640培养基,维森特生物技术有限公司,批号350006037;0.05%胰酶消化液, 维森特生物技术有限公司,批号325041009;96孔板,costar公司,批号12619601;95%乙醇,成都市科隆化学品有限公司,批号2019021301;HPD-BJQH大孔树脂,Solarbio公司,批号218A011;其他分析纯试剂。
1.2 细胞株人PCa细胞株PC3和DU145,紫杉醇耐药细胞株PC3-Txr,DU145-Txr由“长寿与老年相关疾病”教育部重点实验室提供。
1.3 仪器CO2培养箱,生物安全柜,酶标仪,Thermo公司;倒置显微镜,OLYMPUS公司。
1.4 方法
1.4.1TFLS的提取与纯度标定 荔枝核粉末加入三口烧瓶置于加热搅拌器中,在三口烧瓶中加入10倍50%乙醇,持续微沸1.5 h。常温冷却取清液,残渣再提取1次,将2次所得溶液置于旋转蒸发仪中浓缩至适量体积。浓缩液过HPD-BJQH大孔树脂柱,pH 7.0,20%乙醇洗脱1 h弃掉,70%乙醇洗脱1 h留取。水浴锅过夜干燥,得TFLS。以儿茶素为标准品,采用香草醛-盐酸法测定儿茶素含量,通过标准曲线标定TFLS的纯度。
1.4.2细胞培养 PC3、DU145、PC3-Txr和DU145-Txr细胞均用含10%胎牛血清的RPMI1640培养液于5% CO2、37 ℃的CO2培养箱中培养,每3 d换液1次,用0.05%胰酶消化传代,取处于对数生长期的细胞进行实验。
1.4.3TFLS和PTX分别对PC3、DU145及PCa-Txr细胞增殖的影响 取对数生长期的细胞接种于96孔板,密度为2 500个/孔,继续培养24 h后,加入不同浓度的药物(PTX:15.625、31.25、62.5、125、250、500、1×103、5×103、1×104μg·L-1;TFLS:10、20、40、60、80、120、160 mg·L-1),另设空白对照组, 每组设6个复孔。TFLS与细胞共同培养24 h、48 h和72 h,PTX与细胞共同培养72 h,每孔加入CCK8试剂10 μL,继续于37 ℃、5% CO2培养箱内温育2 h后,于450 nm波长处测定各孔的吸光度A。比较药物作用细胞的细胞活性和半数抑制浓度(the half maximal inhibitory concentration,IC50)。细胞活性/%=(药物组A/空白组A)×100%。
1.4.4TFLS处理的PC3-Txr和DU145-Txr细胞对PTX敏感性的影响 设置PTX组,低细胞毒剂量(增殖抑制率<10%)TFLS提前干预组(pre-TFLS组)和同时给药组(TFLS+PTX组)。PTX组用不同浓度PTX分别作用于PC3-Txr和DU145-Txr细胞;pre-TFLS组用25 mg·L-1或40 mg·L-1TFLS提前作用PC3-Txr或DU145-Txr细胞72 h后加入不同浓度PTX继续与细胞共同培养;TFLS+PTX组在25 mg·L-1或40 mg·L-1TFLS的基础上加入不同浓度PTX与PC3-Txr或DU145-Txr细胞共同培养。PC3-Txr的PTX浓度为0.625、0.9375、1.25、1.875、2.5、3.75、5 mg·L-1,DU145-Txr的PTX浓度为25、37.5、50、75、100、150、200、400 μg·L-1。每组3个复孔。药物与细胞在96孔板内共同培养24 h、48 h和72 h后,每孔加入CCK8试剂10 μL,继续于37 ℃、5% CO2培养箱内温育2 h后,于450 nm波长处测定各孔的吸光度A。比较各药物组作用PCa-Txr细胞的IC50值变化。
1.4.5TFLS联合PTX对PC3-Txr和DU145-Txr的细胞增殖活性的影响 采用Chou[6]推荐的联合用药方案来探讨TFLS与PTX的协同抑制作用,以单一药物作用细胞IC50值为中心剂量点,剂量范围在IC5-IC95之间,并选择药物作用效果明显的72 h为作用时间。同一细胞设置两个不同的药物组合比例,分为TFLS组,PTX组和联合给药组(PTX+TFLS)。各组药物浓度配比详见Tab 1,每组设3个复孔。药物与细胞共同培养72 h后,每孔加入CCK8试剂10 μL,继续于37 ℃、5% CO2培养箱内温育2 h后,于450 nm波长处测定各孔的吸光度A。比较两单药组和联合组作用耐药细胞后的细胞增殖率,依据联合指数(Combination index,CI)评价两药联合应用的作用方式。CI = (D)1/(Dx)1 + (D)2/(Dx)2,式中(Dx)1、(Dx)2分别表示药物1、2单独使用造成x%抑制率的剂量,(D)1、(D)2分别表示药物1、2联合使用造成x%抑制率的剂量。CI>1,两药存在拮抗作用;CI<1,两药存在协同作用;CI=1,两药存在加和作用。

Tab 1 The concentration ratios of TFLS combined PTX to PCa-Txr cells

2 结果
2.1 TFLS的含量测定我们以儿茶素为标准品,使用香草醛-盐酸法对荔枝核提取物中的总黄酮含量进行了检测。经测定,回归方程为:Y=11.262X-0.002 3,R2=0.997 7,计算得:提取物中TFLS的含量为42.61%。
2.2 TFLS和PTX对PC3和DU145及耐药细胞活性的影响如Fig 1A-D所示,TFLS可明显抑制PC3、DU145及其耐药细胞PC3-Txr和DU145-Txr增殖,并呈现一定的时间和剂量依赖性,各时间段IC50详见Tab 2。其中PC3-Txr和DU145-Txr细胞的72 h IC50分别为87.74 mg·L-1、112.06 mg·L-1,而作用于PC3和DU145细胞的IC50分别为38.90、47.19 mg·L-1,耐药细胞与亲本细胞差异倍数分别为2.26倍和2.37倍。如Fig 1E-F所示,PTX作用于PC3-Txr和DU145-Txr细胞72 h的IC50分别为2.20 mg·L-1、83.65 μg·L-1,而作用于PC3和DU145细胞的IC50分别为13.63、7.71 μg·L-1,耐药细胞与亲本细胞差异倍数分别为161.41倍、10.85倍,表明PCa-Txr细胞对PTX为特异性耐药。
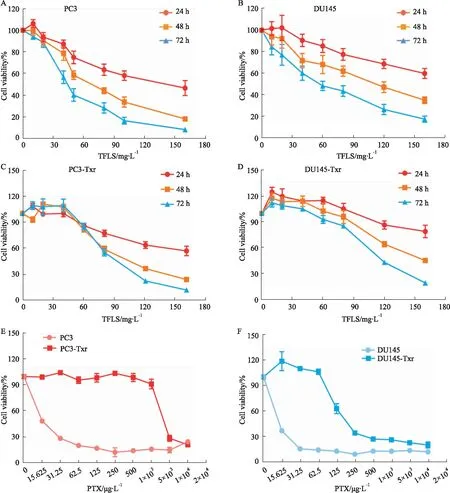
Fig 1 Effects of TFLS and PTX on proliferation of PC3, DU145 and resistant n=3)A-D: Cell viability of PC3, DU145, PC3-Txr and DU145-Txr cells treated with TFLS; E-F: Cell viability of PC3, PC3-Txr, DU145 and DU145-Txr cells treated with PTX for 72 h.

Tab 2 IC50 value of TFLS on PCa and PCa-Txr cells (mg·L-1)
2.3 TFLS处理的PC3-Txr和DU145-Txr细胞对PTX敏感性的影响为了观察TFLS是否可提高PCa-Txr细胞对PTX敏感性,我们采用低细胞毒剂量的TFLS提前干预或同时给予不同浓度的PTX作用PC3-Txr和DU145-Txr细胞,观察TFLS作用24 h、48 h和72 h是否具有增敏的效果。如Fig 2A所示,在25 mg·L-1TFLS作用下,PC3-Txr和DU145-Txr细胞在24 h、48 h和72 h的细胞活性均大于98%,表明25 mg·L-1的 TFLS对PCa-Txr细胞无明显毒性,因此我们首先观察了25 mg·L-1的 TFLS对PCa-Txr细胞耐药敏感性的影响。结果如Fig 2B-C所示,与PTX组相比,TFLS+PTX组和pre-TFLS组细胞活性在24 h、48 h和72 h均未见明显差异。TFLS(25 mg·L-1)不论是提前干预还是与PTX同时作用,均未能降低PTX的IC50值(Tab 3),提示25 mg·L-1的TFLS不能增强PCa-Txr细胞对PTX的敏感性。为了进一步确认TFLS是否具有增敏效果,我们将TFLS浓度增至40 mg·L-1,如Fig 2D所示,单独给予40 mg·L-1TFLS作用72 h后,PCa-Txr细胞活性仍大于90%,因此,接下来我们检测了40 mg·L-1TFLS作用耐药细胞72 h的增敏活性。如Fig 2E-F所示,与PTX组相比,TFLS+PTX组和pre-TFLS组细胞活性仍未见明显差异。PTX组、TFLS+PTX组和pre-TFLS组的PTX对PC3-Txr细胞的IC50值分别为2.21、2.09和2.12 mg·L-1;对DU145-Txr细胞的IC50值分别为80.35、79.05和77.31 μg·L-1。提示低细胞毒剂量的TFLS不能增强PCa-Txr细胞对PTX的敏感性。
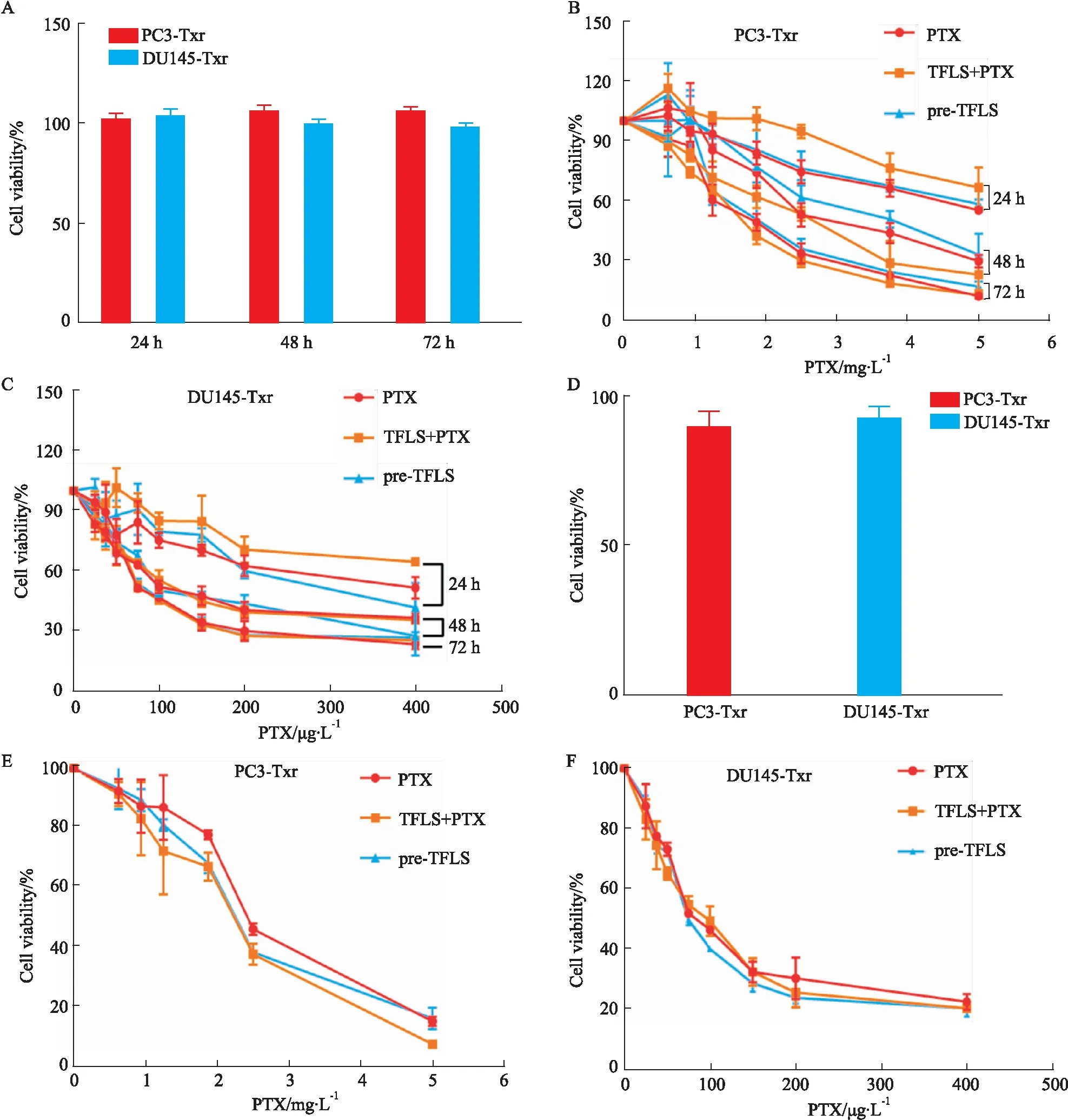
Fig 2 Effects of PTX on proliferation of PC3-Txr and DU145-Txr cells treated with TFLS A: Cell viability of PC3-Txr and DU145-Txr cells treated with TFLS (25 mg·L-1); B-C: Effects of PTX on the proliferation of PC3-Txr and DU145-Txr cells treated with or without TFLS (25 mg·L-1); D: Cell viability of PC3-Txr and DU145-Txr cells treated with TFLS (40 mg·L-1) for 72 h; E-F: Effects of PTX on the proliferation of PC3-Txr and DU145-Txr cells treated with or without TFLS (40 mg·L-1) for 72 h.
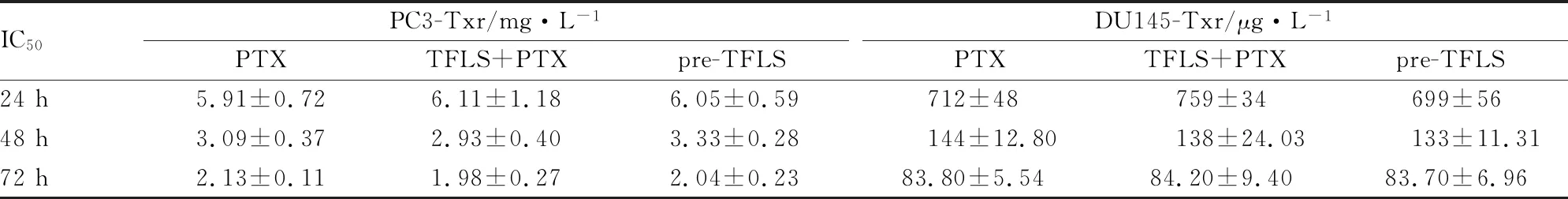
Tab 3 IC50 value of PTX on PC3-Txr and DU145-Txr cells
2.4 TFLS联合PTX抑制PC3-Txr和DU145-Txr细胞的增殖能力为了观察TFLS 和PTX联合应用对PCa-Txr细胞是否有协同抑制的作用,我们采用Chou推荐的联合给药方案来探讨TFLS与PTX对PC3-Txr和DU145-Txr细胞的协同抑制效果。结果显示,分别与TFLS组、PTX组相比,PTX+TFLS组在TFLS剂量大于100 mg·L-1时抑制PC3-Txr细胞的活性,CI小于1,TFLS与PTX联合应用抑制PC3-Txr细胞增殖存在协同作用(Fig 3A-C);分别与TFLS组、PTX组相比,PTX+TFLS组均能抑制DU145-Txr的细胞活性, CI小于1,TFLS与PTX联合应用抑制DU145-Txr细胞增殖存在协同作用(Fig 3D-F)。
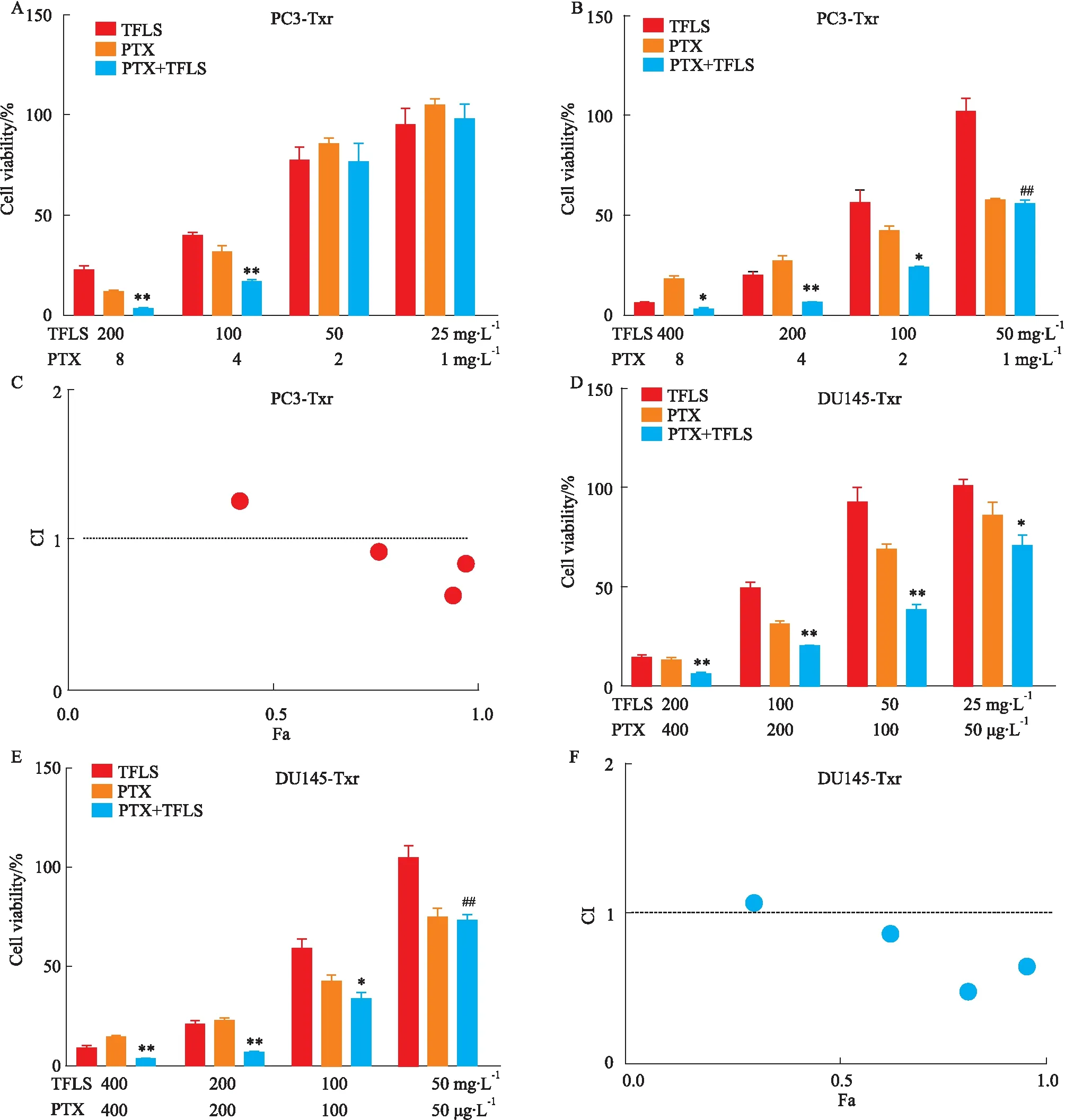
Fig 3 Effects of TFLS combined with PTX on proliferation of PC3-Txr and DU145-Txr cells n=3)A-B: Effects of TFLS combined with PTX on the proliferation of PC3-Txr cells; C: Fa-CI plot of PC3-Txr cells; D-E: Effects of TFLS combined with PTX on the proliferation of DU145-Txr cells; F: Fa-CI plot of DU145-Txr cells. *P<0.05, **P<0.01 vs TFLS, PTX; ##P<0.01 vs TFLS.
3 讨论
雄激素阻断疗法是目前PCa的主要治疗方法,大多数患者起初对阻断疗法敏感,但后期会逐渐发展为去势抵抗性PCa。以紫杉烷类药物为基础的化疗对去势抵抗性PCa有很好的治疗效果,但半数患者治疗一段时间后会出现PTX耐药,临床常常采取紫杉烷类药物联合其他药物的化疗方案来克服紫杉醇耐药改善PCa患者的预后[7]。近来研究表明,传统中医药在PCa的联合化疗中发挥着一定作用,如延长患者生存期、减轻临床症状和减少化疗不良反应等。荔枝核具有行气散结之功,因此不少临床中医师在治疗 PCa及其引起的癌痛时常配伍应用[8]。我们课题组前期研究发现,TFLS为荔枝核提取物的主要活性成分[9],TFLS可靶向AKT/mTOR和NF-κB双通路,诱导肿瘤细胞凋亡进而抑制PCa增殖,减弱PCa细胞EMT进而抑制PCa转移[4]。但是,TFLS对PCa-Txr细胞是否存在抑制作用,TFLS能否增加PCa-Txr细胞对PTX的敏感性,以及TFLS联合PTX对PCa-Txr细胞是否存在协同抑制作用,仍未清楚。
本次实验结果表明,TFLS对PC3-Txr和DU145-Txr细胞存在一定的时间-剂量依赖抑制作用,并且PC3-Txr和DU145-Txr细胞对PTX耐药具有特异性。据此我们探讨了TFLS能否增强PCa-Txr细胞对PTX的敏感性。有研究表明,在药物剂量未明显影响肿瘤细胞活性时,天然产物能增加肿瘤细胞对PTX的敏感性[10]。于是我们先后采用两个低细胞毒性剂量的TFLS提前处理或与PTX同时作用PCa-Txr细胞,观察不同处理方法下PTX的IC50值,结果显示不同处理方法下的PTX各时间段IC50值均无明显差异,提示TFLS不能增强PCa-Txr细胞对PTX的敏感性。
两药或多药物联用,除了增敏作用外,协同、拮抗和加和作用也是两药及多药联合应用的评价方式。单一药物与化疗药物联合应用抑制肿瘤进展与恶化往往存在协同作用,如蟾酥活性成分与索拉非尼联合应用抑制肝癌 HepG2 细胞生长[11],青蒿素联合紫杉醇抑制黑色素瘤B16细胞[12],白藜芦醇联合阿霉素对乳腺癌的抑制作用等[13]。为了进一步探讨TFLS与PTX是否存在协同作用,我们以单一药物作用耐药细胞IC50值为中心剂量,剂量范围在IC5-IC95之间,设置了两个不同比例的药物联合作用同一耐药细胞,观察TFLS与PTX联合应用对耐药细胞的增殖影响,并依据联合指数来评价两药联合应用的作用方式。结果显示,TFLS联合PTX能明显抑制PCa-Txr细胞的增殖,且两药抑制DU145-Txr细胞活性更明显。我们在前期研究中发现,TFLS可明显抑制PCa的增殖与转移,其分子机制可能与抑制AKT/mTOR和NF-κB信号通路有关,但对MAPK通路无明显影响[4],而PTX可通过靶向MAPK信号通路诱导肿瘤细胞的凋亡进而抑制肿瘤增殖[14]。研究显示AKT/mTOR、NF-κB 和MAPK等通路的异常活化与肿瘤恶化、转移及耐药等密切相关[15-16]。单一药物与PTX联合应用可靶向AKT和MAPK双通路协同地抑制恶性肿瘤,如衣霉素联合PTX在体内外均能促进细胞凋亡进而抑制乳腺癌[17],双重阻断AKT和MAPK活性能促进结直肠癌紫杉醇耐药细胞的凋亡而逆转对紫杉醇的耐药性[18]。因此,本研究中TFLS联合PTX对PCa-Txr细胞增殖的协同抑制作用,可能与两药联合靶向不同的信号通路有关,但其具体机制还有待进一步研究。
综上所述,TFLS可抑制PCa-Txr细胞的增殖,TFLS与PTX联合应用对PCa-Txr细胞存在协同抑制作用,但TFLS未能增加PCa-Txr细胞对PTX的敏感性。
