发酵黄精多糖对肥胖小鼠肠道菌群的影响
2021-04-09张智包智影孙家佳魏罡杨可心
张智 包智影 孙家佳 魏罡 杨可心
(东北林业大学 林学院,黑龙江 哈尔滨 150040)
近年来,高脂、高糖及不良的生活方式导致了肥胖的广泛发生,尤其是在经济迅速增长的发展中国家[1- 3]。体内脂肪积蓄或分布异常不仅严重影响身体健康,还会增加慢性病的患病率和死亡率,损害人们的心理健康[4]。肠道微生物可以影响营养物质的获取、能量的调节以及脂肪的储存、生成、氧化等,直接或间接地参与肥胖的发生,对维持人体健康和寄主体内平衡至关重要[5]。肠道微生物与粪便菌群结构密切相关,因此可通过对粪便中菌群的分析进一步研究肠道菌群的变化[6]。高通量测序技术是目前分子生物学中最前沿的研究方法,将其应用在肠道菌群的研究中,可从多方面对肠道菌群进行分析。
黄精属共有71种,有37种和1个变种的黄精被应用在药物中,其中根茎是应用最多的部分[7]。在中医领域,黄精属植物的根茎部被称作“黄精”。黄精中含多糖、皂苷等化合物[8],黄精多糖由不同相对分子质量的单糖构成,是黄精中占比最大的活性成分[9]。目前,热水[10]、乙醇[11]、酶[12]和超声波[13]等提取方式被广泛应用在植物多糖组分的提取中,而微生物法作为一种新兴的提取技术,因其低成本、环保、反应条件温和等特点,一直备受关注,成为了近年来研究的焦点。相关研究指出,微生物技术可提高植物中有效活性成分的溶出速率及提取率[14]。笔者在前期实验中对比了微生物法和热水浸提法对黄精多糖提取率的差异,发现微生物法的多糖提取率高达36.05%,比热水浸提法高23.92%。研究表明,黄精多糖具有的众多生物活性可以显著改善脂质代谢及其相关疾病。但是,微生物技术在黄精多糖提取中的应用目前仍较为鲜见。
有鉴于此,文中以微生物法来提取黄精多糖,并探究其对高脂膳食小鼠血脂水平和肠道菌群的影响,以期为开发黄精等功能食品提供实验依据。
1 材料与方法
1.1 材料和试剂
黄精,于2018年12月采自贵州省印江县,经贵州省中药材产业黄精专家组龙昌顺专家鉴定为百合科植物多花黄精的干燥根茎。植物乳杆菌,由东北林业大学林学院食品微生物实验室提供。60只清洁级雄性小鼠,体质量18~22 g,由黑龙江省中医药大学药物评价中心提供。总胆固醇(TC)测定试剂盒、甘油三酯(TG)测定试剂盒、高密度脂蛋白胆固醇(HDL-C)测定试剂盒、低密度脂蛋白胆固醇(LDL-C)测定试剂盒、肿瘤坏死因子-α(TNF-α)测试盒、白介素- 6(IL- 6)测试盒,南京建成生物工程研究所有限公司提供;D4015粪便基因组DNA提取试剂盒,美国OMEGA公司提供。邻苯二甲醛、牛磺胆酸钠、胆固醇,上海源叶生物科技有限公司提供;辛伐他汀,哈药集团制药总厂提供;其他试剂均为分析纯。
1.2 仪器与设备
TGL- 16G型台式离心机,上海安亭科学仪器厂生产;RT- 600型酶标仪,深圳雷杜生命科学有限公司生产;JA2003型分析天平,上海良平仪器仪表有限公司生产;DK- 8D型电热恒温水槽,上海森信实验仪器有限公司生产;RE- 52型旋转蒸发器,上海亚荣生化仪器公司生产;KT- 80A型恒温摇床,常州市中贝仪器有限公司生产。
1.3 实验方法
1.3.1 黄精预处理
将黄精除杂烘干,粉碎,过60目筛后浸泡于95%乙醇溶液中脱脂12 h,再置于通风处蒸干溶剂后得到脱脂黄精粉,储存在干燥器中备用。
1.3.2 黄精多糖的制备
菌种活化:将植物乳杆菌接入MRS培养基中,在37 ℃下培养16~18 h,如此传代2次,得到活化菌种,用于后续微生物法提取黄精多糖的工艺中。
热水浸提法提取黄精多糖的方法参考文献[15]并稍作修改。微生物法提取黄精多糖的方法参考文献[16]并结合前期实验结果,确定工艺如下:黄精粉添加量(质量分数,下同)4%,葡萄糖添加量0.37%,接种量6%,发酵温度37 ℃,发酵时间26 h。随后,将两种提取液在4 000 r/min下离心20 min,收集上清液,55 ℃下真空浓缩至原体积的1/3。经AB- 8大孔树脂进一步纯化后,用4倍体积的85%乙醇沉淀,4 ℃下静置12 h后真空抽滤,将滤渣烘干、磨粉得热水浸提法和微生物法黄精多糖,分别命名为PSP和FPSP。
1.3.3 胆酸盐吸附能力测定
取1 mL 2 mg/mL的多糖溶液,加入1 mL的0.01 mol/L HCl模拟肠胃环境,于37 ℃下恒温振荡1 h后,用0.1 mol/L的NaOH调节pH值至6.3,随后加入4 mL 10 mg/mL的胰酶(以pH值为6.3的0.1 mol/L磷酸缓冲液配制),在37 ℃下恒温振荡1 h,再加入4 mL 2 mg/mL的牛磺胆酸钠溶液(以pH值为6.3的0.1 mol/L磷酸缓冲液配制),继续在37 ℃下振荡1 h,以4 000 r/min的速度离心20 min后进行胆酸盐的测定,测定方法参考文献[17- 18]并略作修改。取上清液加入6 mL 60%的浓硫酸,于70 ℃下水浴20 min后流水冷却,再于387 nm处测吸光值。以吸光值(y)和牛磺胆酸钠含量(x)绘制标准曲线,线性关系为y=5.272 4x+0.102 5,r2=0.990 9。计算样品的牛磺胆酸钠吸附量,用mg/g表示:
牛磺胆酸钠吸附量=(A1-A2)/m。
式中:A1为吸附前样品中的牛磺胆酸钠质量,mg;A2为吸附后样品中的牛磺胆酸钠质量,mg;m为样品质量,g。
1.3.4 胆固醇吸附能力测定
取0.5 g多糖样品与100 mL 1 mg/mL的胆固醇溶液混合,分别调节pH值至2和7(模拟肠胃环境),在80 r/min、37 ℃下恒温振荡2 h。采用邻苯二甲醛法测定胆固醇含量[19]。取0.4 mL待测溶液加入0.2 mL邻苯二甲醛溶液和4 mL混酸(V浓硫酸:V冰乙酸=1:1),37 ℃下水浴10 min后,在550 nm处测定吸光值。根据吸光值(y)和胆固醇含量(x)绘制标准曲线,线性关系为y=3.688x-0.005 9,r2=0.999 0。计算样品的胆固醇吸附量,用mg/g表示:
胆固醇吸附量=(Q1-Q2)/m。
式中:Q1为吸附前样品中的胆固醇质量,mg;Q2为吸附后样品中的胆固醇质量,mg;m为样品质量,g。
1.3.5 动物实验设计
小鼠适应性喂养7 d后,根据体质量随机分为对照组(C)、模型组(GM)、辛伐他汀组(Y),以及FPSP高(GG)、中(GZ)、低(GD)剂量组,共6组,每组10只。除正常对照组饲喂基础饲料外,其余实验组饲喂高脂饲料。按表1连续灌胃8周,期间自由摄食、饮水。观察小鼠的饮食、精神状态及毛发情况,每7 d测定1次体质量[20]。

表1 小鼠分组及灌胃方式
1.3.6 样本采集与处理
末次给药后,禁食12 h。麻醉后眼球取血约1 mL 收集于离心管中,于4 ℃、3 000 r/min下离心15 min,分离血清。采血后脱颈处死,迅速剥离肝脏等内脏组织,用生理盐水清洗表面血水后擦干,称重。用生理盐水配制肝脏匀浆液(含量为10.0%),4 000 r/min下离心15 min,收集上清液用于进一步测定。收集新鲜粪便样本于灭菌离心管中,用于后续高通量测序。以上待测样本均于-80 ℃下保存备用。
1.3.7 血清和肝脏中生化指标的确定
根据测试盒提供的说明测定血清样本中的TG、TC、LDL-C、HDL-C水平;根据ELISA测试盒提供的说明测定肝匀浆液样品中的TNF-α和IL- 6水平。
1.3.8 肠道菌群分析
随机抽取待测样本进行测序和生物信息学分析。按照试剂盒提供的说明,利用E.Z.N.ATM Mag-Bind Soil DNA试剂盒(OMEGA公司生产)从每组中提取总细菌基因组DNA。利用Illumina MiSeq测序仪从微生物基因组DNA中选择通用引物341F(5′-CCCTACACGACGCTCTCTTCCGATCTG- 3′)和805R(5′-GACTGGAGTTTTCCTTGGCACCCGAGA ATTCCA- 3′)扩增16S rRNA V3-V4区DNA样本。
1.4 数据分析
实验结果以“均值±标准差”的形式表示,数据采用SPSS 19.0和Excel 2010进行处理,用LSD(最小显著性差异法)进行方差分析,分析组间差异,P<0.05则认为差异显著。
2 结果与分析
2.1 体外吸附实验结果与分析
牛磺胆酸钠是胆酸盐的主要成分之一。许多植物多糖由于可结合胆酸盐,阻断机体对胆酸盐的重吸收或将胆酸盐移除,所以具有一定的降脂作用[21]。文中对两种多糖样品的体外胆酸盐和胆固醇吸附能力进行了评价,结果见表2。由表2可知,FPSP和PSP都表现出很好的牛磺胆酸钠和胆固醇吸附能力,FPSP的胆固醇(pH值为7和2)和胆酸盐的吸附能力略高,分别为(109.04±6.46)mg/g、(102.86±8.04)mg/g和(337.08±21.02)mg/g。因此,综合以上分析结果,选择FPSP进行后续的动物实验。

表2 FPSP和PSP体外吸附实验结果
2.2 FPSP对体质量及内脏指数的影响
实验过程中,小鼠生长和精神状况良好,毛色正常,无异常死亡。说明FPSP灌胃含量适当,不会对小鼠的正常生长产生负面影响。由表3可知,实验过程各组小鼠体质量均呈上升趋势。实验进行4周之后,GM组出现了明显的肥胖和脂肪堆积,小鼠体质量显著高于其他组(P<0.05)。实验结束时,GM组小鼠体质量比C组小鼠增长25.40%,表明长期高脂饮食可导致肥胖的发生。FPSP的3个干预组(GD、GZ、GG)和Y组比GM组小鼠的体质量分别降低7.68%、14.65%、16.13%、11.97%,其中GZ、GG组与GM组差异显著(P<0.05)。
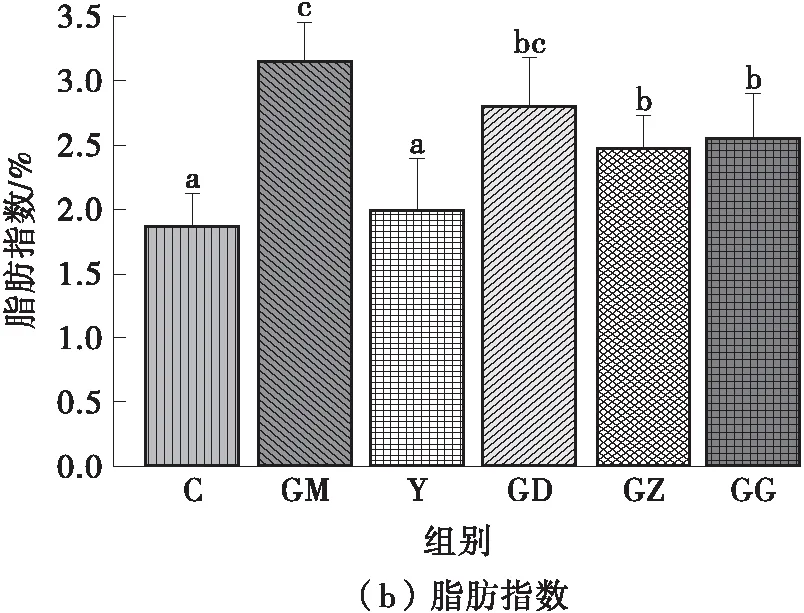
解剖过程中,记录小鼠的内脏质量并计算相应的脏器指数,发现GM组小鼠的肝脏和睾周脂肪组织的质量远高于其他组。由图1可知:GM组小鼠的肝脏、脂肪指数均显著高于C组(P<0.05);辛伐他汀干预的Y组可逆转肥胖小鼠的这两个指数,且与C组无显著差异(P>0.05);FPSP干预8周后,与GM组相比,GZ组、GG组小鼠的脂肪指数显著降低,GD组、GZ组、GG组小鼠的肝脏指数均显著降低(P<0.05)。总之,FPSP干预可抑制脂肪堆积和肝脏异常肿大,其中,中、高剂量的干预效果最突出。然而,各组小鼠的脾脏、肾脏指数均无显著差异(P>0.05)。
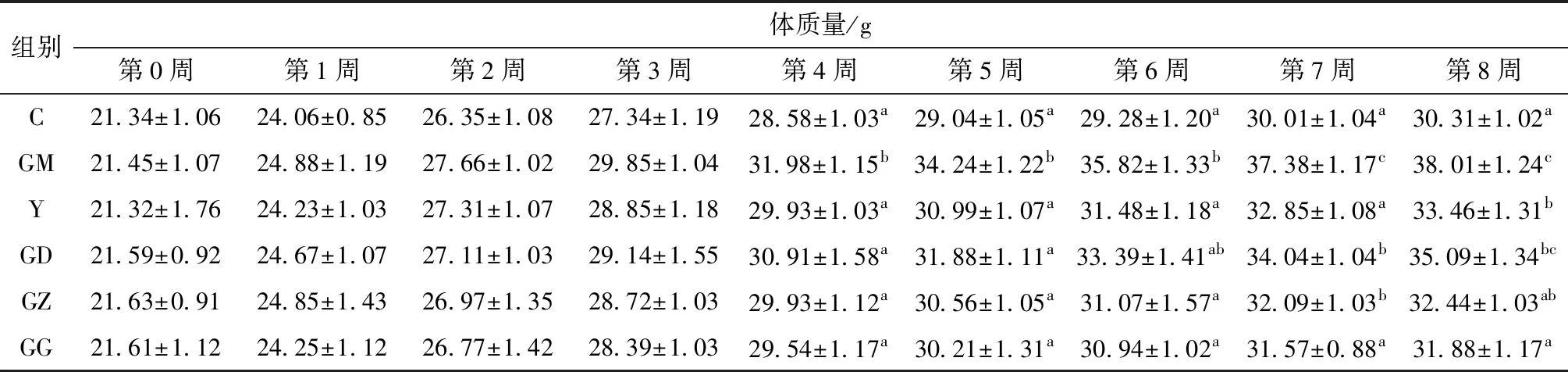
表3 实验过程中各组小鼠的体质量变化1)

不同小写字母代表差异显著(P<0.05),下同
2.3 FPSP对血脂水平的影响
图2所示为FPSP对实验小鼠血脂水平的影响。由图2可知:高脂饮食使GM组小鼠的TC、TG和HDL-C水平显著增加(P<0.05);相反,辛伐他汀干预可明显改善高脂膳食小鼠的血脂水平,Y组和C组无显著差异(P>0.05)。这说明FPSP显著改善了高脂膳食小鼠的血脂异常状态,其中,中、高剂量FPSP能显著改善小鼠的血清TC、TG水平,高剂量FPSP能显著改善小鼠的血清HDL-C和LDL-C水平(P<0.05),且与Y组无显著差异(P>0.05)。
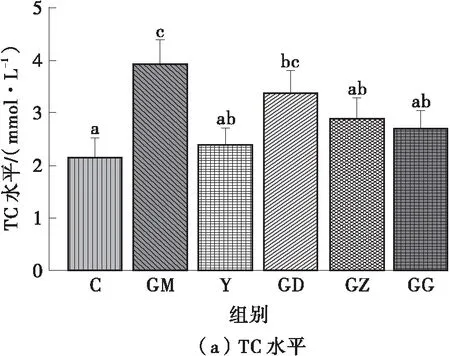
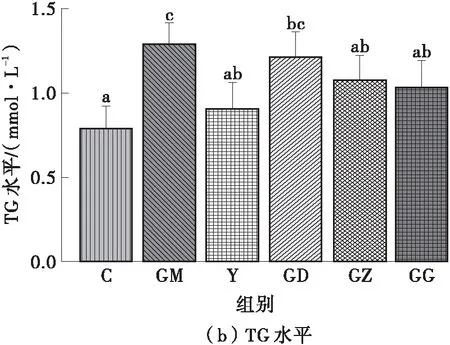
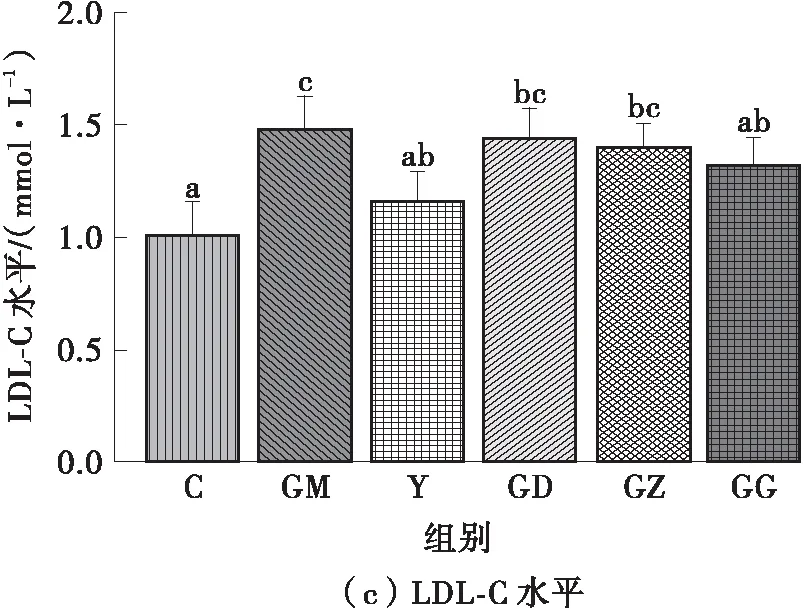
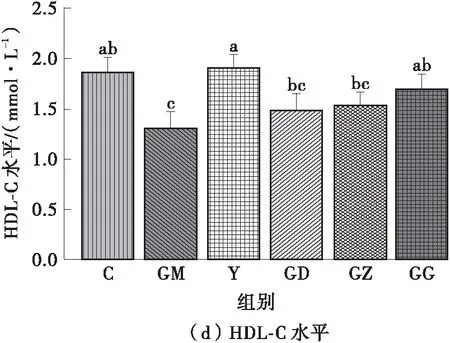
图2 FPSP对实验小鼠血脂水平的影响
2.4 FPSP对促炎因子水平的影响
肝脏在调节脂代谢过程中起重要作用。许多研究表明,肥胖的发生与炎症反应存在相关性,常伴随促炎因子的释放,例如TNF-α、IL- 1β和IL- 6。因此,文中对肝脏中TNF-α和IL- 6的水平进行分析。如图3所示,高脂饮食干预8周后,与C组相比,GM组小鼠肝脏中的TNF-α和IL- 6含量显著增加(P<0.05),此结果与文献结果[22]相似。不同剂量的FPSP干预对高脂饮食小鼠肝脏中的促炎因子均表现出抑制作用,干预效果随干预剂量增大而增强。GG组小鼠肝脏中IL- 6和TNF-α的含量比GM组小鼠分别降低37.68%和26.48%。因此,可推断FPSP对高脂饮食小鼠的机体炎症反应具有缓解作用,可有效阻碍促炎因子的分泌。实验结果还显示,相比于TNF-α,FPSP对促炎因子IL- 6的异常升高的抑制效果更明显。有研究表明,IL- 6与动脉粥样硬化、II型糖尿病的发病有关,因此推测FPSP还可以缓解由高脂饮食引起的其他代谢疾病,例如动脉粥样硬化、糖尿病等导致的IL- 6水平升高,但具体原因仍需进一步实验验证。

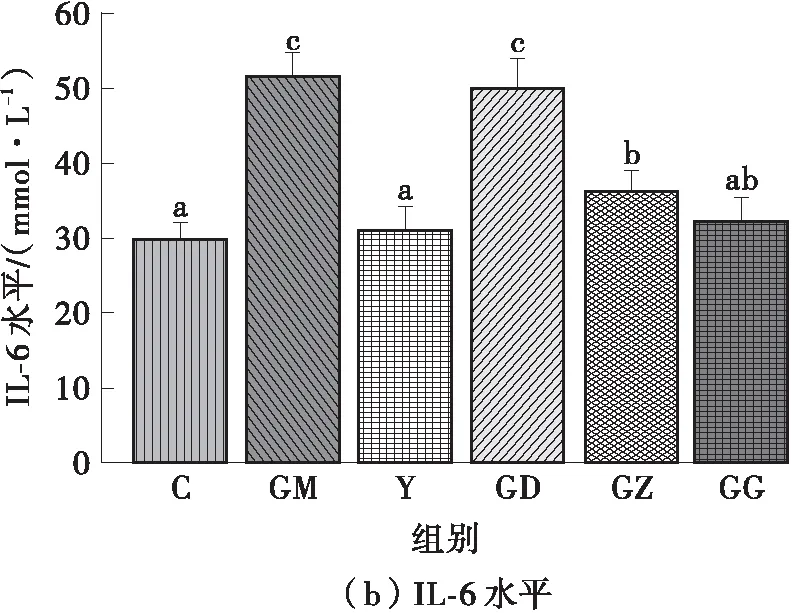
图3 FPSP对高脂饮食小鼠肝脏中促炎因子水平的影响
2.5 FPSP对肠道菌群的影响
2.5.1 OTU Venn图分析
Venn图用于统计多个样本中共有和独有的OTU的数量,直观展现环境样本的OTU数目相似性及重叠情况。OTU数量也可代表样本物种的丰度。如图4所示,3组样本共检出3 428个OUT;C组、GG组、GM组的OTU总数分别为976、1 216、1 236个,且相似度在97%以上,其中C组与GM组共有的OTU为498个,C组与GG组共有的OTU为518个,而GG组与GM组共有的OTU高达746个,相比之下GG组与GM组的相似性及重叠性更高。这说明,高脂饮食喂养的小鼠(GG组和GM组)肠道菌群的组成结构与正常组小鼠(C组)的存在一定差异。但分别比较C组与GG组、GG组与GM组、GM组与GG组共有的OTU数量可发现,FPSP干预对于逆转小鼠肠道菌群组成结构的效果并不明显,推测其原因,可能是FPSP干预时间不够导致的,但具体仍需进一步实验验证。
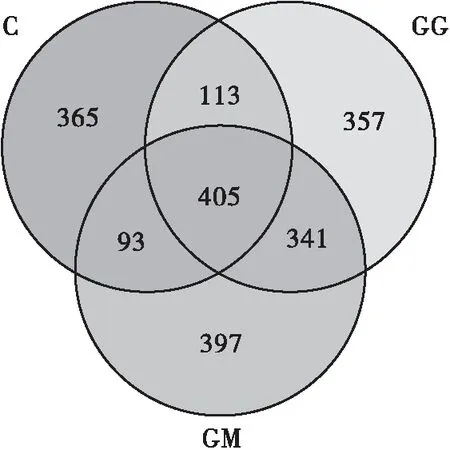
图4 不同样本的韦恩图
2.5.2 菌群α多样性分析
α(Alpha)多样性指数包括Chao1指数、ACE指数、Shannon指数、Simpson指数和Coverage指数等,用于分析97%相似水平下的OTU信息,进行样本内微生物群落丰富度、多样性及测序深度的评估。同一菌群的不同物种可用Chao 1指数和ACE指数评价菌群丰度,Shannon指数和Simpson指数则用于评价菌群多样性。样本的Chao1指数、ACE指数、Shannon指数越低,Simpson指数越高,说明样本的微生物丰度及多样性越低。Coverage指数为各样本文库的覆盖率,其数值越接近1,表明样本测序结果越符合真实情况。表4所示为各组样本的α多样性指数。可以看出,3组样本的Cove-rage指数都是0.99,表明该次样本测序结果可代表样本的真实情况。α多样性分析显示,与C组相比,GM组小鼠的Chao1指数和Shannon指数升高,Simpson指数降低,表明此次实验的高脂膳食改变了小鼠肠道菌群的多样性及丰度。综合对比3组样本的Chao1指数、ACE指数、Shannon指数和Simpson指数,其中微生物多样性最高的是GM组,其次是GG组和C组,说明FPSP逆转了高脂组小鼠肠道微生物的多样性。
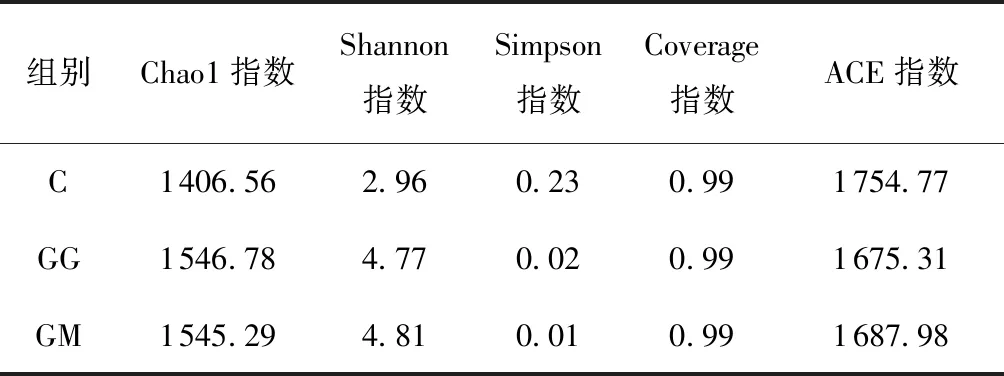
表4 各组的α多样性指数
2.5.3 菌群结构分析
如图5所示,3组小鼠粪便样本在门(Phylum)水平上的主要优势菌群有:Firmicutes、Bac-teroidetes、Proteobacteria、Antinobacteria,总占比均在98%以上。Firmicutes和Bacteroidetes在C组样本中的总占比最大,为97.17%;其次为GG组,总占比为91.94%;GM组样本中的总占比最小,为89.49%,比C组降低7.9%,比GG组降低2.7%。Proteobacteria和Antinobacteria在C组样本中的占比均最低,分别为0.98%和0.75%;其次为GG组,占比分别为3.52%、4.05%;而在GM组中的占比高达4.05%和4.76%;GG组样本中的占比较GM组分别降低13.08%和39.08%,与C组更为接近。这说明,长期高脂膳食会破坏小鼠原有的菌群比例,引起小鼠肠道菌群紊乱,而FPSP具有缓解高脂膳食导致的肠道菌群失调的作用。另外,Proteobacteria多数属于致病菌,例如Escherichiacoli、Salmonella、Vibriocholerae、Helicobacter等,因此,FPSP还具有抑制有害菌生长、促进益生菌增殖的功能。
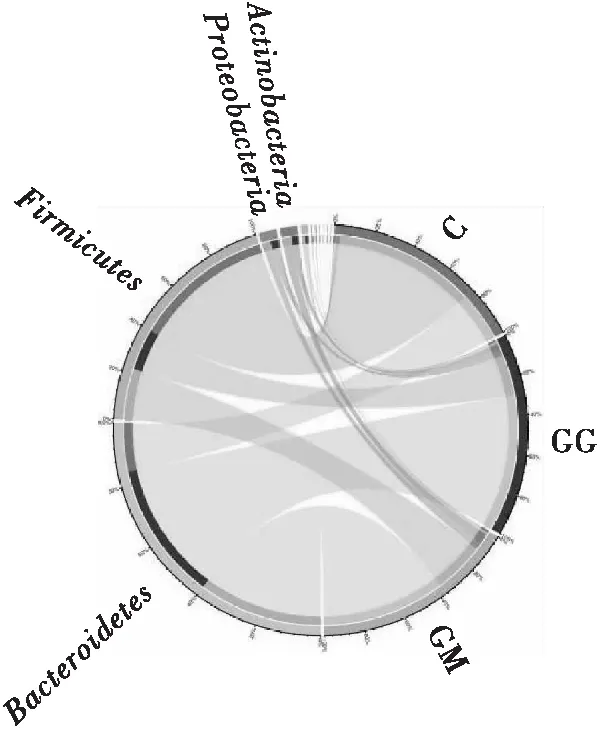
图5 门水平样本群落结构分布图
如图6所示,3组小鼠的肠道菌群在属(Genus)水平上的菌群组成包括Lactobacillus、Barnesiella、Bacteroides、ClostridiumXIVa、Coprobacter、Alistipes等多个菌属。其中,Lactobacillus是一种典型的益生菌,属于Firmicutes,对于肠道健康和血脂代谢指标具有有益影响,可有效提高TC和TG水平,促进体质量增加。Lactobacillus可增强机体免疫力和抵抗力,调节肠道微生物平衡,促进肠道有益菌的定植,改变肠道中短链脂肪酸的组成,已经被广泛用来调节肠道微生态环境及改善代谢类疾病[23]。在本次实验中,Lactobacillus是3组样本的高丰度菌群之一,在C组、GG组和GM组样本中的比例分别为58.39%、2.09%和1.72%,因此推测Lactobacillus在调节血脂水平方面具有重要作用,并且Lactobacillus丰度的降低可能和高脂血症发病相关[24]。Barnesiella是一种厌氧菌,可以抑制肠道中有害菌的生长[25],为机体提供必须的营养物质,但有时也会导致感染和脓肿。Clostridium能够释放多种微生物及抑制有害菌生长,但也会产生毒素引起感染[26]。C组样本中的主要菌群包括Lactobaci-llus、Barnesiella、ClostridiumXIVa,这3种菌属共占菌群总量的70.29%(其中Lactobacillus占菌群总量的58.37%)。GG组和GM组样本中的主要菌群包括Barnesiella、Bacteroides、ClostridiumXIVa、Coprobacter,这4种菌属共占GG组、GM组样本中菌群总量的41.78%、42.36%,而Lactobacillus占比仅为2.09%和1.72%,GG组样本中Lactobaci-llus占比较GM组提高了21.51%。以上结果说明,高脂饮食会导致肠道菌群中Lactobacillus的比例大大降低,经适当剂量的FPSP干预后可恢复Lactobacillus的比例,使GG组菌群比例与C组更为接近。由此可推测,FPSP有改善长期高脂膳食小鼠粪便菌群的多样性、结构和丰度的作用,能促进乳酸菌等益生菌的增殖。
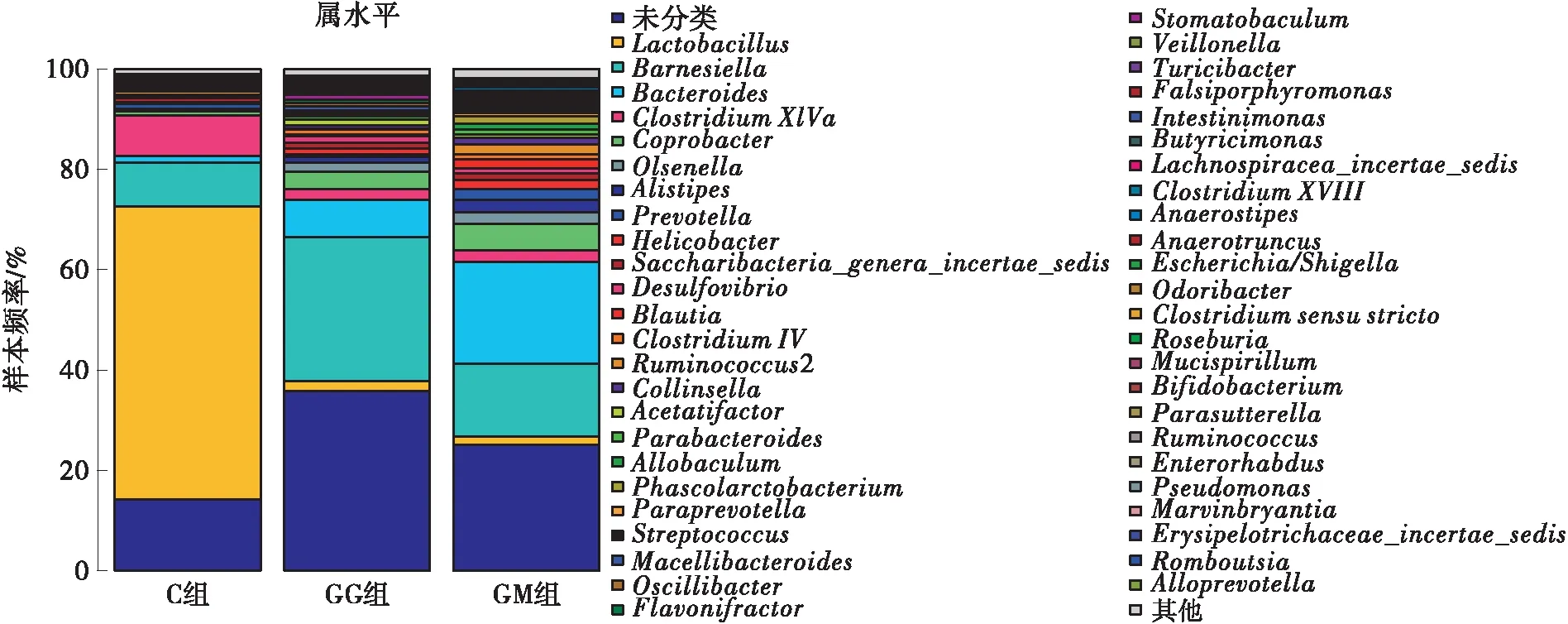
图6 属水平样本与物种的关系
另外,FPSP干预也提高了GG组小鼠肠道Oscillibacter和Barnesiella的丰度。在肠道厌氧细菌中定殖的Oscillibacter和Barnesiella将不能消化的碳水化合物发酵成短链脂肪酸,包括丙酸和丁酸。研究显示高脂饮食喂养下采用丁酸干预可以抑制肥胖的发生,产丁酸微生物对某些患有代谢类疾病的患者有益[25]。短链脂肪酸可直接被肠道吸收,随着肠道中短链脂肪酸含量的增加,肠道中pH值降低,抑制了有害微生物的生长,同时促进了能量代谢,抑制了炎症反应,对维持机体的健康至关重要。FPSP可有效抑制机体炎症反应的效能,可能与其能降低机体促炎因子的分泌有关。Blautia菌属是高脂模型小鼠肠道中的特殊菌群,据报道Blautia也参与了乙酸盐和丁酸盐的形成[27]。
文中还对一些低丰度的有害菌(例如Helicobacter、Streptococcus、Alistipes菌属)的丰度变化进行了分析,这些菌都与感染和炎症相关。Helicobacter是一种普遍的传染性疾病病原菌,被认为与哺乳动物胃炎和肝炎等感染性疾病密切相关[28]。Streptococcus是一种普通的化脓性球菌,属于条件致病菌,能够引起化脓炎症反应、毒素疾病和过敏性疾病等[29]。Alistipes与肠道炎症反应有关[30]。在本次实验中,FPSP干预可抑制高脂饮食喂养引起的小鼠肠道中这3种菌属比例的升高。
同时,一个值得关注的现象是:在GM组小鼠肠道的低丰度微生物中,一些有益菌比例有所增加,例如Bacteroides、Prevotella,而一些有害细菌的比例降低,例如Veillonella。这一情况可能是因为高脂血症患病早期肠道微生物的自我调节,也可能是高脂血症患病早期的一个标志。
2.6 功能预测分析
通过对已有测序微生物基因组基因功能的构成进行分析,可由16S测序获得的物种构成推测样本中功能基因的构成,从而分析不同样本和分组在功能上的差异。碳水化合物代谢、氨基酸代谢、能量代谢、脂质代谢等途径是3组样本的主要代谢途径。如图7、8所示,GG组比GM组有更多与C组差异显著的代谢途径,在GG组,大部分代谢途径被激活,小部分代谢途径被抑制,这一变化可能与发酵黄精多糖改善代谢疾病(例如高脂血症)的功能有关。
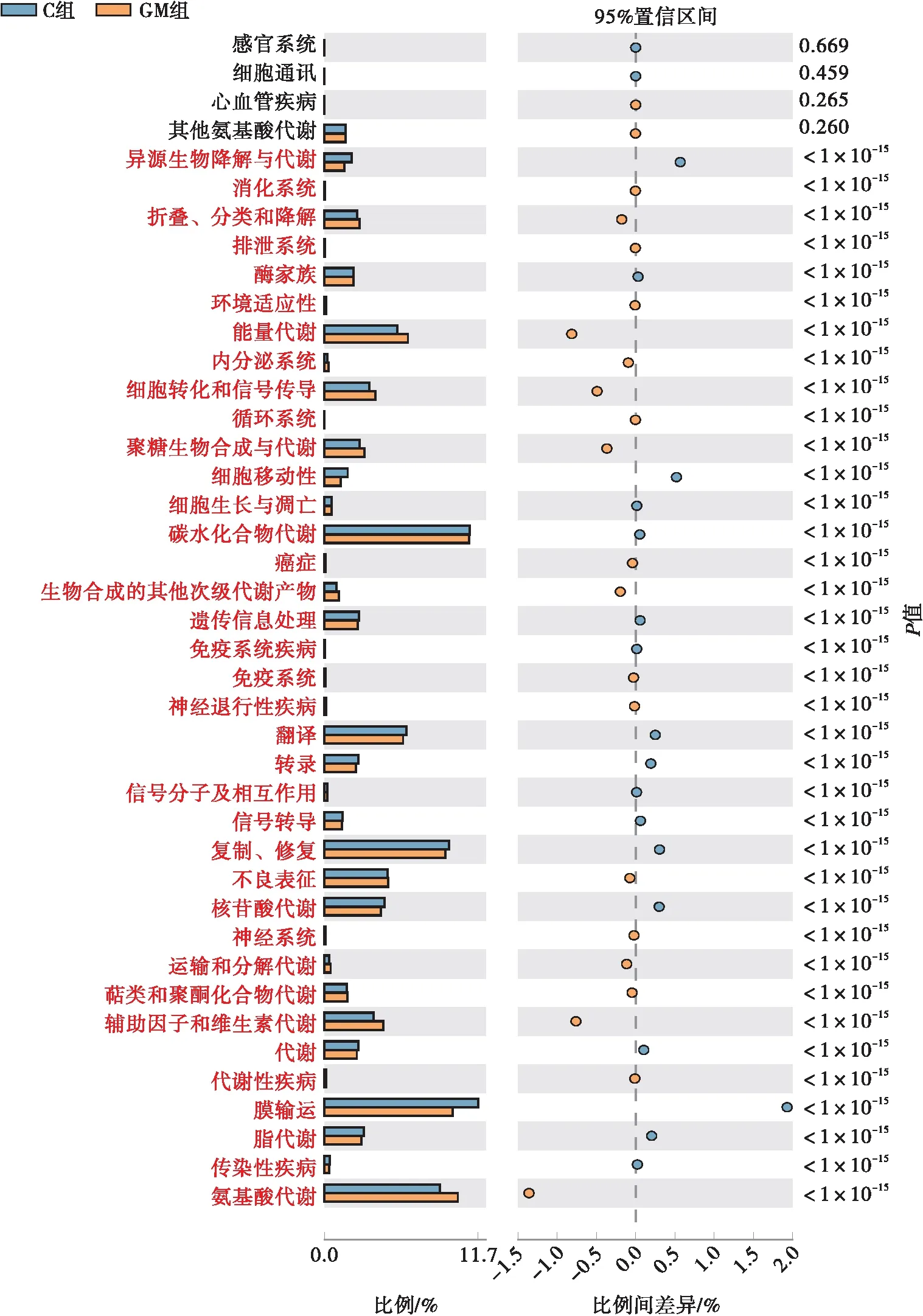
图7 C组与GM组间差异比较的误差图
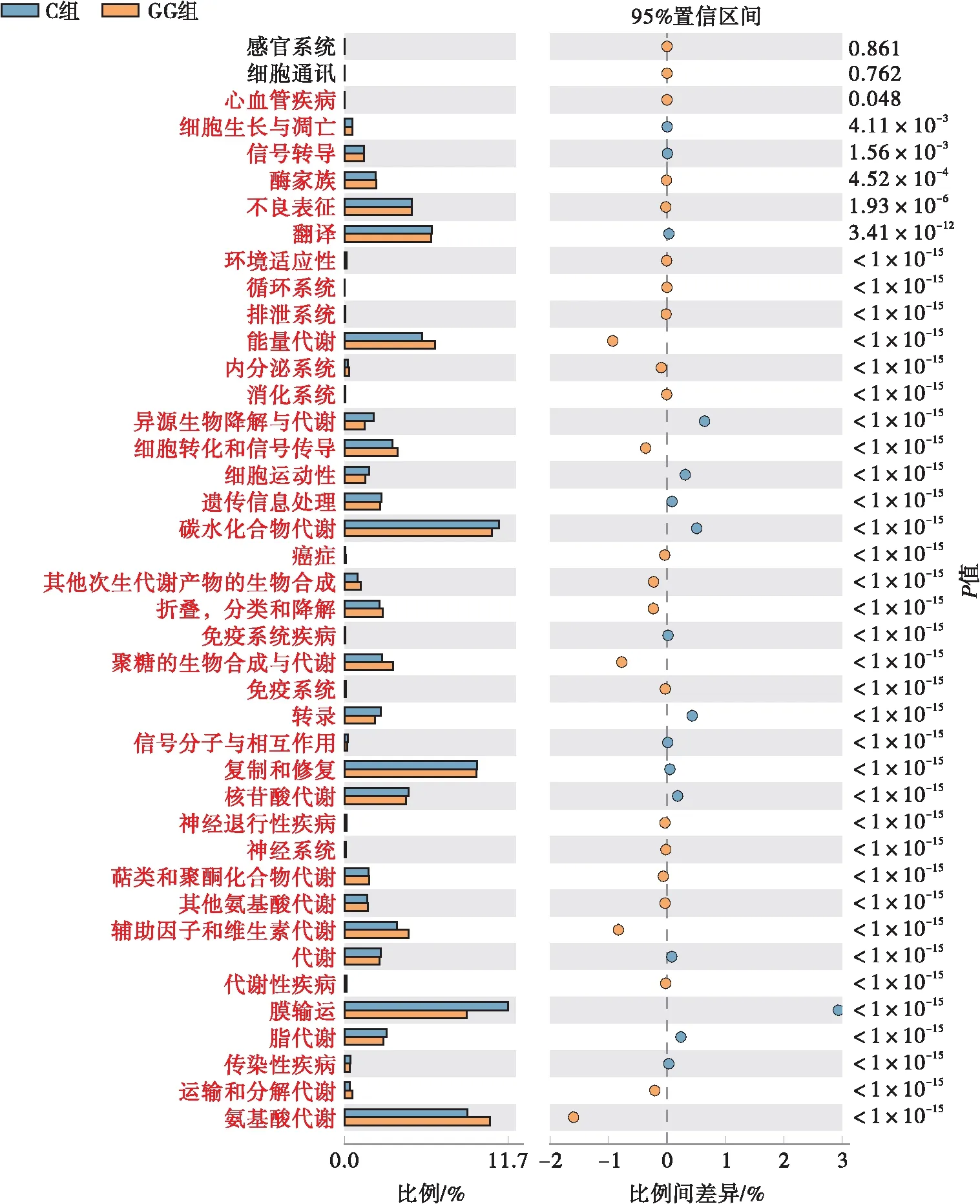
图8 C组与GG组间差异比较的误差图
3 讨论
文中首先以体外胆固醇和胆酸盐结合能力为指标,筛选出具有更好的降血脂能力的FPSP进行动物实验,然后通过高脂膳食建立高脂小鼠模型,进一步验证FPSP对高脂小鼠血脂水平的改善作用,并结合高通量测序技术,深入分析FPSP对小鼠肠道菌群的影响,为黄精及其产品的深入开发提供数据和理论支撑。
利用微生物法提高中药植物利用率是近年来开发中草药疗效的一个新思路,经微生物的强大酶系修饰后,可有效提高产率并获得更好的治疗效果[31]。同时,中草药植物的主要活性成分可抑制致病菌,促进有益细菌的增殖,调节菌群结构,加强肠道粘膜屏障,恢复肠道的稳定状态。吴泊等[32]采用微生物法对中药红花进行发酵处理并经动物实验发现,发酵处理增强了中药红花的溶血栓药效。文中研究也表明,微生物法提取的黄精多糖可显著调节血脂水平,促进TC和TG从血液向肝脏的转运,从而对高脂血症产生有益作用,增加胆固醇的排泄或抑制胆固醇的合成。
肠道菌群在肥胖的形成过程中,其代谢产物可作用于脂肪、肝脏及大脑等其他组织器官,参与和肥胖发生相关的病理生理机制[33- 34]。赵唐[16]探究了发酵处理后复方中药对小鼠肠道菌群的影响,发现复方发酵中药增加了小鼠肠道中有益菌的相对丰度,降低了某种条件致病菌的相对丰度,对小鼠肠道菌群表现出明显的有益调节作用。文中研究也表明,高脂膳食可导致肠道中优势菌群结构及丰度的改变,这与相关文献的研究结果一致[35]。经FPSP干预后,小鼠粪便菌群的菌群结构得到缓解,Lactobacillus、Barnesiella占比增加,Bacteroides、ClostridiumXIVa占比降低,表明FPSP具有抑制有害细菌群、促进有益菌群增殖、调节肠道菌群的作用。
综上所述,文中研究结果表明,FPSP可改善高脂小鼠的血脂水平,并对小鼠的肠道菌群具有有益的调节作用,可进一步缓解由高脂膳食引起的血脂代谢紊乱症状。
