IL-22和IL-2在四甲基哌啶减轻三氯乙烯致敏小鼠肝损伤中的表达
2021-04-09黄丽萍张家祥朱启星
姜 伟,杨 呓,黄 猛,黄丽萍,张家祥,朱启星,2
三氯乙烯(trichloroethylene,TCE)是一种传统有机溶剂,广泛存在于工业生产中。部分接触TCE的工人会出现职业性三氯乙烯药疹样皮炎(occupational medicamentosa-like dermatitis due to TCE, OMLDT),OMLDT患者发病过程中常会出现肝脏损伤,其中肝功能衰竭是该患者死亡的主要原因之一。因而TCE介导的免疫性肝损害的机制探究在OMLDT发病及防治中很有意义。研究显示, OMLDT患者及TCE接触动物体内氧化应激相关指标均有升高迹象,脏器损伤部位检测到氧化应激升高。过量ROS通过多种途径由多种细胞因子的联合作用造成不同程度肝脏损伤。白细胞介素(interleukin,IL)-22是机体调节组织应答炎症反应重要的小分子蛋白质,兼有保护和增强炎症应答的双重功能;IL-2作为细胞生长因子,不仅能增强机体的免疫监视作用,而且能诱导T细胞增殖与分化,在机体调节中有着不可或缺的作用。氧化应激可介导炎症因子释放从而加重机体损伤,但在TCE致敏小鼠免疫性肝损伤过程中的机制还未阐明。为此,该研究基于TCE致敏小鼠模型,使用Tempol抑制小鼠氧化应激观察在TCE致敏小鼠免疫性肝损伤中IL-22和IL-2表达水平,探究氧化应激在TCE致肝脏损伤的作用机制。
1 材料与方法
1.1 实验试剂与仪器
三氯乙烯(TCE分析纯)、Tempol及弗氏完全佐剂购自美国Sigma公司,谷草转氨酶(AST/GOT)、谷丙转氨酶(ALT/GPT)及丙二醛试剂盒购自南京建成科技公司,橄榄油和丙酮购自国药集团,苏木精-伊红(HE)染液、IHC检测试剂盒购自北京中杉金桥公司,RIPA裂解试剂、5×蛋白上样缓冲液、PMSF、BCA试剂盒和一抗稀释液购自上海碧云天公司,多克隆抗体IL-22(bs-2623R,兔来源)和IL-2(bs-1191R,兔来源)购自中国博奥森公司,单克隆β-actin一抗(KM9001T,小鼠)购自天津三箭公司,Universal 320/320R低温高速离心机(型号:LD5-2A,德国Hettich公司),显微镜( 型号:BX53+DP26,日本Olympus公司) ,电泳电源(型号:EPS 300,中国Tanon公司),Image Pro Plus软件(美国Media Cybernetics公司),艾科浦纯水机(型号:ASW1-0501-V,重庆颐洋企业发展有限公司)。1.2 动物
40只SPF级Balb/c小鼠购自安徽省实验动物中心,6~8周龄,雌性,16~18 g。于温度 20~25 ℃、湿度为60%左右无特定病原菌的室内饲养,自主摄取清洁的食水,人工控制各12 h的昼夜节律。该实验相关内容经由安徽医科大学实验动物伦理委员会审查并批准。1.3 方法
1.3.1
动物处理 将Balb/c小鼠进行7 d适应性喂养,用简单随机抽样法将其分为空白组(5只)、溶剂组(5只)、TCE组(15只)与TCE+Tempol组(15只)。TCE小鼠致敏模型参考该课题组前期建模方法,每次染毒前将小鼠腰背处除去2 cm×2 cm范围大小的鼠毛,实验第1天给TCE组和TCE+Tempol组背部皮下注射50%TCE(体积比为TCE ∶橄榄油 ∶丙酮=5 ∶2 ∶3)和等体积的FCA溶液共100 μl混合液,溶剂组则后背皮下注射无TCE等体积比的橄榄油同丙酮混合溶液;第4、7、10天, TCE组和TCE+Tempol组背部涂抹100 μl 50%TCE(体积比为TCE ∶橄榄油 ∶丙酮=5 ∶2 ∶3),溶剂组后背涂抹无TCE等体积比的橄榄油同丙酮混合液;第17、19天对TCE组和TCE+Tempol组背部涂抹100 μl 30%的TCE(体积比为TCE ∶橄榄油 ∶丙酮=3 ∶2 ∶5)进行激发处理,溶剂组则涂抹等体积比的橄榄油和丙酮但不含TCE的混合溶液。在第19天末次激发前30 min给TCE+Tempol组每只小鼠腹腔注射100 mg/kg的Tempol试剂,TCE组和溶剂组则使用等量0.9%氯化钠溶液代替注射。空白组不作处理。1.3.2
皮肤致敏评分 在小鼠末次激发24 h后观察皮肤致敏状态并对其反应给分:皮肤没有反应不得分,存在小块红斑或离散红斑得1分,有轻度水肿或中度弥漫性红斑得2分,有严重红斑或水肿评为3分。背部皮肤评分分数≥1分为致敏小鼠,将TCE组和TCE+Tempol组由此再分作致敏阳性组和致敏阴性组。1.3.3
肝脏组织采集 小鼠于末次激发72 h后用水合氯醛腹腔注射麻醉后眼静脉取全血,颈部脱臼法处死小鼠剖取肝脏。取每只小鼠相同位置的肝脏组织,部分存放在4%多聚甲醛溶液里固定,制成石蜡切片进行小鼠肝脏组织的病理学变化以及相关炎症指标的检测,其余分装于-80 ℃保存,用于后续检测。1.3.4
TBA法检测MDA含量 称取50 mg肝组织加入450 μl 0.9%氯化钠溶液后匀浆, 4 ℃、12 000 r/min离心10 min取上清液。MDA检测按说明书操作:准备空白管、标准管、测定管、对照管,向标准管中加入0.1 ml的10 nmol/ml标准品,向空白管加0.1 ml无水乙醇,测定管和对照管各加0.1 ml测试样品,4个离心管均加0.1 ml试剂一,将4管溶液各自摇晃混匀;给4个离心管分别加入3.0 ml试剂二;对照管加1.0 ml 50%乙酸,其余3管均加1.0 ml试剂三;用封口膜给所有离心管封口再用针头在膜上刺孔,放入95 ℃水中孵育40 min,冰水中快速降温至室温,4 000 r/min离心10 min,取上清液,1.0 cm光径,三蒸水校准后于532 nm波长测各管吸光度值,BCA法测定上清液蛋白浓度,计算得MDA含量。1.3.5
肝脏组织HE检查 用固定于4%多聚甲醛溶液中的肝脏石蜡包埋处理,制成4 μm厚薄片,经由二甲苯和乙醇梯度脱蜡后,流水冲洗水化。PBS清洗后滴加苏木精染色3 min后水冲洗4 min,再用伊红染色1 min,流水冲洗后烤干,封片。光学显微镜观测组织病理损伤情况。1.3.6
血清AST、ALT测定 将小鼠血清分离后按照AST、ALT试剂盒说明书进行实验,先制作标准曲线再加样于96孔板,孵育后使用酶标仪在510 nm波长处检测吸光度值(optical density,OD),应用标准曲线分析得AST、ALT活力值。1.3.7
免疫组化检测肝脏中IL-22和IL-2表达 将4 μm厚石蜡切片放入烤片机中98 ℃烤片20 min,依浓度高低从二甲苯到乙醇完成脱蜡和水化,经流水及PBS清洗,HO除去内源性生物素,PBS洗后加枸橼酸钠在微波炉中热抗原修复,后自然冷却,PBS洗后加山羊血清于恒温箱内封闭,加对应一抗(IL-22抗体或IL-2抗体),存放在4 ℃冰箱过夜,隔日拿出后恢复至室温再PBS清洗,滴加二抗(山羊抗小鼠/兔IgG聚合物),放37 ℃ 恒温箱中15 min,PBS清洗后加辣根过氧化物酶试剂于37 ℃汽浴15 min,取出用PBS洗涤后加DAB着色,流水灌洗后苏木精染核,水洗去多余残液,烤干封片,显微镜下观察并拍片,用Image Pro plus进行处理,测定OD。1.3.8
Western blot检测IL-22和IL-2蛋白水平 RIPA加PMSF提取肝脏总蛋白后经BCA法检测肝脏总蛋白浓度,蛋白液待浓度变性后取20 μg成品上样,SDS-PAGE电泳分离,转膜,牛奶封闭,加入相应抗体IL-22(1 ∶1 000)、IL-2(1 ∶1 000)及β-actin(1 ∶1 000)孵育过夜,洗涤后加入对应的兔来源二抗和小鼠来源二抗(1 ∶5 000)室温反应2 h。洗涤后加入1 ∶1配成的ECL化学发光试剂经化学发光成像系统成像,用Image Pro Plus 6.0软件将目的蛋白条带与内参蛋白条带进行比较判断各组IL-22和IL-2蛋白相对表达水平。
2 结果
2.1 小鼠致敏评分结果
空白组与溶剂组小鼠背处皮肤皆无异常。TCE组和TCE+Tempol组小鼠致敏率分别为40.0%和33.3%,差异无统计学意义(P
>0.05),见表1。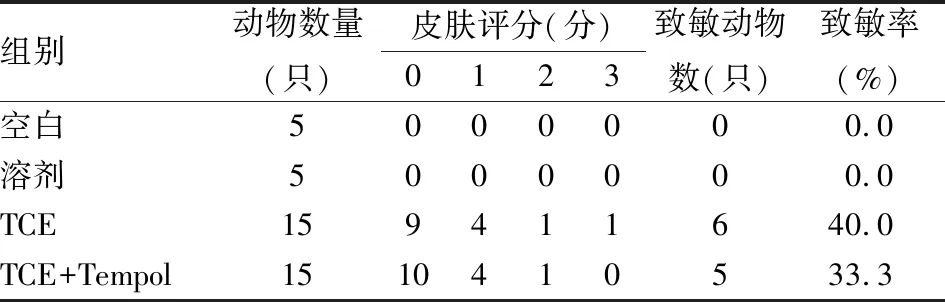
表1 小鼠背部皮肤致敏评分[ n(%)]
2.2 肝脏组织MDA含量
致敏阴性组、溶剂组与空白组小鼠相比,肝组织中MDA含量无明显变化,差异无统计学意义。同溶剂组及致敏阴性组比较,TCE致敏阳性组和TCE+Tempol致敏阳性组小鼠肝组织中MDA含量均有上升,差异有统计学意义(P
<0.05);同时与TCE致敏阳性组相比,TCE+Tempol致敏阳性组含量有下降,差异有统计学意义(P
<0.05,F
=50.33,P
=0.017 6)。见图1。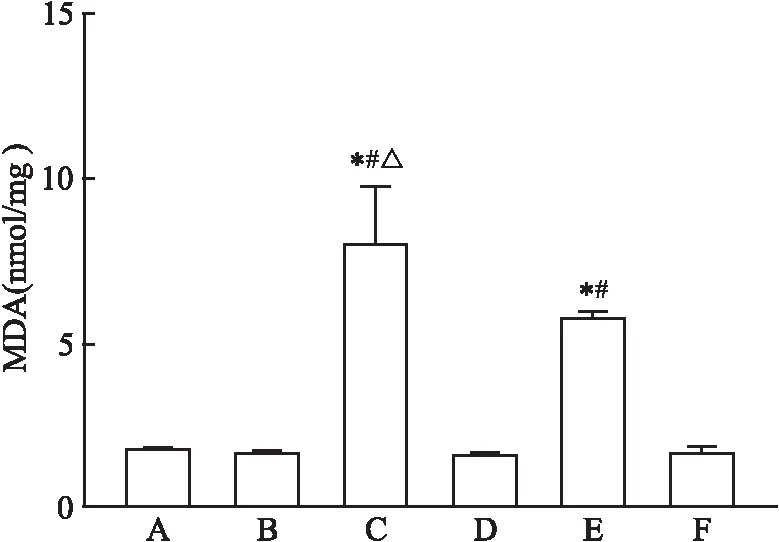
图1 肝脏组织中MDA含量A:空白组; B:溶剂组; C:TCE致敏阳性组;D:TCE致敏阴性组;E: TCE+Tempol致敏阳性组;F: TCE+Tempol致敏阴性组;与溶剂组比较: *P<0.05;与致敏阴性组比较: #P<0.05;与TCE+Tempol致敏阳性组比较:△P<0.05
2.3 肝脏HE检测结果
空白组、溶剂组、致敏阴性组小鼠肝组织均未见明显异常。TCE致敏阳性组小鼠肝细胞存在明显空泡样变性,胞质呈现疏松状态且细胞有水肿表现,而TCE+Tempol致敏阳性组表现为部分区域有水肿的肝细胞,面积有所减少,较TCE致敏阳性组肝损伤有减轻。见图2。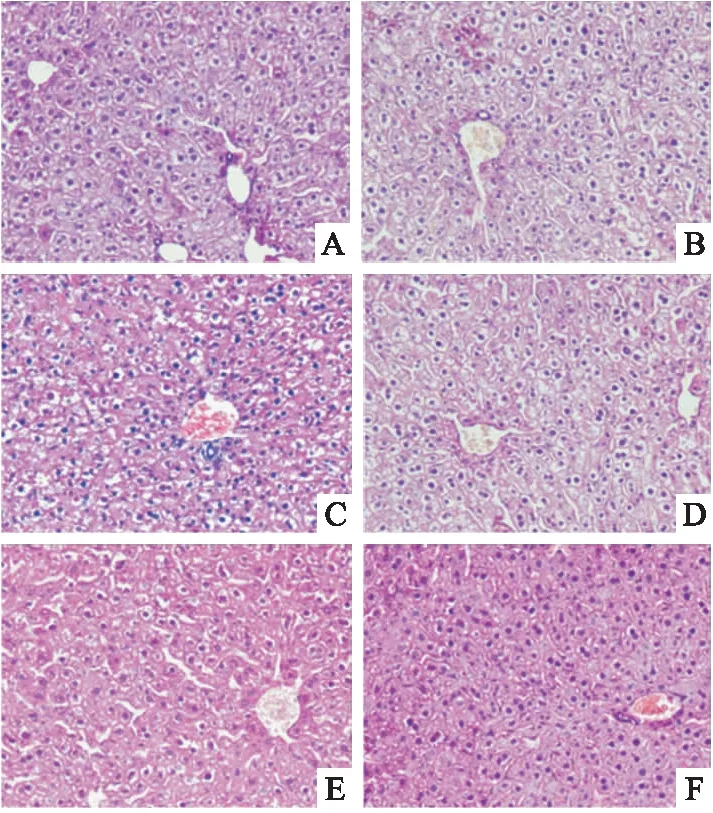
图2 小鼠肝脏HE染色 ×400A:空白组;B:溶剂组;C:TCE致敏阳性组;D:TCE致敏阴性组;E: TCE+Tempol致敏阳性组;F: TCE+Tempol致敏阴性组
2.4 血清AST、ALT含量
致敏阴性组、溶剂组与空白组小鼠相比AST、ALT含量无统计学意义。与溶剂组、致敏阴性组比较,致敏阳性组小鼠血清内AST、ALT水平均上调;同时与TCE致敏阳性组相比,TCE+Tempol致敏阳性组小鼠的AST、ALT水平有所下调,差异有统计学意义(P
<0.05 )。见图3。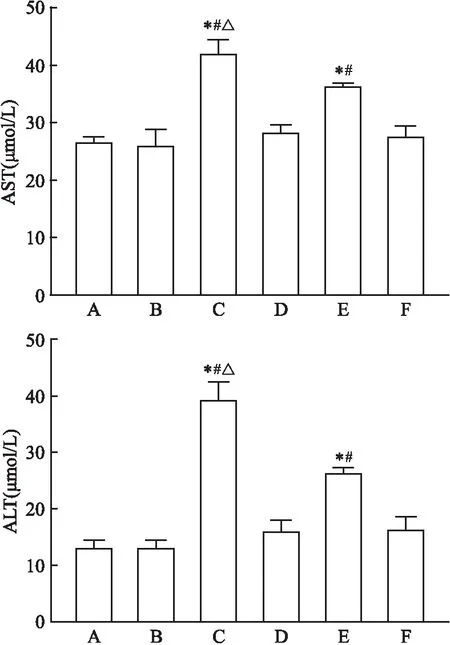
图3 血清AST、ALT水平A:空白组;B:溶剂组;C:TCE致敏阳性组;D:TCE致敏阴性组;E: TCE+Tempol致敏阳性组;F: TCE+Tempol致敏阴性组;与溶剂组比较:*P<0.05;与致敏阴性组比较:#P<0.05;与TCE+Tempol致敏阳性组比较:△P<0.05
2.5 肝脏IL-22、IL-2免疫组化结果
致敏阴性组、溶剂组与空白组小鼠相比IL-22和IL-2蛋白沉积量差异无统计学意义。致敏阳性组小鼠肝组织 IL-22和IL-2表达量皆高于溶剂及致敏阴性组,差异有统计学意义(P
<0.05); 较TCE致敏阳性组,TCE+Tempol致敏阳性组小鼠IL-22和IL-2沉积量下调,差异有统计学意义(P
<0.05)。见表2,图4、5。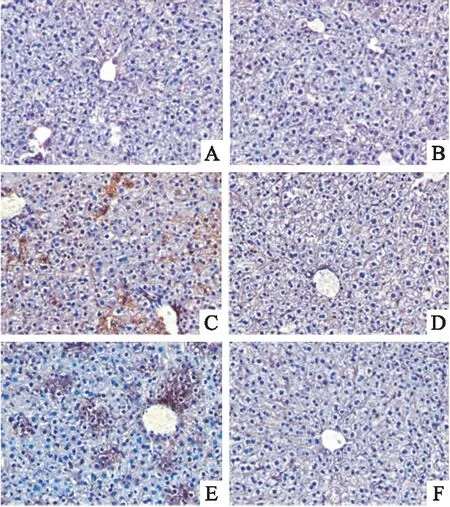
图4 小鼠肝脏中IL-22表达水平 DAB×400A: 空白组;B:溶剂组;C:TCE致敏阳性组;D:TCE致敏阴性组;E: TCE+Tempol致敏阳性组;F: TCE+Tempol致敏阴性组
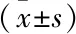
表2 小鼠肝脏IL-22和IL-2蛋白表达含量的IHC评分
2.6 肝脏IL-22和IL-2蛋白表达结果
致敏阴性组、溶剂组与空白组相比IL-22和IL-2条带灰度值差异均无统计学意义(P
>0.05);致敏阳性组小鼠IL-22和IL-2蛋白含量与溶剂组和致敏阴性组相比均有明显增加,且TCE+Tempol致敏阳性组蛋白表达水平低于TCE致敏阳性组,差异有统计学意义(P
<0.05),与IHC结果一致。见图6。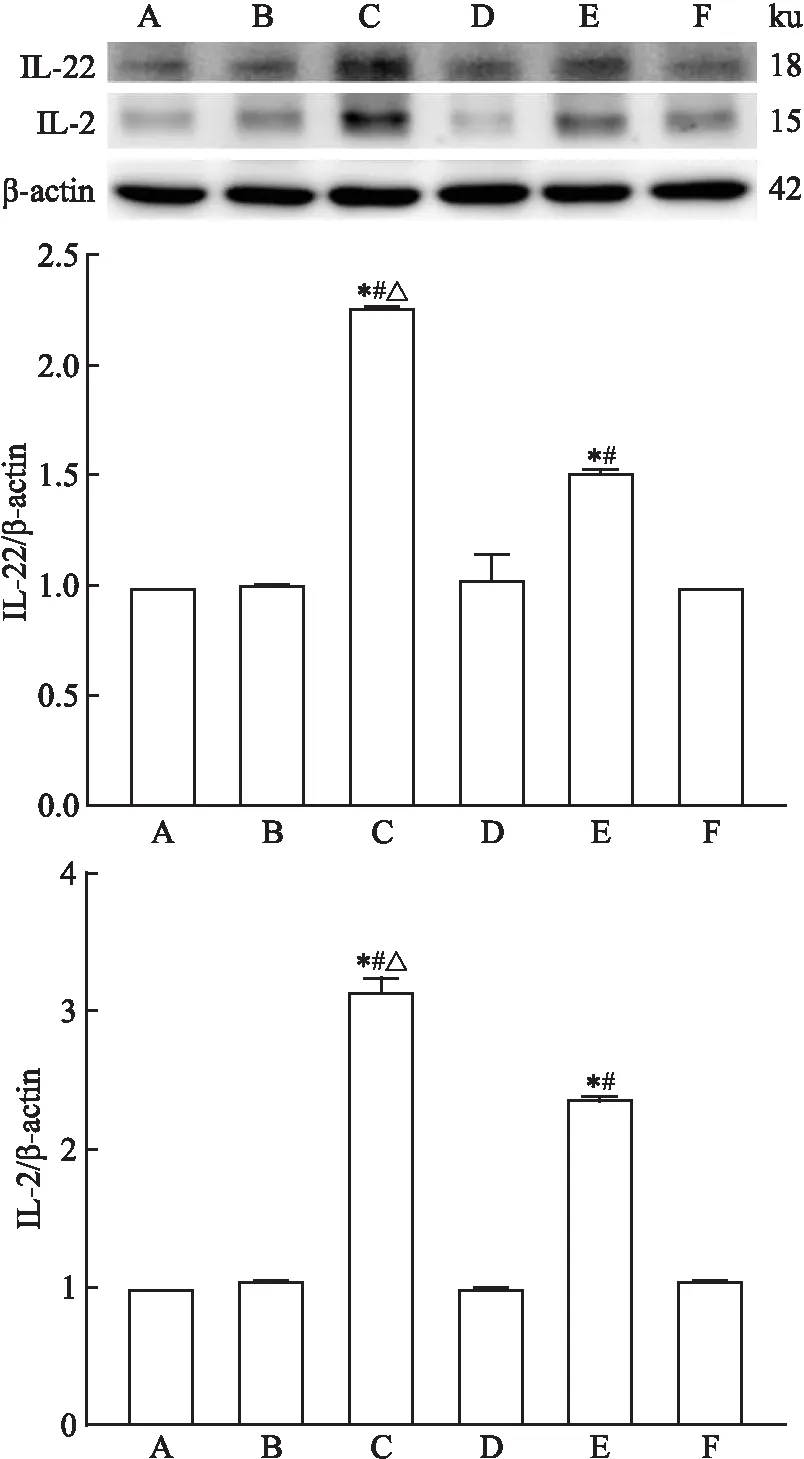
图6 肝脏组织中IL-22和IL-2蛋白含量变化A:空白组;B:溶剂组;C:TCE致敏阳性组;D:TCE致敏阴性组;E: TCE+Tempol致敏阳性组;F: TCE+Tempol致敏阴性组;与溶剂组比较:*P<0.05;与致敏阴性组比较:#P<0.05;与TCE+Tempol致敏阳性组比较:△P<0.05
3 讨论
目前,OMLDT的发病机制不明确,多数学者认为其属于Ⅳ型变态反应,但其还可能与Ⅱ、Ⅲ型变态反应有关。课题组前期研究表明,TCE可引起致敏豚鼠肝损伤,其中肝脏的MDA与超氧化物歧化酶(SOD)表达水平明显升高,提示氧化应激在TCE致敏肝损伤中发挥作用。同样,在Balb/c致敏小鼠中也表明肾脏损伤和氧化应激相关。有研究表明多种自身免疫性疾病与TCE 的暴露相关,包括自身免疫性肝炎可能因机体产生大量的活性氧(reactive oxygen species, ROS)导致。氧化应激水平上升后,ROS可通过上下游联合反应导致机体失衡损伤。
图5 小鼠肝脏中IL-2表达水平 DAB×400A:空白组;B:溶剂组;C:TCE致敏阳性组;D:TCE致敏阴性组;E: TCE+Tempol致敏阳性组; F: TCE+Tempol致敏阴性组
氧化应激(oxidative stress,OS)是机体氧化与抗氧化作用失衡的一种状态,过氧化导致中性粒细胞炎性浸润,蛋白酶分泌增加,产生大量氧化中间产物从而带来负作用。Tempol是一种氧化还原循环的一氧化氮和可透过膜的抗氧化剂,具有清除过氧化氢诱导的细胞内ROS的能力,并增加了SOD与过氧化氢酶这类抗氧化蛋白的表达水平,通过在细胞中提供更多的NADPH来增加细胞内谷胱甘肽进而去除ROS,降低氧化应激水平。研究显示Tempol可通过降低氧化应激水平来减轻肝脏炎症,提示氧化应激水平与机体内肝脏炎症有重要关联。因此,该实验通过腹腔注射抗氧化剂Tempol,以研究 TCE 致敏小鼠肝脏损伤的机制。结果表明,TCE组和TCE+Tempol组小鼠致敏率相比差异无统计学意义,各组小鼠肝脏病理检测表明,TCE致敏阳性组小鼠肝细胞有明显的空泡样变性,有水肿表现,胞质呈现疏松状态,而TCE+Tempol致敏阳性组肝细胞有部分区域存在水肿状况,面积较少,肝脏损伤有所减轻。提示Tempol对TCE致免疫性肝损伤有保护意义,但其机制尚不清楚。
药疹患者和肝炎患者血清中IL-22表达水平均有所升高,治疗后均有下调表现。体外实验显示,TCE及其氧化代谢产物三氯乙酸和二氯乙酸显著活化T细胞增加IL-2分泌以及T细胞CD25和CD69的表达,动物实验也表明TCE致敏小鼠皮肤中有IL-2大量沉积。IL-22属于IL-10细胞因子家族,是近年来发现的一种免疫介质,而且是唯一一种由免疫细胞产生但不作用于免疫系统的白介素。IL-22所处环境、本身浓度以及发挥作用的时间将联合决定其是产生保护作用还是促炎症作用。研究表明,IL-22可以磷酸化肝脏的STAT3,抑制肝脏氧化,同时IL-22也可促使乙醛诱导的肝星状细胞内Nrf2核转位,增强抗氧化轴Nrf2-Keap1-ARE活性进一步减轻机体氧化水平;IL-22还可通过自噬途径降低大鼠胰岛细胞内ROS含量;也有实验表明,IL-22可以通过减少ROS累积,缓解线粒体功能障碍和减轻NLRP3炎性小体活化来改善肾损伤。这些说明IL-22与机体氧化应激相关。IL-2作为一种细胞生长因子在细胞调节中发挥着不可替代的作用,诱导T细胞增殖分化的同时也起到增强机体免疫监视功能的作用。研究表明,IL-2可维持机体免疫常态,同时也能保持Treg细胞稳态和其产生的耐受性免疫,故具有双向免疫调节作用。ROS的蓄积可以上调IL-2表达,而IL-2是作为T淋巴细胞活化的第三信号,T细胞活化后又能调节下游氧化应激水平。整体动物实验表明,D
-半乳糖介导小鼠过氧化损伤引起IL-2水平显著升高;同时也有研究表明过度氧化应激能增加血清和细胞培养液中IL-2表达,提示IL-2能与机体氧化应激互相调节。该研究结果显示,致敏阳性组小鼠肝脏组织IL-22和IL-2表达量皆高于空白组、溶剂组及致敏阴性组(P
<0.05),TCE+Tempol致敏阳性组肝组织IL-22和IL-2表达量较TCE致敏阳性组有所下调(P
<0.05)。提示TCE诱导的肝损伤过程中IL-22和IL-2表达增加,抑制机体氧化应激水平而减少IL-22和IL-2表达可能缓解TCE导致的免疫性肝损伤。该研究提示氧化应激可能通过影响IL-22和IL-2的表达参与了TCE引起的免疫性肝脏损伤,降低氧化应激水平对其具有一定的保护作用。但氧化应激调节IL-22和IL-2的表达机制以及介导肝损伤的具体机制尚未阐明,还需进行深入研究。
