SRSF9基因敲除胶质母细胞瘤细胞株基因回补及其功能研究
2021-04-09汪京京张真豪穆会君龚玲丽
汪京京,张真豪,穆会君,龚玲丽,邹 健,殷 莹
成簇的规律间隔的短回文重复序列(clustered regularly interspaced short palindromic repeats/Cas9,CRISPR/Cas9)技术近年被广泛应用于生物学及医学各领域,其基本原理是人工合成一个与靶标序列碱基互补的向导RNA(single guide RNA, sgRNA)及Cas9蛋白复合物,对特定基因片段进行切割从而实现基因敲除和敲入等。
富含丝氨酸/精氨酸剪切因子9(serine-arginine-rich splicing factor 9,SRSF
9)是富含丝氨酸/精氨酸蛋白(serine-arginine-rich proteins, SRps)家族成员之一,SRps 在多种肿瘤组织中表达上调,并介导肿瘤相关基因的选择性剪接,现有研究表明SRSF
9在胶质瘤等多种肿瘤中表达上调。前期研究使用CRISPR/Cas9技术成功建立SRSF
9基因敲除的胶质母细胞瘤U87 单克隆细胞株,表明SRSF
9 是成胶质细胞瘤的一个关键致癌基因。为了进一步研究其功能和相关分子机制,该研究在SRSF
9基因敲除细胞中回补SRSF
9并验证其定位和功能。该研究介绍的回补方法可适用于shRNA、siRNA和CRISPR/Cas9等基因敲降和敲除方法。1 材料与方法
1.1 主要材料
1.1.1
细胞株和载体SRSF
9基因敲除的U87单克隆细胞株(sg1-B6和sg1-G8)及其对照细胞株sgcon A3由该实验室构建及保存。病毒包装载体psPAX和pMD2.G购自美国Addgene公司,过表达载体GV348购自上海吉凯基因化学技术有限公司。1.1.2
试剂与仪器 Lipofectamine3 000购自美国Invitrogen公司。PVDF膜和ECL化学发光底物购自美国Millipore公司。点突变试剂盒QuikChange II XL Site-Directed Mutagenesis Kit购自美国Stratagene公司。Nc-细胞核/浆蛋白抽提试剂盒购自北京康为世纪生物科技有限公司。兔抗人SRSF
9多抗、Lamin B1多抗和鼠抗HA单抗购自美国Abcam公司,鼠抗人GAPDH单抗、偶联Alexa Flour 594的驴抗鼠荧光二抗、Hoechest 33342、B-27 Supplement和GlutaMAX Supplement购自美国Thermo Fisher公司,辣根过氧化物酶偶联的羊抗兔/抗鼠IgG二抗购自美国Proteintech公司。重组人表皮生长因子(epidermal growth factor,EGF)和重组人碱性成纤维生长因子(FGF-basic,bFGF)购自PeproTech公司。CCK-8 试剂盒购自美国 Bimake 公司。kFluor555-EdU法细胞增殖检测试剂盒(流式)购自南京凯基生物科技发展有限公司。透明圆底超低附着96孔板购自美国Corning公司。PCR仪购自美国Life Technologies公司。凝胶成像仪购自美国ProteinSimple公司。1.1.3
引物合成及DNA测序 引物合成由上海吉凯基因完成,DNA片段测序工作由生工生物工程(上海)股份有限公司完成。1.2 方法
1.2.1
细胞培养 细胞用含10%胎牛血清和1%青链霉素的DMEM完全培养液,置于37 ℃、饱和湿度及CO体积分数为5%的培养箱中培养,每2~3 d用0.125%胰蛋白酶溶液常规消化传代。1.2.2
SRSF
9-WT和SRSF
9-sgMu过表达载体构建及鉴定 过表达空载体GV348 经Age Ⅰ和EcoR I内切酶双酶切后回收纯化并检测浓度;通过SRSF
9-WT引物以人全基因组cDNA扩增SRSF
9-WT片段后与19T-Vector连接转化并挑取单克隆测序,得到SRSF
9-WT-19T质粒。通过SRSF
9-sgMu引物按点突变试剂盒说明书多点突变SRSF
9-WT-19T质粒,多点突变产物转化后挑取单克隆测序,得到SRSF
9-sgMu-19T质粒。通过SRSF
9-WT引物以SRSF
9-sgMu-19T质粒为模板扩增SRSF
9-sgMu片段并纯化、测定浓度。SRSF
9-WT片段和SRSF
9-sgMu片段分别与线性化GV348载体片段经T4 ligase连接转化后挑取单克隆以SRSF
9鉴定引物进行鉴定并测序。所有引物序列见表1。
表1 目的基因引物序列
1.2.3
慢病毒包装及SRSF
9回补细胞株构建 采用三质粒包装系统,将过表达载体以脂质转染法分别转染至293T细胞。具体方法:293T细胞融合度为70%~80%时,每10 cm培养皿中加入10 μg载体以及5 μg包装质粒psPAX 和pMD2.G。转染6 h后换完全培养液,培养48 h和72 h后分别收集病毒。将两次收集得到的病毒混合后,用0.45 μm过滤器过滤,检测病毒滴度后置于-80 ℃保存备用。取对数生长期细胞按每孔2×10密度接种于6孔板,待细胞生长至30%~40%融合时,DMEM完全培养液中加入终质量浓度为5 μg/ml的聚凝胺(polybrene)及慢病毒(感染复数为10)。感染24 h后换DMEM完全培养液继续培养得到SRSF
9回补细胞株(SRSF
9-WT和SRSF
9-sgMu)和感染空载的细胞株(vector)。1.2.4
细胞总蛋白和核浆蛋白提取及Western blot检测 收集各组细胞总蛋白以及按照Nc-细胞核/浆蛋白抽提试剂盒说明书提取胞质和胞核蛋白,BCA法测定蛋白质浓度。蛋白变性后经10% SDS-PAGE后转移至PVDF膜;以5%脱脂奶粉-TBST室温封闭1 h,兔抗人SRSF
9、Lamin B1多抗、鼠抗HA和鼠抗人GAPDH单抗4 ℃孵育过夜;1×TBST洗3次,每次10 min,辣根过氧化物酶偶联标记的羊抗兔/抗鼠IgG室温孵育1 h;1×TBST洗3次,每次10 min;ECL显影,凝胶成像仪拍照。1.2.5
免疫荧光检测 取对数期生长细胞消化计数,将1×10个细胞接种于细胞爬片,培养48 h后以4% PFA溶液室温固定15 min;0.3% Triton X-100-PBS洗涤3次,每次10 min;驴血清室温封闭1 h,鼠抗HA 4 ℃避光孵育过夜,PBS洗3次,每次10 min;偶联Alexa Flour 594的驴抗鼠二抗室温避光孵育1 h,PBS洗3次,每次10 min;Fluoromount(含Hoechst 10 μg/ml)封片,荧光显微镜拍照。1.2.6
EdU流式法检测细胞增殖 取对数期生长细胞消化后计数,将1.5×10个细胞接种于6 cm培养皿,每组设3个复孔,加入等量DMEM完全培养液培养过夜;然后更换无血清DMEM培养液,培养24 h后换成含10 μmol/L EdU的DMEM完全培养液,孵育3 h;消化细胞并收集于流式细胞管中,1% BSA-PBS 洗涤1次,1 000 r/min离心5 min,弃上清液;4%多聚甲醛溶液固定15 min,1% BSA-PBS洗涤1次,0.5% Triton X-100-PBS室温孵育20 min,破膜;1% BSA-PBS洗涤1次,500 μl 1×Apollo染色反应液重悬细胞,避光室温孵育30 min;离心弃上清液,0.5% Triton X-100-PBS洗涤1次,1% BSA-PBS重悬,流式细胞仪检测。1.2.7
CCK-8 法检测细胞生长曲线 取对数期生长的细胞消化后计数,96孔板每孔接种2 000个细胞,每组设3个复孔,加入等量的DMEM完全培养液培养。第0、1、2、3、4和5天时,按照试剂盒说明书,每100 μl培养液中加入10 μl CCK-8试剂,37 ℃孵育2 h。用多功能酶标仪检测450 nm波长下各孔的OD值,以第0天即接种4 h后的OD值为1,绘制细胞生长曲线。1.2.8
肿瘤干细胞成球实验 选择对数生长期细胞消化后计数,以神经干细胞培养基(D/F-12+20 ng/ml EGF+20 ng/ml bFGF+B-27+GlutaMAX)培养细胞,低吸附96孔板每孔种400个细胞,1 000 r/min离心5 min,37 ℃连续培养10 d并从第一天(即24 h)开始隔天用EVOS显微镜(×40)拍照,Image Pro Plus软件统计细胞球面积。
2 结果
2.1
9-WT和
9-sgMu过表达载体构建和鉴定
如图1A所示:SRSF
9-WT和SRSF
9-sgMu同义突变序列及编码蛋白示意图,下划线为sgRNA1靶序列,红色字母为5个同义突变位点。图1B所示:载体测序结果对比图,SRSF
9-WT和SRSF
9-sgMu质粒测序结果与理论序列一致,表明SRSF
9-WT和SRSF
9-sgMu表达载体构建成功。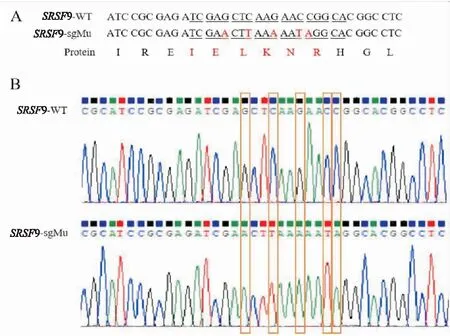
图1 SRSF9-WT和SRSF9-sgMu序列及测序结果比对A:SRSF9-WT和SRSF9-sgMu同义突变序列及编码蛋白示意图;B:SRSF9-WT和SRSF9-sgMu测序结果比对
2.2 Western blot 法验证
9-sgMu成功回补
9
该课题组前期以CRISPR/Cas9系统成功构建胶质母细胞瘤U87敲除SRSF
9基因细胞株,其中sg1-B6和sg1-G8是U87细胞敲除SRSF
9的单克隆细胞株,sgcon-A3为其对照细胞,表达野生SRSF
9蛋白。Western blot结果显示:sgcon-A3细胞中,转染空载的vector对照组在约30 ku位置可见明显内源SRSF
9蛋白而无带HA标签的外源SRSF
9蛋白,SRSF
9-WT和SRSF
9-sgMu回补组的SRSF
9较vector组增多,且通过检测HA标签蛋白(HA标签蛋白与SRSF
9蛋白融合表达)得到相同结果。见图2A;sg1-B6和G8细胞中,vector对照组未见SRSF
9蛋白表达,WT回补组同样未检测到带HA标签的SRSF
9蛋白,仅有sgMu回补组在30 Da位置可见清晰的带HA标签的SRSF
9蛋白。见图2B、C。这是由于sg-B1和G8稳转细胞中持续表达Cas9蛋白和SRSF
9 sgRNA1,当转入SRSF
9-WT,sgRNA1同样可识别该序列,Cas9蛋白对其进行特异性切割,但sgRNA1无法识别同义突变后的SRSF
9-sgMu序列。该结果显示利用sgRNA靶序列的同义突变可成功回补SRSF
9。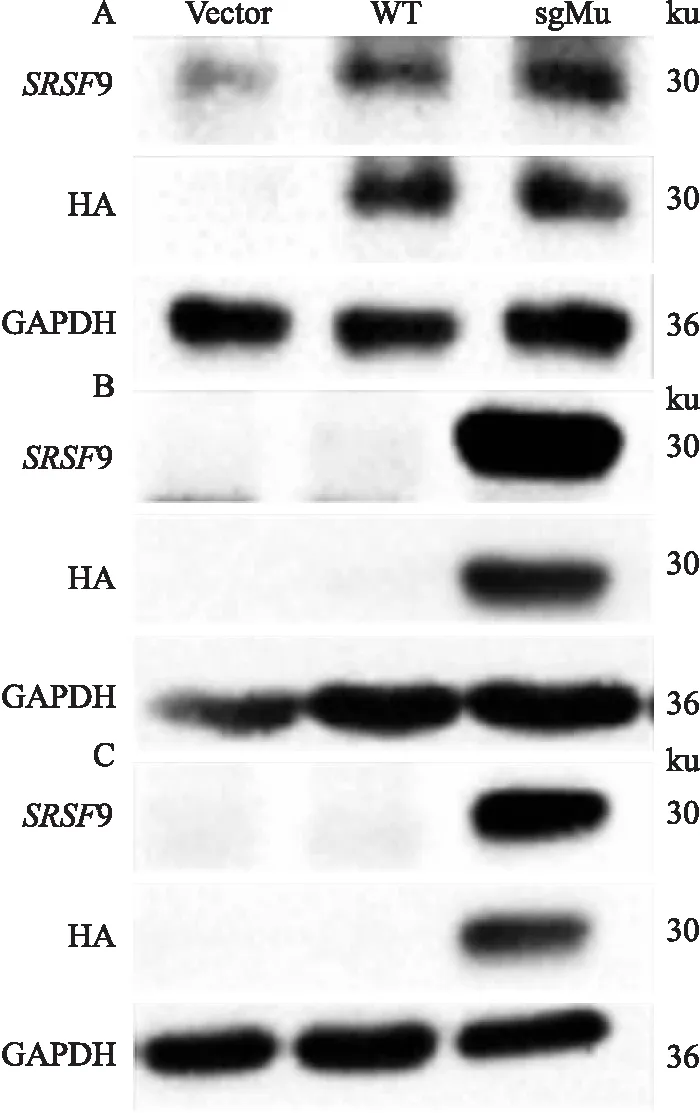
图2 Western blot法验证SRSF9-sgMu成功回补SRSF9A:sgcon-A3细胞蛋白分析;B: sg1-B6细胞蛋白分析;C: sg1-G8细胞蛋白分析
2.3 免疫荧光法验证
9-sgMu成功回补
9
该课题组前期构建的sgcon-A3、sg1-B6和sg-G8细胞均带有绿色荧光蛋白(GFP)表达,该研究构建的SRSF
9-WT和SRSF
9-sgMu带有HA标签,以HA抗体免疫荧光染色可见,sgcon-A3中,SRSF
9-WT和SRSF
9-sgMu回补组均可检测到HA标签蛋白,而vector对照组未检测到;sg1-B6和G8中,SRSF
9-sgMu回补组可检测到HA标签蛋白,但SRSF
9-WT回补组和vector对照组未检测到该蛋白。见图3。以上结果与Westem blot结果一致,再次表明利用sgRNA靶序列的同义突变可成功回补SRSF
9。并且,回补的SRSF
9蛋白优势表达于细胞核。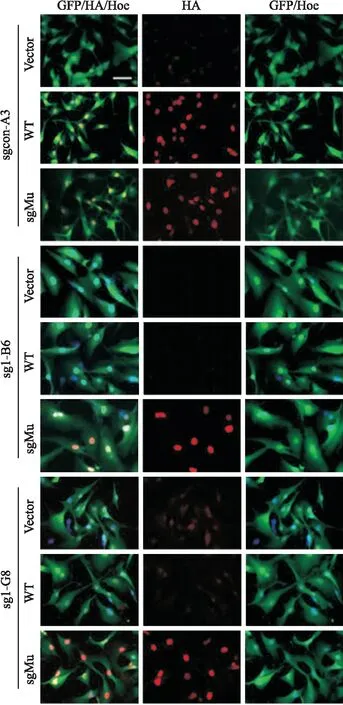
图3 免疫荧光法验证SRSF9-sgMu成功回补SRSF9(×400,Scale bar: 50 μm)
2.4 Western blot法验证回补
9蛋白定位
由于SRSF
9-sgMu回补组的免疫荧光染色结果显示:回补的SRSF
9蛋白优先表达于细胞核,为了进一步探索其定位,该研究分别提取了sgcon-A3、sg1-B6和sg1-G8感染慢病毒后的浆蛋白和核蛋白并进行Western blot实验,GAPDH为浆蛋白标志物,Lamin B1为核蛋白标志物。如图4所示:P(plasma protein)为胞质蛋白,N(nucleoprotein)为核蛋白,sgcon-A3细胞中,vector对照组仅表达内源性SRSF
9,且内源性SRSF
9表达在细胞核,而SRSF
9-WT和SRSF
9-sgMu回补组的SRSF
9蛋白优先表达于细胞核。sg1-B6和G8细胞中,SRSF
9-sgMu回补组带HA标签的SRSF
9蛋白也优先表达于细胞核,而SRSF
9-WT回补组和vector对照组未检测到该蛋白,以上结果与免疫荧光结果一致,再次表明利用sgRNA靶序列的同义突变可成功回补SRSF
9,且回补的SRSF
9蛋白与内源蛋白均优先表达于细胞核。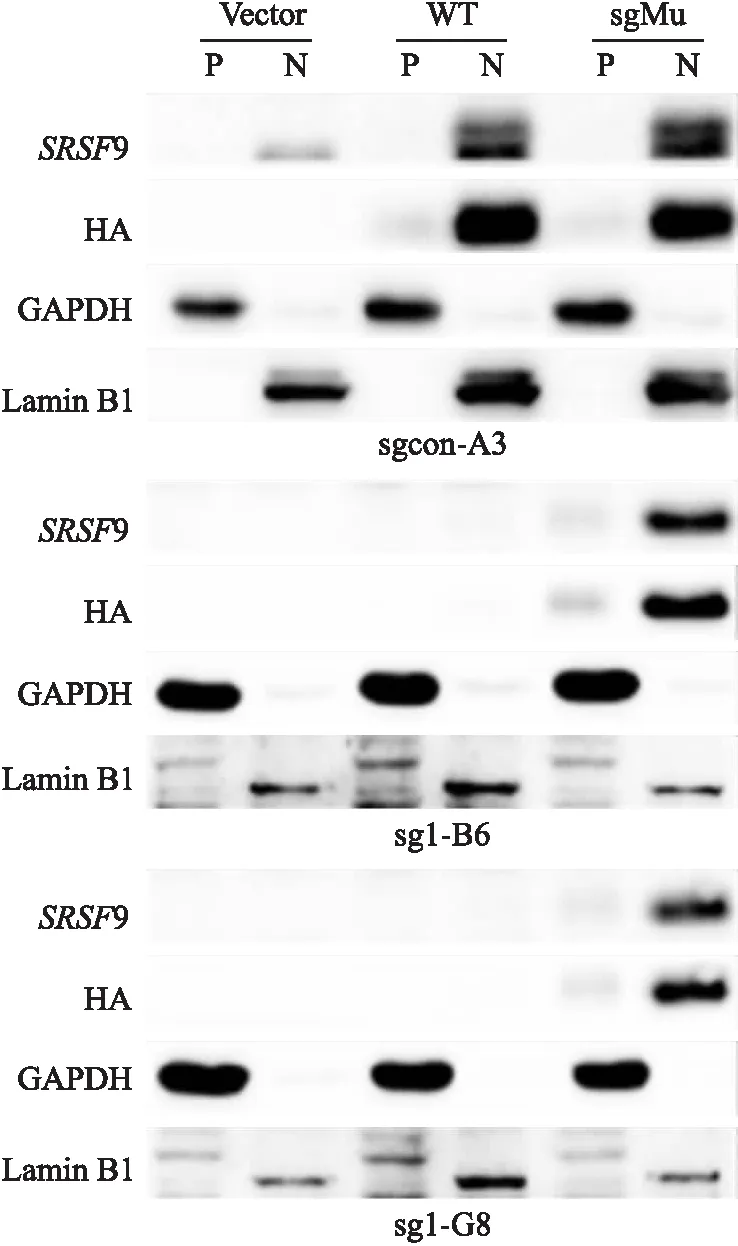
图4 Western blot法验证回补SRSF9蛋白定位GAPDH和Lamin B1分别为浆蛋白和核蛋白的标志
2.5
9-sgMu回补拯救细胞增殖和肿瘤干细胞成球能力
前期该课题组研究表明U87细胞敲除SRSF
9基因后增殖和肿瘤干细胞成球能力减弱,该研究选择敲除了SRSF
9基因的sg1-G8细胞来验证回补的SRSF
9基因拯救细胞增殖和成球的能力。EdU流式法检测结果显示,vector、WT和sgMu实验组EdU细胞所占比例分别为:(20.27 ± 1.19)%、(23.23±0.29)%和(26.00±0.97)%,sgMu组增殖能力强于vector和WT组,差异有统计学意义(F
=10.009,P
<0.05)。见图5A。CCK-8实验结果显示,sgMu组从第3天起增殖能力高于vector组,而WT组与vector组差异无统计学意义。第5天3组细胞相对增殖率分别为(6.64±0.13)%、(6.32±0.22)%和(7.75±0.23)%, sgMu组高于vector组,差异有统计学意义(F
=15.035,P
<0.01),见图5B。肿瘤干细胞成球实验结果显示,从第3天开始sgMu组细胞成球的相对面积大于vector组,而WT组与vector组差异无统计学意义;第10天vector、WT和sgMu组细胞成球的相对面积分别为(5.21±0.52)%、(4.85±0.46)%和(5.98±0.23)%,sgMu细胞成球面积大于vector组,差异有统计学意义(F
=15.142,P
<0.05),见图5C、D。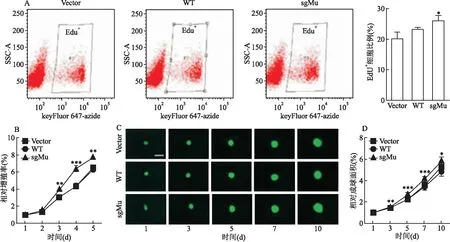
图5 SRSF9-sgMu回补拯救sg1-G8细胞增殖和肿瘤干细胞成球能力A:EdU流式法检测SRSF9基因回补的U87单克隆细胞的增殖能力;B:CCK-8法检测SRSF9基因回补的U87单克隆细胞的增殖能力;C、D:肿瘤干细胞成球实验检测SRSF9基因回补的U87单克隆细胞肿瘤干细胞成球能力,荧光显微镜×40,Scale bar: 200 μm;与Vector组比较:*P<0.05,**P<0.01,***P<0.001
3 讨论
该课题组前期以CRISPR/Cas9系统构建胶质母细胞瘤U87敲除SRSF
9基因细胞株sg1-B6和sg1-G8,表明敲除SRSF
9的U87细胞增殖和肿瘤干细胞成球能力降低。为进一步验证SRSF
9的功能,该研究通过构建SRSF
9 sgRNA1序列位点同义突变载体,成功在CRISPR/Cas9系统敲除SRSF
9基因的单克隆细胞株中回补SRSF
9蛋白。由于CRISPR/Cas9系统敲除SRSF
9的单克隆细胞持续表达Cas9蛋白和sgRNA1,它不仅切割内源SRSF
9基因,外源表达的SRSF
9-WT基因也会被持续切割而无法实现回补。由于遗传密码子存在简并性,即同一氨基酸具有多个密码子,该研究通过对SRSF
9 sgRNA1序列进行同义突变,使得SRSF
9-sgMu基因能躲避CRISPR/Cas9系统切割,同时不改变SRSF
9蛋白序列。CRISPR/Cas9基因编辑系统的特异性决定于sgRNA上的识别序列(~20nt),多项研究指出:sgRNA的特异性主要与邻近PAM区的10~12 bp有关,即种子序列。该研究选择SRSF
9 sg1种子序列中的4个碱基和种子序列外的1个碱基进行了同义突变得到SRSF
9-sgMu序列,提高了其抵抗SRSF
9 sgRNA1的特异性切割的效率。随后Western blot和免疫荧光染色均证实:敲除了SRSF
9的U87 sg1-B6和G8细胞中SRSF
9-sgMu载体可以回补,而SRSF
9-WT则不能。SRSF
9是进化中高度保守的一种RNA剪接蛋白,主要在细胞核中执行RNA剪接功能,研究表明SRSF
9蛋白C端的RS结构域对其细胞定位起了决定性作用。该研究回补的SRSF
9蛋白带有HA标签,免疫荧光染色显示回补的SRSF
9优势表达于细胞核,由于缺乏商业化用于免疫荧光染色的SRSF
9抗体,无法通过免疫荧光法检测内源性SRSF
9蛋白的细胞定位,因此该研究通过提取细胞核/浆蛋白进行Western blot检测SRSF
9的表达定位:与免疫荧光染色结果一致,内源和外源SRSF
9蛋白均优势表达于细胞核,这一结果与已有报道一致,同时也符合SRSF
9行使RNA剪接蛋白的角色。在此基础上该研究表明回补的SRSF
9蛋白可以挽救SRSF
9基因敲除后U87 sg1-G8胶质瘤细胞增殖能力和肿瘤干细胞成球能力减弱的表型,进一步表明了SRSF
9在胶质瘤中的促癌功能,为研究SRSF
9的功能和作用机制提供了有效工具。