早期高效抗艾滋病逆转录病毒治疗对HIV育龄妇女抗病毒治疗效果和安全性的影响
2021-04-08刘帅凤邓小娥孟琴李春英刘伟梁富雄曾雪梅
刘帅凤 邓小娥 孟琴 李春英 刘伟 梁富雄 曾雪梅
广西壮族自治区疾病预防控制中心(南宁530028)
艾滋病病毒(HIV)感染人体后主要引起CD4+T 淋巴细胞(简称CD4)进行性减少和CD4/CD8比值倒置,与HIV 病毒大量繁殖、异常免疫激活、HIV 储存库有关[1],早期或尽早期高效抗艾滋病逆转录病毒治疗(HAART)可以较早控制并维持病毒的低复制,延缓或防止免疫系统破坏[2]。本文中将CD4 水平正常的无症状HIV 患者接受HAART 称为“早期HAART”。对HIV 妇女其产后接受或中断HAART 益处和风险如何,相关报道甚少。为此,本研究对产后无症状HIV 妇女进行早期HAART 的情况进行研究,探索其对产后病毒清除、CD4/CD8 比值恢复、肝肾功能安全性的影响,为医务人员开展精准HAART 提供参考。
1 对象与方法
1.1 研究对象选取2012-2016年广西疾控中心门诊就诊的104 例HIV 阳性育龄妇女。纳入标准:CD4 ≥400 个/μL,无临床症状,血常规指标正常。
1.2 分组52 例产后进入早期HAART 组(A 组)、52 例停止HAART(B 组),随访2年,定期体格检查、实验室检测以及提供心理咨询等。
1.3 方法采用队列研究方法,开展知情同意、服药依从性教育后,按照《国家免费艾滋病抗病毒药物治疗手册》(2012年)[3]开展HAART。HAART对象:A 组或B 组产妇出现CD4 <350 个/μL 就启动HAART。
1.4 HAART方案统一使用国家免费提供HAART药品:(1)齐多夫定(AZT)BID、拉米夫定(3TC)QD、替诺福韦(TDF)QD;(2)依非韦伦(EFV)QD;(3)克立芝(LPV/r)QD。
1.5 实验室检测
1.5.1 T 淋巴细胞计数检测使用美国BD 公司生产的四色免疫荧光染色剂、Trucount 绝对记数管和FACSCalibur 流式细胞仪检测全血CD45、CD3、CD4、CD8+T 淋巴细胞计数(个/μL)。
1.5.2 病毒载量检测使用Roche 公司Cobas Am⁃pliPrep/Cobas TaqMan 全自动分析系统和本公司HIV⁃1 Testversion 2.0 试剂盒,检测有效线性范围为20 ~1.0×107copies/mL,检测灵敏度为20 copies/mL。
1.5.3 血生化检测采用德国罗氏公司提供试剂和罗氏全自动生化仪(COBVS INTEGRA 400 plus),检测总胆红素(TBIL)(mg/dL)、肌酐CREA(mg/dL)、谷草转氨酶AST(U/L)、谷丙转胺酶ALT(U/L)。
1.6 不良事件的严重程度分级根据《DAIDS 成人和儿童不利事件严重程度分级表(DAIDS 不利事件分级表)》(2004年)评估评估实验室异常值不良事件分级。
1.7 统计学方法采用SPSS 22.0 软件进行统计分析,计量资料以均数±标准差表示,组间比较采用t检验;计数资料使用例(%)表示,采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 HIV⁃1阳性产妇基本情况104例妇女平均年龄(27.1 ± 5.0)岁,96%已婚(100/104),CD4(400 ~1 000 个/μL),入组时基本情况比较,差异无统计学意义(P>0.05),见表1。
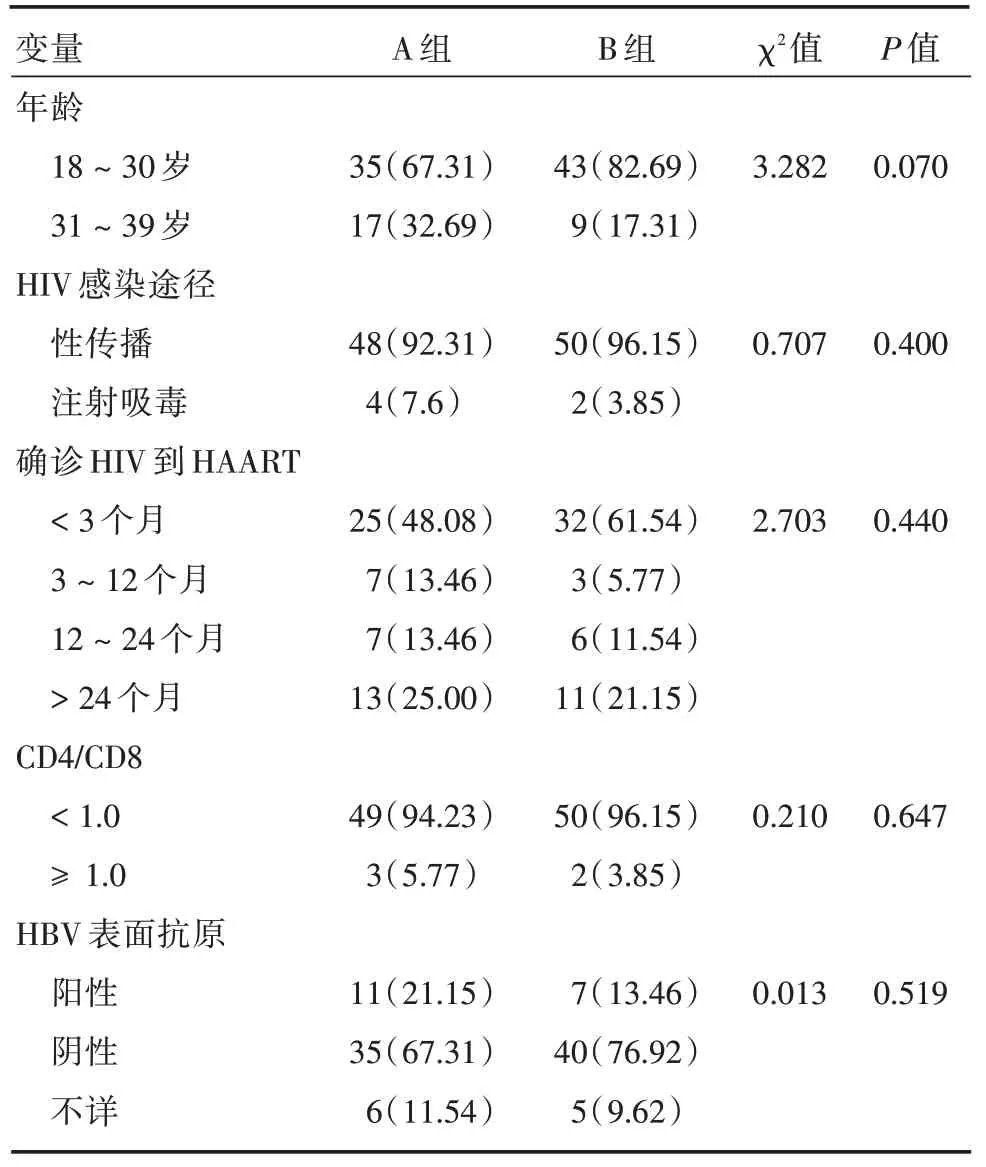
表1 两组HIV⁃1 阳性育龄妇女入组基本情况比较Tab.1 Comparison of basic data of HIV Fertile women in two groups 例(%)
2.2 早期HAART 方案治疗情况A 组52 例妇女服药情况:34 例服用AZT+3TC+LPV/r,10 例服用TDF+3TC+LPV/r,4例服用TDF+3TC+EFV,4例服用AZT + 3TC + EFV;患者服药依从性≥95%。B 组5 例分别于产后49、58、62、76、89 周CD4 <350 个/μL,根据国家治疗指南启动HAART。
2.3 早期HAART 对妇女产后免疫细胞亚群影响两组CD4、CD4/CD8 产后24 ~96 周比较差异有统计学意义(P<0.01),A 组产后CD4 计数、CD4/CD8 显著升高(P<0.05);B 组CD4、CD4/CD8 水平产后显著下降(P<0.01);A 组CD8 计数随着时间在下降(P<0.05),而B 组CD8 计数较小变化。见表2。
A 组CD4/CD8随时间不断升高,CD4/CD8 ≥1.0 例数从0 周11.5%(6/52)、48 周40.5%(17/42)上升到96 周60%(12/20),72 周时A 组CD4/CD8 平均值≥1.0;而B 组CD4/CD8 ≥1.0 例数明显下降,从0 周15.4%(8/52),48 周4.8%(2/42)到96 周11.1%(2/18),两组CD4/CD8 ≥1.0 例数于24 ~96 周比较差异均有统计学意义(P<0.01)。
表2 两组产后育龄妇女T 淋巴细胞结果分析Tab.2 Analysis of T lymphocyte of HIV fertile women in two groups ±s
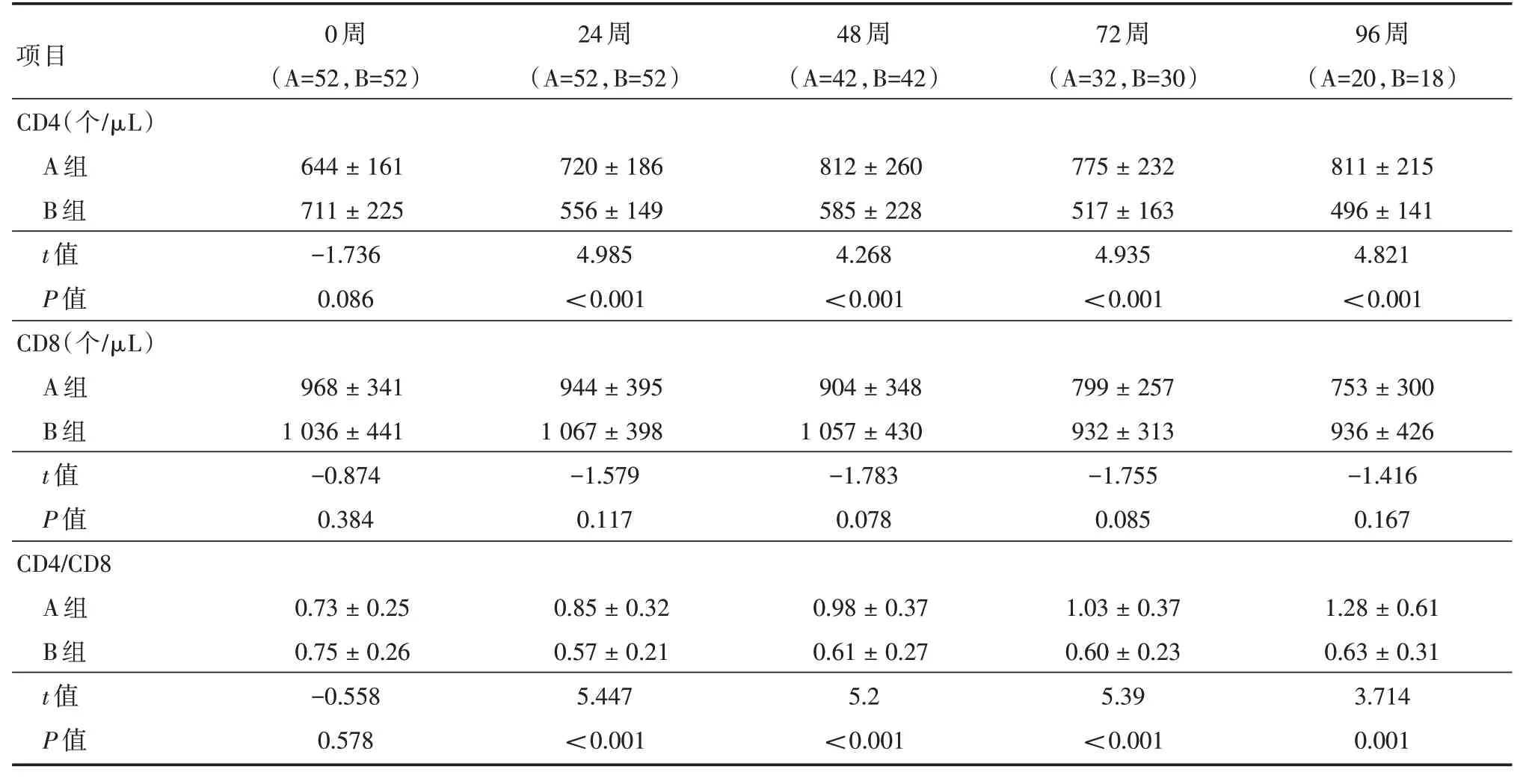
表2 两组产后育龄妇女T 淋巴细胞结果分析Tab.2 Analysis of T lymphocyte of HIV fertile women in two groups ±s
项目CD4(个/μL)A 组B 组t 值P 值CD8(个/μL)A 组B 组t 值P 值CD4/CD8 A 组B 组t 值P 值0 周(A=52,B=52)644±161 711±225-1.736 0.086 968±341 1 036±441-0.874 0.384 0.73±0.25 0.75±0.26-0.558 0.578 24 周(A=52,B=52)720±186 556±149 4.985<0.001 944±395 1 067±398-1.579 0.117 0.85±0.32 0.57±0.21 5.447<0.001 48 周(A=42,B=42)812±260 585±228 4.268<0.001 904±348 1 057±430-1.783 0.078 0.98±0.37 0.61±0.27 5.2<0.001 72 周(A=32,B=30)775±232 517±163 4.935<0.001 799±257 932±313-1.755 0.085 1.03±0.37 0.60±0.23 5.39<0.001 96 周(A=20,B=18)811±215 496±141 4.821<0.001 753±300 936±426-1.416 0.167 1.28±0.61 0.63±0.31 3.714 0.001
2.4 早期HAART 对HIV 病毒抑制结果A 组妇女随HAART 时间延长,HIV 病毒清除率越高(P<0.01)。A 组中出现1 ~2 例病毒载量>1 000 cop⁃ies/mL(服药依从性不佳导致),进行基因型耐药检测,没有显示对ARV 药物耐药。
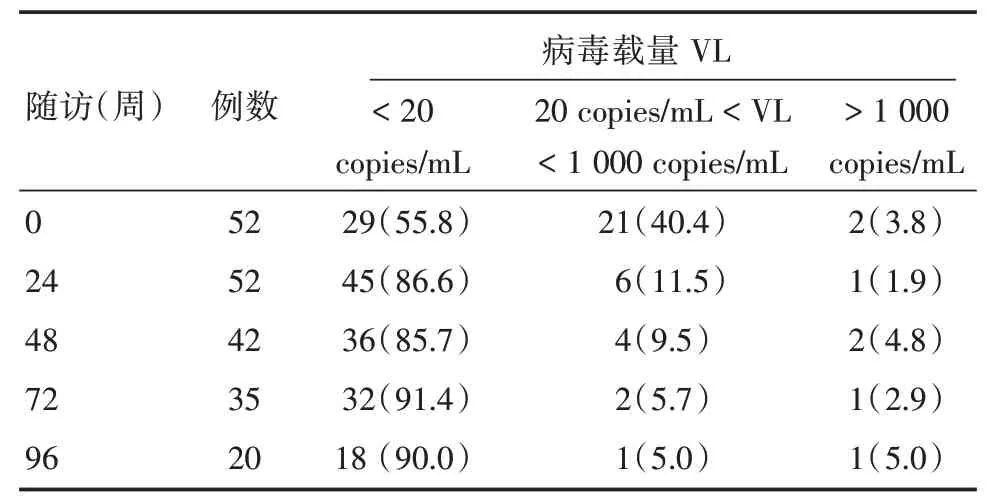
表3 A 组妇女HAART 不同随访时间病毒抑制分析Tab.3 Analysis of viral load of women in group A at follow⁃up time 例(%)
2.5 早期HAART 对肝肾功能影响结果对两组妇女产后0 ~96 周定期进行肝肾功能检查:两组的TBIL 和CREA 均值都在正常范围(A 组均值0.23~0.57 mg/dL,B 组0.21 ~0.64 mg/dL),差异无统计学意义(P>0.05)。
AST 和ALT 均值在48 ~72 周差异有统计学意义(P<0.05),A 组均值比B 组低,见表4。两组发生不良事件差异有统计学意义(P<0.05),ALT(A 组14 例,B 组49 例,χ2= 38.717,P<0.001)和AST 不良事件(A 组13 例,B 组37 例,χ2=38.166,P<0.001),B 组不良事件发生率更高。
3 讨论
鉴于现已普及HARRT 预防HIV 母婴传播,对免疫水平正常无症状的育龄妇女产后接受早期HAART 的有效、安全性评估至关重要。为此本研究采用随机对照研究分析妇女产后病毒清除、免疫恢复、肝肾功能等相关指标变化。如果接受早期HAART 有利免疫功能系统完善并具有很好安全性,这将作为尽早HARRT 益处的有力证据,另一方面,如果由于其感觉身体良好,对早期HAART 不重视、依从性不好,增加HAART 的耐药风险或其他合并症引起的毒性,则需要在此人群重新评估。
据文献报道早期HAART 可以减少单阳家庭内HIV 传播,在艾滋病疫苗还没有上市前是较好一种适用中国公共卫生预防策略[4]。据报告在HIV 患者感染后6 个月内尽早期HAART 助于降低HIV 储存库并有利于降低T 细胞活化(CD8 细胞激活水平),对于个人病毒库清除以及提升免疫系统都有明显效果[5],近年来研究发现在早期(CD4 细胞≥350 个/μL)即进行HAART 治疗,能更好地抑制HIV 逆转录酶的活性、HIV 病毒的繁殖和活性,减少病毒对身体免疫系统破坏[6],并有利于CD4/CD8 比值改善[9],特别恢复CD4/CD8 ≥1.0 与早期抗病毒治疗有关[9]。本研究发现接受早期HAART的产后妇女,随着治疗时间延长,病毒抑制率越高,产后96 周90% HIV 产后妇女病毒载量在极低水平(RNA <20 copies/mL),并随着时间延长,能明显提高CD4/CD8 值,扭转CD4/CD8 倒置现象,在96周时60%妇女CD4/CD8比值≥1.0,进一步说明了早期治疗有利恢复和完善免疫功能,与相关报告结论一致。同时也发现B组妇女由于中断HAART,HIV 病毒在持续感染繁殖,CD4/CD8 随时间而明显下降,导致患者的T 淋巴细胞亚群比例进一步恶化,与相关研究报道一致[12]。
表4 两组产后育龄妇女不同时间肝功能结果分析Tab.4 Analysis of liver function of women in two groups at follow⁃up time ±s
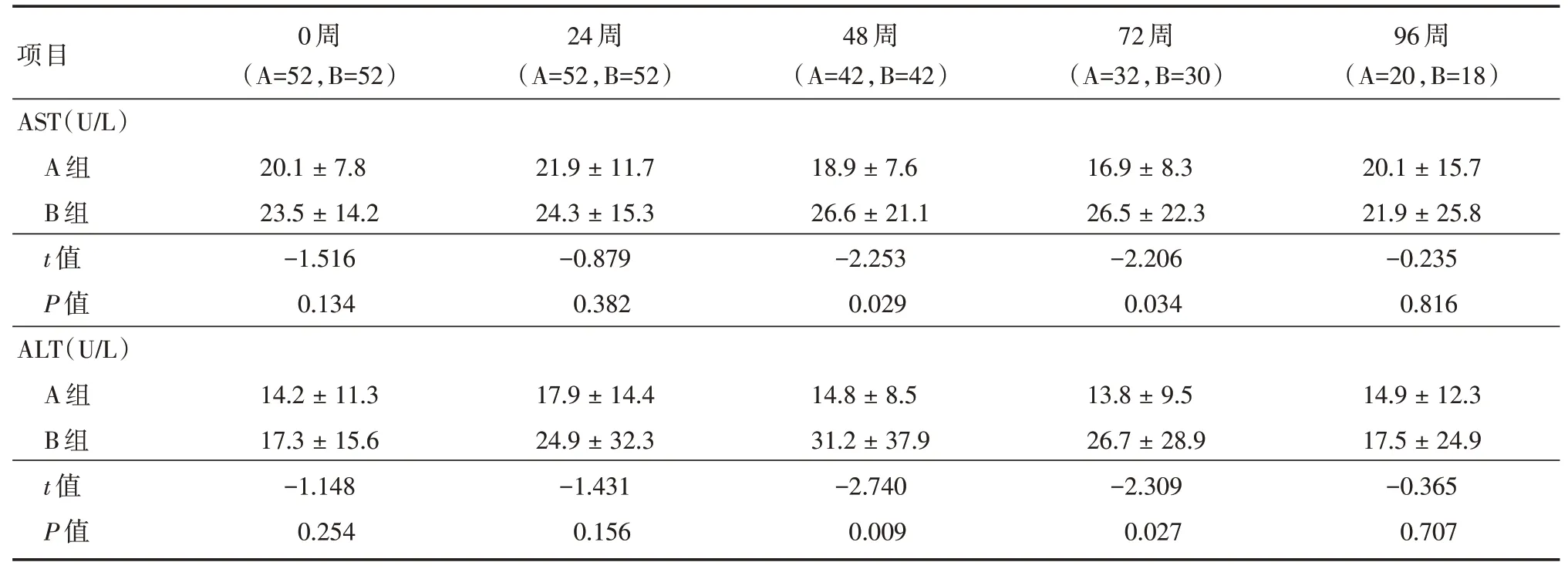
表4 两组产后育龄妇女不同时间肝功能结果分析Tab.4 Analysis of liver function of women in two groups at follow⁃up time ±s
项目AST(U/L)A 组B 组t 值P 值ALT(U/L)A 组B 组t 值P 值0 周(A=52,B=52)20.1±7.8 23.5±14.2-1.516 0.134 14.2±11.3 17.3±15.6-1.148 0.254 24 周(A=52,B=52)21.9±11.7 24.3±15.3-0.879 0.382 17.9±14.4 24.9±32.3-1.431 0.156 48 周(A=42,B=42)18.9±7.6 26.6±21.1-2.253 0.029 14.8±8.5 31.2±37.9-2.740 0.009 72 周(A=32,B=30)16.9±8.3 26.5±22.3-2.206 0.034 13.8±9.5 26.7±28.9-2.309 0.027 96 周(A=20,B=18)20.1±15.7 21.9±25.8-0.235 0.816 14.9±12.3 17.5±24.9-0.365 0.707
本研究A 组妇女有11 例(21%)同时感染乙肝病毒(HBV),研究报道HIV 感染患者人群合并HBV 感染率在5%~20%,由于HBV 与HIV 具有相似的传播途径,HIV 合并HBV 感染患者可能会造成艾滋病病情加速发展,两种病毒可能具有相互促进作用,加重患者肝损伤及免疫缺陷,严重影响患者生存率[14]。因此,本研究给予HIV、HBV 双感妇女TDF+3TC+LPV/r 或TDF+3TC+EFV 三联药物治疗,有利减轻患者肝功能损坏、提高免疫功能等。研究发现A 组妇女肝功能不良事件发生率低于B 组,与有关研究结果相似[16],早期HAART 对于CD4 基线水平较高艾滋病患者肾功能显示具有较好安全性。
产后妇女在接受早期HAART 过程中,心理支持对服药依从性非常重要,研究发现1 例由于担心药物副作用等原因,16 周后停止服药;1 例因与家人关系不佳,36 周后外出打工经常忘记服药,导致CD4、CD4/CD8 显著下降和病毒载量显著升高(VL >1 000 copies/mL)。文献报道早期HAART 组(CD4≥350 个/μL)患者出现临床疾病进展的比率比延迟治疗组患者低4~5 倍,但在早期HAART 组中有41%的患者至少1 次彻底中断过治疗,还有24%的患者在随访末期停止了HAART[17]。最近报道广西CD4 >500 个/μL 的艾滋病患者比CD4 >350 个/μL 的患者的HAART 停药风险增加21%[18]。对于出现CD4计数突然降低的HIV 患者,应当立即开展HAART 治疗,降低疾病进展的危险性和死亡[19]。本研究B 组妇女由于中断HAART,产后CD4 计数和CD4/CD8 比值随着时间持续下降,产后5 例(10%)妇 女CD4下降到350 以下启动HAART。
由于本研究对象处在产后特殊阶段,尽管当年入组来自广西全区病例,但样本量、随访时间有限,还需要长期跟踪对象,收集更全面信息,对早期HAART 治疗带来的收益和风险进行权衡。未来还需要更多研究分析不同时期的HAART 有效性和安全性,比如早期HAART 对人体肠道菌群影响等[21],也是今后的重要课题。
