双膦酸盐治疗原发性骨质疏松症的研究进展
2021-04-10李奕玉关雅心吴斌
李奕玉 关雅心 吴斌
昆明医科大学第一附属医院内分泌一科(昆明650032)
骨质疏松症(osteoporosis,OP)是一种因低骨量、骨组织微结构损坏导致骨脆性增加,以易发生骨折为特征的全身性疾病。骨质疏松性骨折又称脆性骨折,好发于椎骨、髋部和桡骨远端,髋部骨折是最严重的骨折[1]。研究表明,我国60 岁以上人口达2.1亿,OP患病率为36%,其中男性23%,女性49%,截止2010年,我国骨质疏松性骨折数量达233 万,其中髋部骨折36 万,椎体骨折111 万[2]。骨质疏松性骨折是老年患者致死和致残的主要原因,给家庭及社会带来沉重的生活压力和经济负担,OP 已然成为日益关注的公共健康问题。
骨组织是由骨细胞、成骨细胞、破骨细胞等细胞组成的一类具有高度代谢活性的组织,处于成骨细胞介导的骨形成和破骨细胞介导的骨吸收的动态平衡过程,称为骨重建[3]。骨重建过程受骨细胞调节作用,其机制十分复杂,其中包括cbfα⁃1、Wnt/β⁃catenin、RANKL/RANK/OPG 等信号通路[4]。当骨吸收作用大于骨形成作用时则发生OP,目前根据对骨细胞的作用机制可将抗OP 药物大致分为骨吸收抑制剂、骨形成促进剂和骨代谢调节剂。近年来越来越多的作用于信号通路的抗OP药物相继问世,如RANKL 抑制剂、硬化蛋白抗体等。除以上分子调节水平机制外,越来越多的研究证明miRNA 也通过调节骨细胞、促进骨分化参与骨重建过程,miRNA 作用机制的发现为OP 的诊断及新型抗OP 药物的研制提供了依据[5-6]。
尽管新型抗OP 药物不断问世,但双膦酸盐(bisphosphonates,BPs)仍是目前临床上使用最广泛的骨吸收抑制剂,在抗骨折治疗上有不可忽视的作用,最近BPs 再次被各国权威指南推荐作为部分骨折患者的初始治疗方案[7]。本文将对几种常见的BPs 的作用机制、药代动力学、临床疗效及安全性进行总结分析,为医务工作者正确合理使用BPs 提供参考。
1 双膦酸盐分子结构及作用机制
1.1 双膦酸盐分子结构无机焦磷酸盐是一种天然存在于血清和尿液中的生物合成反应产物,它的氧原子(P⁃O⁃P)被碳原子取代(P⁃C⁃P)后形成BPs(图1)。P⁃C⁃P 与骨矿物羟基磷灰石(HAP)结合,是BPs 抑制骨吸收的必要条件,R1 侧链取代基主要参与BPs 与HAP 的结合,R2 侧链取代基对BPs 抗骨吸收活性有重要的作用。第一代BPs 抗骨吸收作用较弱,通过不断地研究发现进一步延长R2 侧链长度或引入环状结构时可增强药物活性,从而研制出第二、三代双膦酸盐(表1)[8]。
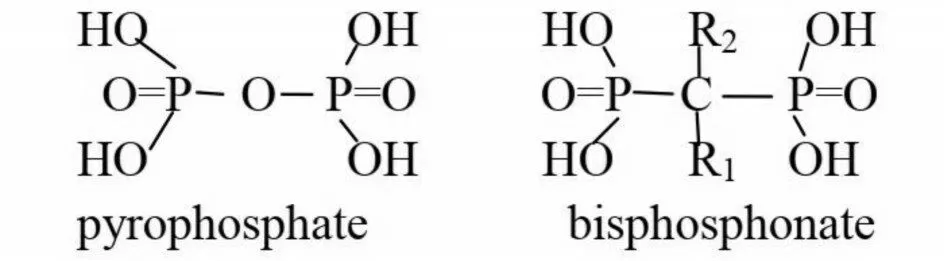
图1 无机焦磷酸盐(左)和双膦酸盐(右)分子结构Fig.1 The molecular structure of pyrophosphate(left)and bisphosphonate(right)
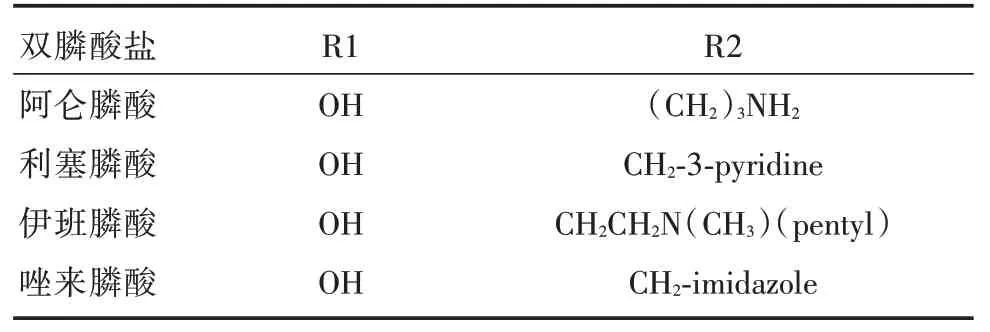
表1 常见双膦酸盐分子结构式[8]Tab.1 The molecular structure of some bisphosphonates
1.2 双膦酸盐分子作用机制常见的几种BPs,如阿仑膦酸(alendronate,ALN)、伊班膦酸(ibandro⁃nate,IBN)、利塞膦酸(risedronato ,RIS)、唑来膦酸(zoledronic acid,ZOL)均属于含氮BPs(nitrogen⁃containing bisphosphonate,N⁃BPs)。N⁃BPs 通过抑制破骨细胞功能,从而抑制骨吸收,作用机制为:(1)抑制甲羟戊酸⁃胆固醇合成途径中的法尼基二磷酸合成酶(farnesyl pyrophosphate synthase,FPPS)活性;(2)破坏破骨细胞功能必不可少的蛋白质的异戊烯酸酯化(脂化作用);(3)干扰骨微绒毛衬界面上吸收所需的GTPase 信号蛋白;(4)ZOL 还被代谢为ATP 类似物三磷酸1⁃腺苷50⁃基酯3⁃(3⁃甲基丁⁃3⁃烯基)酯,该酯抑制腺嘌呤核苷酸的转移酶(调节线粒体中的ADP/ATP 交换)[9]。N⁃BPs 抑制FPPS 活性是其抗骨吸收最主要的机制,研究表明各N⁃BPs 效价排序依次为ZOL>RIS>IBN>ALN[10]。
2 药代动力学
BPs 药代动力学参数见表2。
2.1 吸收目前临床上可通过口服或静脉给予BPs。口服BPs 通过两种途径从胃肠道吸收进入血液:(1)细胞外运输,通过上皮细胞进入血液;(2)细胞间运输,通过上皮细胞间的紧密连接进入血液。BPs 的口服生物利用度很低,静脉给药直接进入血液,生物利用度明显较口服利用度高[11]。
2.2 分布BPs 进入血液后,40%~60%的剂量被骨组织吸收,也有一部分被软组织吸收(如肝脏、脾脏)[12]。
2.3 代谢BPs 由于其P⁃C⁃P 主链的稳定性和水溶性性质,在体内稳定,不发生水解,最终以原形从肾脏排出。
2.4 清除进入机体附着于骨矿物质表面的BPs,在骨吸收过程中可被破骨细胞摄取或继续附着于骨矿物质表面,且在骨形成过程中可嵌入骨骼中,因此骨骼中的BPs 清除非常缓慢。而未被骨组织吸收的BPs 在24 h 内几乎完全通过肾脏排出,仅有约0.5%的剂量会保留在肾组织中[12]。
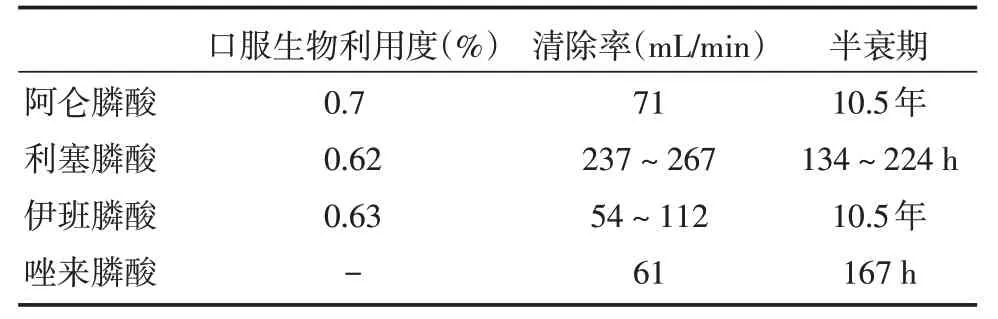
表2 BPs 药代动力学参数[13-15]Tab.2 The pharmacokinetic parameters of some bisphosphonates
3 临床疗效
3.1 ALNBLACK 等[16]研究中纳入了2 027 例绝经后妇女,随机分配为安慰剂组和ALN 组(开始时每天5 mg,24 个月后每天10 mg),3年研究结束后ALN 组股骨颈、全髋关节、后腰椎、全身骨密度分别增加了4.1%、4.7%、6.5%、1.8%;椎体骨折风险降低47%。FLEX 研究中ALN 组和安慰剂组腰椎骨密度分别增加了5.26%、1.52%,全髋关节骨密度分别下降了1.02%、3.38%;椎体骨折在安慰剂组中更常见,但差异无统计学意义[17]。
3.2 IBNCHESNUT 等[18]研究中纳入了296 例绝经后妇女,随机分配为安慰剂组或IBN 组(每天2.5 mg 或每次20 mg,隔天1 次,3 个月共12 次)。3年研究结束后,IBN 组椎体骨折风险分别降低了62%和50%,腰椎骨密度分别增加了6.5%和5.7%。对降低非椎体骨折以及髋部骨折风险,尚无明确证据。REGINSTER 等[19]研究纳入了1 609例绝经后妇女,随机分配为安慰剂组或IBN 组(每日2.5 mg、每月50 mg、每月100 mg、每月150 mg)。2年研究结束后,IBN组腰椎骨密度分别增加了5.0%、5.3%、5.6%、6.6%,股骨近端骨密度也明显增加。EIS⁃MAN 等[20]研究中将1 395 例受试对象随机分配为IBN 组(每两个月2 mg 或每3 个月3 mg 静脉注射)和安慰剂组(每日口服2.5 mg),2年研究结束后各治疗方案腰椎骨密度分别增加了6.4%、6.3%、4.8%。HAGION 等[21]的研究亦证明了静脉注射方案较口服治疗方案效果显著。
3.3 RISHARRIS 等[22]研究中将受试者随机分配为RIS 组(每日5 mg)和安慰剂组。3年研究结束后RIS 组腰椎、股骨颈、股骨粗隆骨密度分别增加了5.4%、3.3%、1.6%;椎体、非椎体骨折风险分别降低了49%、39%。SORENSEN 等[23]研究(VERT⁃MN)中,RIS 组股骨转子骨密度分别增加了9.3%、2.2%、5.7%,髋部骨密度维持稳定;椎体、非椎体骨折风险分别降低了59%、41%,未观察到髋部、腰椎、股骨颈骨折。MELLSTRÖM 等[24]研究(VERT⁃MN)中,RIS 组腰椎、全髋、股骨颈、股骨粗隆骨密度分别增加了11.5%、3.9%、3.2%、6.1%;新椎体骨折年发生率与安慰剂组相似(3.8%)。
3.4 ZOLBLACK 等[25]在HORIZON⁃PFT 试验中,ZOL 组(Z3)和安慰剂组随访3年后,Z3 组腰椎、髋部、股骨颈骨密度分别增加了6.71%、6.02%、5.06%;椎体、髋部、非椎体、临床椎体、临床骨折风险分别降低了70%、41%、25%、77%、33%。第1 次扩展研究中,ZOL 组(Z6)和安慰剂组(Z3P3)腰椎、股骨颈骨密度分别增加了12.1%、4.5%和10.1%、3.1%,椎体骨折风险分别降低了6.2%、3.0%,非椎体骨折、髋部骨折、临床椎体骨折、临床骨折发生率无显著差异[26]。第2 次扩展研究中,ZOL 组(Z9)和安慰剂组(Z6P3)椎体形态骨折、临床骨折发生率无显著差异[17,27]。XU 等[28]对绝经后OP 患者的研究亦证明ZOL 能显著能提高骨密度、降低骨折风险。通过以上各项研究分析发现各BPs 均可有效地预防骨折,但效价存在一定的差异。根据上述及其他研究可对各BPs 给药方案进行归纳总结,并推论出各种BPs 最有效的给药方案(表3)。

表3 几种BPs 类的给药方案[29-30]Tab.3 Dosing regimens of several bisphosphonates
4 不良反应
4.1 急性期反应(acute phase reaction,APR)APR 是指静脉注射BPs 后出现的短暂的类似轻至中度的流感样症状,通常在72 h 内消失,一般不超过1 周。APR 发生机制主要为:FPPS 活性抑制后导致外周血单核细胞中异戊烯基二磷酸(IPP)蓄积,并大量激活γδT 细胞,导致促炎性细胞因子(肿瘤坏死因子⁃a、白细胞介素⁃6、干扰素⁃c)的释放[33]。非甾体类抗炎药可显著降低APR 的发生率和严重程度,因此建议首次接受BPs 治疗的患者可提前使用该类药物[34]。
4.2 胃肠道副作用胃肠道副作用主要是由药物刺激上消化道黏膜所致,症状包括食道刺激、吞咽困难和胃灼热。一项随机对照试验结果显示对照组与试验组的上消化道事件发生率相似[35]。当已存在食管狭窄、严重的胃食管反流、失弛缓症等胃肠道疾病时,应谨慎使用口服BPs。
4.3 肾毒性肾毒性主要发生于静脉给药。研究表明ZOL 对FPPS 的抑制使异戊二烯化蛋白水平降低,导致Na+⁃K+⁃ATP 酶功能降低,最终导致细胞凋亡;CHENG 等[36]研究亦证实ZOL 可激活HK⁃2细胞中TGFβ介导的多种信号通路导致肾毒性。因此美国FDA 提出若GFR <30 mL/min,禁用IBN;若GFR <35 mL/min,禁用ZOL。
4.4 BPs 相关颌骨骨坏死(bisphosphonate⁃indu⁃ced osteonecrosis of the jaws,BIONJ)BIONJ 是指无颅面辐射史的患者,且使用过BPs 后颌骨暴露持续超过8 周未愈合[37]。ZIRK 等[38]的研究表明BIONJ 的发病机制与BPs 抑制破骨细胞功能、颌骨血供减少及口腔放线菌定植有关。流行病学数据表明,口服或静脉注射BPs 患者中颌骨骨坏死的发病率在1∶10 000 到1∶100 000 之间[39]。MARA⁃KA 等[35]研究显示,使用与未使用BPs 的OP 患者发生颌骨骨坏死的风险相似。
4.5 非典型骨折(atypical femoral fractures,AFF)AFF 是指发生在转子下或股骨干区的创伤性骨折,其影像学特征为存在横向骨折和皮质增厚[39]。近期研究表明长期使用BPs可严重抑制骨转换,阻止微损伤修复,引起AFF[40]。一项研究发现美国患者在使用BPs 0.1 ~1.9年时AFF发生率为1.78/10 万,8~9.9年时AFF 发生率为131.1/10 万,表明BPs 使用时间越长,风险越大[41]。也有报道显示在现有BPs中,口服ALN时AFF发生率更高[42]。
4.6 心房颤动(atrial fibrillation,AF)OP 患者接受BPs 治疗比未接受BPs 治疗的AF 发生率高,在HORIZON⁃PFT 中Z3 组(1.3%)的严重AF 事件风险显著高于安慰剂组(0.5%)[35]。其机制主要是BPs 诱导炎症因子释放,导致心房重构和心肌纤维化,增加AF 风险[43]。然而最近研究表明,BPs 可能通过抑制纤维化心肌重构而具有抗心律失常作用,因此BPs 与AF 之间的关系存在争议[44]。由上述分析来看APR、肾毒性主要发生在IBN、ZOL 静脉注射时,胃肠道不良反应主要发生在口服RIS、IBN、ALN 时,BIONJ、AFF、AF 在四种药物静脉注射或口服时均可发生。
由于胃肠道不良反应,口服BPs 时要求空腹服用,用200 ~300 mL 白水送服,服药后30 min 内避免平卧,应保持直立体位(站立或坐立),还应避免进食牛奶、果汁等任何食品和药品[1]。鉴于用药方案较为复杂,部分患者依从性明显降低,经对比静脉给药方案不仅可以避免胃肠道不良反应,还可以提高患者依从性。
5 药物假期
药物假期是指在连续使用BPs 治疗一段时间后暂停使用,观察一段时间,再考虑是否继续接受治疗。它的目的主要基于两点:(1)BPs 骨骼半衰期长;(2)停止治疗可减少罕见严重不良事件的发生率。美国骨骼和矿物质研究协会(ASBMR)推荐若患者骨折风险较低(T ≥-2.5),在口服BPs 治疗5年后或静脉注射BPs 治疗3年后,无新发骨折、新的骨折危险因素、明显的骨密度下降,可考虑进入药物假期;若患者骨折风险高(T <-2.5),在口服BPs 治疗10年后或静脉注射BPs 治疗6年后,无新发骨折、新的骨折危险因素、明显的骨密度下降,可考虑进入药物假期[17]。
美国临床内分泌学家协会和美国内分泌学院(AACE/ACE)建议如果患者发生脆性骨折或骨密度显著下降,可恢复治疗。据统计,15%的患者进入药物假期后在第4年和第5年骨质疏松性骨折的发生率再次明显升高,因此停药一定时间后应重新评估骨折风险,以确定是否需要继续抗OP治疗[45]。
6 总结与展望
BPs 抗骨折效果显著、不良反应发生率低,是目前临床上使用的最广泛的抗OP 药物之一。然而对于BPs 的治疗周期、何时进入药物假期以及再次启动治疗的时机,我国尚无明确的指南予以推荐,因此今后需要进行大量临床研究探索上述问题。此外随着新型抗OP 药物的不断问世,BPs与新型抗OP 药物的联合应用、序贯治疗等方面值得进一步关注探索。
