Rho激酶抑制剂联合葛根素通过抑制TGF⁃β1/Smads信号通路和炎症反应来减轻缺氧诱导肺动脉高压对肺血管的损伤
2021-04-08陈晨张妍蓓
陈晨 张妍蓓
1安徽医科大学第一附属医院老年呼吸与危重症(合肥230022);2安徽省胸科医院结核科(合肥230022)
许多肺部疾病均能引起肺部持续性的低氧环境,从而发展为缺氧性肺动脉高压[1-3],死亡率极高[4]。研究发现通过抑制TGF⁃β1/Smads 通路相关因子的表达能够缓解缺氧性肺动脉高压[5],炎症和重塑会使血管发生永久性的结构改变,而半乳糖凝集素⁃3(galectin⁃3,Gal⁃3)的高表达能够增加平滑肌细胞的非自然增殖和存活[6]。近年来研究发现Rho 激酶抑制剂法舒地尔在慢性阻塞性肺疾病相关性肺动脉高压中有一定作用[7]。国内对于中药治疗缺氧性肺动脉高压的研究越来越多,研究发现黄酮类槲皮素能减轻肺动脉高压的严重程度[8],丹参通过抑制肺动脉平滑肌细胞过度增殖和过度激活RhoA/Rho 信号通路来预防大鼠缺氧性肺动脉高压[9],葛根素诱导人肺动脉平滑肌细胞线粒体依赖性凋亡[10],但是对于Rho 激酶抑制剂法舒地尔联合葛根素治疗缺氧性肺动脉高压的研究未见报道。因此研究Rho 激酶抑制剂法舒地尔联合葛根素通过TGF⁃β1/Smads 通路和炎症反应来减轻缺氧诱导肺动脉高压对肺血管的损伤程度具有重要的意义,对于临床治疗缺氧性肺动脉高压提供理论依据。
1 材料与方法
1.1 实验动物与分组选取体质量为180~200 g的SD 大鼠60 只(最后纳入实验的例数,HPH 模型成功率为72%),随机分成5 组:正常对照组、模型组、葛根素组、法舒地尔组和法舒地尔与葛根素联合治疗组。
将模型组、葛根素组、法舒地尔组和法舒地尔与葛根素联合治疗组大鼠分别放入常压缺氧舱内缺氧,缺氧期间舱内氧浓度控制在10%,每天缺氧8 h,连续21 d[11]。各组大鼠缺氧放置前30 min进行腹腔注射,葛根素组大鼠注射葛根素注射液20 mg/kg,法舒地尔组大鼠注射法舒地尔注射液15 mg/kg,联合治疗组大鼠注射葛根素注射液20 mg/kg+法舒地尔注射液15 mg/kg,对照组和模型注射相当体积的0.9%NaCl 溶液。
1.2 实验方法
1.2.1 血流动力学指标的测定将麻醉后的大鼠仰卧位固定在手术板上,用测压导管沿着大鼠劲外静脉经右心房插入至右心室及肺动脉,记录右心室收缩压(RVSP)、平均肺动脉压(mPAP)、肺动脉收缩压(PASP)和肺小动脉楔压(PAWP)。
1.2.2 右心室肥厚指数的测定开胸取心脏,采集并称取右心室(RV)和左心室加室间隔(LV+S)的重量,计算右心室肥厚指数(RVHI)=RV/(LV+S)。
1.2.3 HE 染色法将石蜡切片脱蜡至水后,没入Harris 苏木素染液,蒸馏水洗后用1%的盐酸酒精分化,0.6%氨水返蓝,伊红染液中染色。脱水透明后,用中性树胶封片保存。用光学显微镜镜观察肺血管形态学变化。
1.2.4 qPCR 检测法肺组织被迅速分离后放于液氮中。采用Trizol 法提取样品中总RNA。根据逆转录试剂盒说明书进行反转录后,扩增目的基因(表1)。

表1 引物序列Tab.1 Primer sequence
1.2.5 Western blot检测法提取总蛋白,采用SDS⁃PAGE 分离蛋白。随后转印蛋白到PVDF 膜上。5%的脱脂奶粉室温封闭1 h,一抗(兔抗鼠TGF⁃β1、Smad2、Smad4 和Smad7 多克隆抗体)4 ℃孵育过夜,二抗(HRP 标记的山羊抗兔)室温孵育1 h。采用ECL显色法扫描获得图片。通过Image J 软件对目的条带进行灰度分析,做统计学分析。
1.2.6 免疫组化检测法将肺组织放入4 ℃4%多聚甲醛中固定6 h,再放入30%蔗糖4 ℃过夜,然后将组织包埋成石蜡块,切片、爬片、脱腊后按照免疫组化试剂盒进行免疫组化,置于倒置显微镜下观察。
1.3 统计学方法采用SPSS 20.0 进行统计学分析,值以均数±标准差表示。组间多重比较采用单因素方差分析,采用最小显著性差异(LSD)检验作为多重比较的事后分析。方差不整齐时进行Dunnett′t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 法舒地尔联合葛根素对HPH大鼠血流动力学和右心室重构指标的影响模型组RVSP、mPAP、PASP、PAWP和RVHI值明显高于Sham组(P<0.05)。与模型组、葛根素组和法舒地尔组比较,联合治疗组的RVSP、mPAP、PASP、PAWP 和RVHI 值显著降低(P<0.05)。见表2。
2.2 法舒地尔联合葛根素对HPH 大鼠肺动脉血管壁的影响见图1,对照组组肺动脉血管壁清晰、管壁薄、管腔大、细胞分布均匀、血管周围无炎性浸润。与对照组相比,模型组肺动脉血管壁明显增厚、平滑肌增生、管腔变狭窄、细胞核增多、血管周围出现炎性浸润。与模型组相比,葛根素组、法舒地尔组和联合治疗组肺动脉血管壁厚度下降、管腔变小、细胞形态趋于正常、血管周围炎性浸润程度下降。
表2 各组大鼠血流动力学和右心室重构指标比较Tab.2 Comparison of hemodynamics and right ventricular remodeling in each group ±s
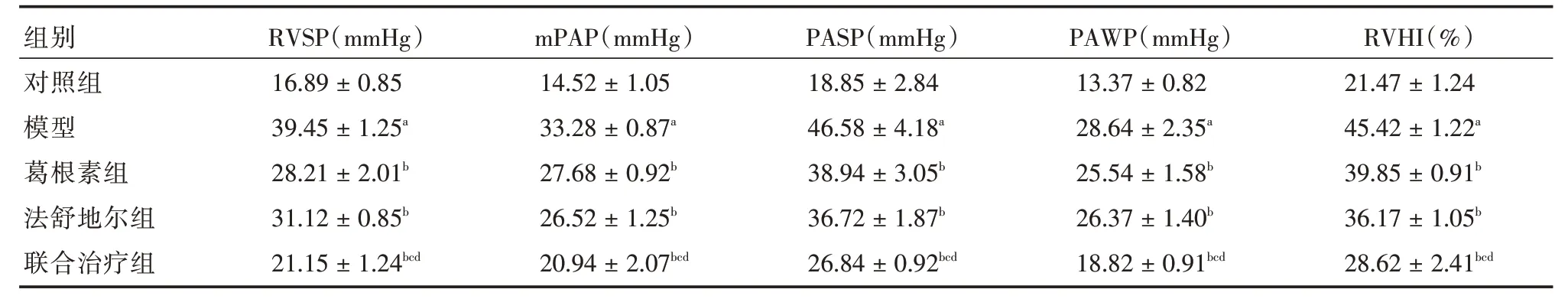
表2 各组大鼠血流动力学和右心室重构指标比较Tab.2 Comparison of hemodynamics and right ventricular remodeling in each group ±s
注:与对照组比较,aP <0.05;与模型组比较,bP <0.05;与葛根素组比较,cP <0.05;与法舒地尔组比较,dP <0.05
组别对照组模型葛根素组法舒地尔组联合治疗组RVSP(mmHg)16.89±0.85 39.45±1.25a 28.21±2.01b 31.12±0.85b 21.15±1.24bcd mPAP(mmHg)14.52±1.05 33.28±0.87a 27.68±0.92b 26.52±1.25b 20.94±2.07bcd PASP(mmHg)18.85±2.84 46.58±4.18a 38.94±3.05b 36.72±1.87b 26.84±0.92bcd PAWP(mmHg)13.37±0.82 28.64±2.35a 25.54±1.58b 26.37±1.40b 18.82±0.91bcd RVHI(%)21.47±1.24 45.42±1.22a 39.85±0.91b 36.17±1.05b 28.62±2.41bcd

图1 法舒地尔联合葛根素对HPH 大鼠肺动脉血管壁的影响Fig.1 Effect of fasudil combined with puerarin on pulmonary artery wall in HPH rats
2.3 法舒地尔联合葛根素对HPH 大鼠TGF⁃β1/Smads 通路的影响见图2,与模型组、葛根素组和法舒地尔组相比较,联合治疗组TGF⁃β1、Smad2、Smad4 和Smad7 蛋白的表达量显著下降(P<0.05)。

图2 法舒地尔联合葛根素对HPH 大鼠TGF⁃β1/Smad2/Smad4/Smad7 的影响Fig.2 Effects of fasudil combined with puerarin on TGF⁃ β1/Smad2/Smad4/Smad7 in HPH rats
2.4 法舒地尔联合葛根素对HPH 大鼠炎症因子的影响见图3,与模型组、葛根素组和法舒地尔组相比较,联合治疗组iNOS、COX⁃2、IL⁃6 和HIF⁃1α mRNA 的表达量显著下降(P<0.05)。
2.5 法舒地尔联合葛根素对HPH 大鼠Gal⁃3 的影响见图4,与模型组、葛根素组和法舒地尔组相比较,联合治疗组Gal⁃3 蛋白的表达量显著下降(P<0.01)。

图3 法舒地尔联合葛根素对HPH 大鼠iNOS/COX⁃2/IL⁃6/HIF⁃1α mRNA 的影响Fig.3 Effects of fasudil combined with puerarin on iNOS/COX⁃2/IL⁃6/HIF⁃1α mRNA in HPH rats
3 讨论

图4 法舒地尔联合葛根素对HPH 大鼠Gal⁃3 蛋白的影响Fig.4 Effects of fasudil combined with puerarin on Gal⁃3 protein in HPH rats
本研究发现与对照组相比,模型组右心室收缩压和右心肥厚指数显著升高,且肺动脉血管壁明显增厚、平滑肌增生、管腔变狭窄、细胞核增多、血管周围出现炎性浸润等,说明缺氧诱导的肺动脉高压会改变心脏右心室压力,加重右心室负荷[12-13]的同时,导致肺循环阻力增大[14],这与AGARWAL等[15]的研究结果相似。本研究还发现与模型组、葛根素组和法舒地尔组相比较,联合治疗组HPH大鼠RVSP、mPAP、PASP、PAWP、PVHI 和Gal⁃3 蛋白的表达量下降、脉血管壁厚度下降、管腔变小、细胞形态趋于正常、血管周围炎性浸润程度下降,提示法舒地尔联合葛根素对大鼠缺氧诱导的肺血管损伤具有很好的修护作用,且效果优于法舒地尔和葛根素单独治疗。Gal⁃3 的相对表达量能够预测心血管疾病的发生风险及治疗效果[16],其高表达能够增加平滑肌细胞的非自然增值和存活[17]。
进一步检测了炎症相关因子的表达情况,发现模型组炎症相关因子iNOS、COX⁃2、IL⁃6 和HIF⁃1α mRNA 等炎症因子的相对表达量显著升高,而联合治疗组炎症因子的相对表达量显著下降,提示模型组大鼠为了保护机体免受低氧诱导肺动脉高压的损伤炎性因子水平迅速上升[18],而法舒地尔联合葛根素具有免疫调节和抗炎作用,保护肺血管免受缺氧诱导的肺动脉高压的损伤[19]。本研究检测了TGF⁃β1/Smads 通路相关蛋白的表达,结果显示联合治疗组TGF⁃β1/Smads 通路相关蛋白相对表达量下降。缺氧诱导的肺动脉高压可激活TGF⁃β1,激活的TGF⁃β1 首先与受体结合使其活化,受体活化后激活丝/苏氨酸激酶从而磷酸化其下游信号蛋白Smad2[20],磷酸化的Smad2 与Smad4 结合形成异二聚体,转入细胞核调节靶基因的表达,即Smad2 与Smad4 复合物的形成及核转位是该通路活化的标志[21-22]。受体激活性Smad 被激活以后,相对应的靶基因的产物开始调控抑制性Smad7 的表达,构成负反馈调节环路从而抑制Smad 通路信号的转导,即Smad7 表达的上调也是该通路活化的标志[23]。以上提示,缺氧诱导肺动脉高压促进TGF⁃β1/Smads 通路活化来增大肺血管损伤程度,而法舒地尔联合葛根素通过促进TGF⁃β1/Smads 通路负反馈调节来保护缺氧性肺血管损伤。
综上所述,缺氧性肺动脉高压可促使肺血管重建、导致肺损伤,法舒地尔联合葛根素能保护肺动脉血管缓解缺氧诱发的肺动脉高压引起一系列肺血管收缩失常、重建及肺血管壁病理变化,并通过调节TGF⁃β1/Smads 信号通路和缓解炎症反应来保护机体减轻损伤,为缺氧性肺动脉高压的临床治疗提供参考。
