铁死亡参与高脂饮食诱导的ApoE-/-小鼠动脉粥样硬化及ox⁃LDL诱导的泡沫细胞形成过程
2021-04-08刘洋孙岳杨安宁刘子歌刘太阳郝玮刘耀阳王秋实刘志宏
刘洋 孙岳 杨安宁 刘子歌 刘太阳 郝玮 刘耀阳 王秋实 刘志宏
宁夏医科大学1公共卫生与管理学院,2基础医学院,3临床医学院(银川750004);4国家卫生健康委代谢性心血管疾病研究重点实验室(银川750004)
动脉粥样硬化(atherosclerosis,AS)是一种脂质驱动的动脉内膜炎症性疾病,是多种心血管疾病的病理基础[1]。铁死亡是一种铁依赖的氧化性细胞死亡,其特征是细胞内铁的增加和抗氧化能力的降低导致过氧化脂质的致死性积累[2],铁死亡已被证明对多种疾病具有重要意义。脂质过氧化、斑块内出血和铁沉积是晚期人类AS 斑块的特征[3],这是AS 中铁死亡发生的间接证据。已有研究证实[4]抑制铁死亡可以减轻小鼠主动脉内皮细胞的脂质过氧化和AS。动脉内膜中巨噬细胞源性泡沫细胞的形成是早期AS 病变的主要标志,且在AS 发生发展的各个阶段都起着重要作用,但铁死亡在泡沫细胞及AS 形成中的作用尚不清楚。因此,本文拟从泡沫细胞铁死亡角度出发,探讨ox⁃LDL 诱导巨噬细胞泡沫化以及高脂饮食诱导ApoE-/-小鼠AS 过程中是否有铁死亡发生,并讨论了泡沫细胞铁死亡在晚期斑块中可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 动脉粥样硬化动物模型制备本次研究选用6 ~8 周龄雄性ApoE-/-小鼠,购于宁夏医科大学动物中心。12只ApoE-/-小鼠随机分为两组(n=6):(1)对照组:普通饲料喂养;(2)模型组:高脂饲料(1.25%胆固醇)喂养。饲养于宁夏医科大学SPF级实验动物中心,小鼠饲养16 周后处死,进行后续实验。整个实验过程符合宁夏医科大学实验动物使用伦理规定。
1.1.2 正常RAW264.7 巨噬细胞的培养及泡沫细胞模型的复制RAW 264.7巨噬细胞购于中国科学院典型培养物保藏委员会细胞库,细胞使用完全培养基(10%胎牛血清+DMEM 高糖培养基+1%双抗)培养于37 ℃、5%CO2恒温培养箱,将处于对数生长期的RAW264.7 巨噬细胞随机分为Control 组和Ox⁃LDL 组,Control 组给予常规培养基,Ox⁃LDL 组给予含有50 mg/L ox⁃LDL 的培养基诱导培养24 h,即为RAW264.7 巨噬细胞源性泡沫细胞模型[5]。
1.1.3 实验试剂和仪器设备H&E 染色试剂盒(碧云天,中国);油红O 检测试剂盒(索莱宝,北京);RNA 提取试剂盒(天根,中国);反转录和荧光定量PCR 试剂盒(赛默飞,美国);荧光定量PCR 仪(枫岭国际,上海);谷胱甘肽检测试剂盒(南京建成,中国);丙二醛(MDA)检测试剂盒(贝博,中国);铁离子比色法检测试剂盒(普利莱,北京);蛋白提取试剂盒(凯基,南京);p53、GPX4 和SLC7A11抗体(abcam,美国);辣根过氧化物酶(HRP)标记的羊抗兔二抗(博奥森,北京);DMEM 培养基和胎牛血清(Gibco,美国);电泳仪及凝胶成像系统(Rio⁃Rad,美国)。
1.2 方法
1.2.1 血脂水平检测全自动生化分析仪检测小鼠血清中TG、TC、LDL⁃C 和HDL⁃C 的含量。
1.2.2 H&E 和油红O 染色观察小鼠主动脉根部斑块面积大小和脂质沉积H&E 染色:多聚甲醛固定冰冻切片,流水清洗后苏木素染色,1%盐酸乙醇分化后流水冲洗返蓝,随后伊红染色,梯度脱水透明后封片,光镜下观察。
油红O 染色:多聚甲醛固定冰冻切片,60%异丙醇浸洗,油红O 染色,苏木素复染,流水冲洗返蓝,1%盐酸乙醇分化,封片后在光镜下观察。
1.2.3 qRT⁃PCR 检测泡沫细胞及主动脉组织中p53、GPX4 和SLC7A11 mRNA 表达水平取主动脉组织或细胞,按照试剂盒说明书提取总RNA,测定浓度后进行反转录,加入扩增反应体系运用qRT⁃PCR 法扩增。本次引物由上海生物工程公司合成,引物序列见表1。采用2⁃ΔΔCt法计算目的基因的相对表达水平。
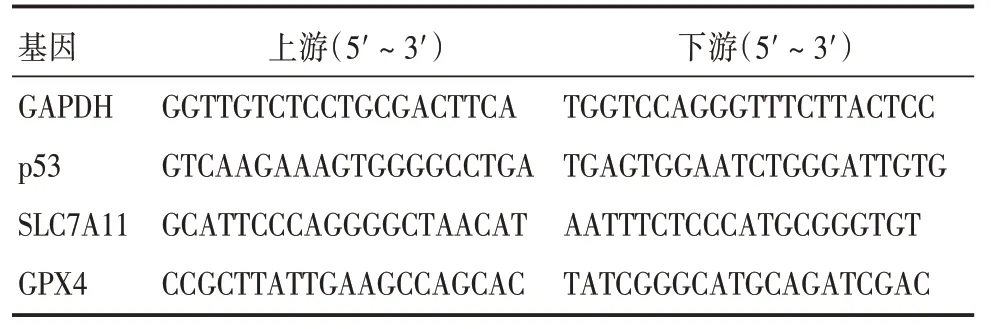
表1 引物序列表Tab.1 Primer sequence table
1.2.4 Western blot 法测定泡沫细胞及主动脉组织p53、GPX4 和SLC7A11 蛋白表达水平取主动脉组织或细胞,使用蛋白提取试剂盒提取蛋白。制备蛋白样品后进行SDS⁃PAGE 电泳,采用湿转法转印至PVDF 膜上,5%脱脂奶粉封闭2 h,洗膜后一抗4 ℃孵育过夜。二抗室温孵育2 h,加入ECL 发光底物显色后,使用凝胶成像仪成像。以目的蛋白与β⁃actin 蛋白光密度的比值反映目的蛋白的相对表达水平。
1.2.5 泡沫细胞中ROS、GSH、MDA 和Fe2+水平的检测荧光探针DCFH⁃DA 检测各组细胞内过氧化标志物ROS 水平,比色法观察各组细胞内GSH、MDA 和Fe2+水平,严格按照试剂盒说明书进行操作。
1.3 统计学方法采用SPSS 23.0软件分析数据,计量资料以均数±标准差表示,两组间比较采用两独立样本t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 高脂饮食诱导ApoE-/-小鼠动脉粥样硬化模型的建立血脂胆固醇水平检测结果显示,与对照组相比,模型组小鼠血清中TC、TG、LDL⁃C 水平显著升高(P<0.01),HDL⁃C 差异无统计学意义(P>0.05,图1);H&E和油红O染色结果显示,与对照组相比,模型组小鼠主动脉根部可见内膜增厚,管腔明显狭窄,有明显粥样斑块形成,且存在大量脂滴沉积,油红O 阳性面积占比较大(P<0.01,图2)。表明ApoE-/-小鼠AS 模型构建成功。

图1 小鼠血清中TC、TG、HDL⁃C 和LDL⁃C 的含量Fig.1 Content of TC、TG、HDL⁃C and LDL⁃C in mice serum

图2 小鼠主动脉根部横切面H&E 和油红O 染色(20×)Fig.2 Mouse aortic root cross sections were separately stained with H&E and Oil Red O(20×)
2.2 高脂饮食诱导的ApoE-/-小鼠主动脉组织中铁死亡相关基因mRNA 和蛋白的表达采用qRT⁃PCR 及Western blot 分别检测主动脉组织中铁死亡相关基因表达情况,结果显示,与对照组相比较,模型组p53的mRNA表达明显上升(P<0.01),GPX4和SLC7A11的mRNA 表达呈降低趋势(均P<0.05,图3)。蛋白表达与上述mRNA 表达改变相一致(P<0.05,图4)。证实高脂饮食诱导的ApoE-/-小鼠AS 中铁死亡的发生。

图3 小鼠主动脉组织中铁死亡相关基因的mRNA 表达Fig.3 The mRNA expression of ferroptosis⁃related genes in mice aorta

图4 对照组和模型组中铁死亡相关基因的蛋白表达Fig.4 The protein expression of ferroptosis⁃related genes in mice aorta
2.3 RAW264.7 巨噬细胞源性泡沫细胞模型的建立选择大小均一、生长状态良好的RAW264.7 巨噬细胞,用含50 mg/L 的ox⁃LDL 刺激后通过油红O观察,胞浆中有红色脂滴,由此泡沫细胞模型建立成功,见图5。

图5 建立RAW264.7 巨噬细胞源性泡沫细胞模型(20×)Fig.5 Establishment of RAW264.7 macrophage⁃derived foam cell model(20×)
2.4 ox⁃LDL 诱导的泡沫细胞发生铁死亡为了进一步明确铁死亡在泡沫细胞中的作用,采用qRT⁃PCR 及Western blot 分别检测两组细胞中铁死亡相关基因的表达情况。与Control 组相比,Ox⁃LDL 组GPX4 和SLC7A11 mRNA 表达水平显著降低(均P<0.01),而p53 mRNA 表达水平明显升高(P<0.01),见图6。随后检测了p53、GPX4 和SLC7A11 蛋白表达,与Control 组相比,Ox⁃LDL 组p53 蛋白表达升高(P<0.001),GPX4 和SLC7A11表达水平降低(均P<0.01),说明ox⁃LDL 诱导的泡沫细胞有铁死亡发生,见图7。
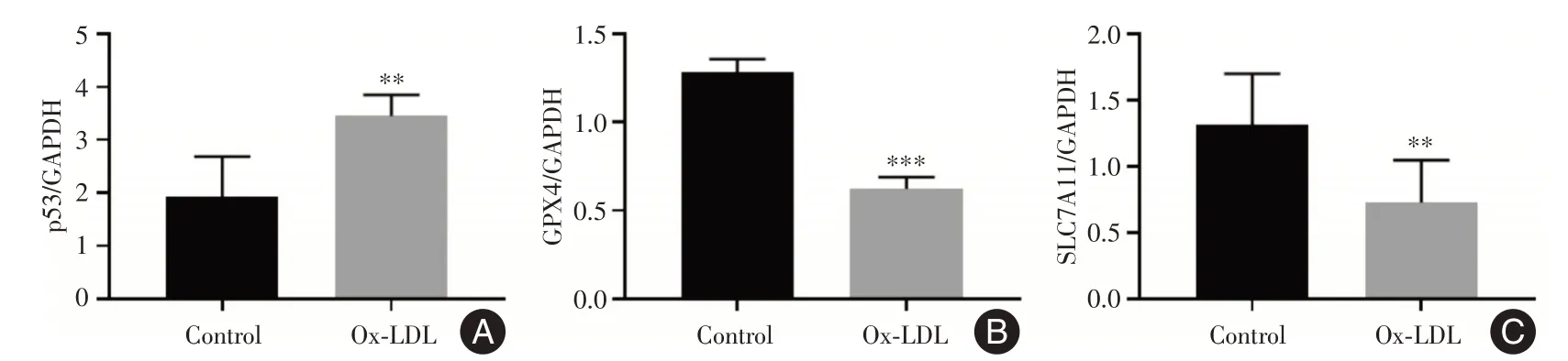
图6 Control 组和Ox⁃LDL 组中铁死亡相关基因的mRNA 表达Fig.6 The mRNA expression of ferroptosis⁃related genes in Control and Ox⁃LDL groups
2.5 ox⁃LDL 诱导的泡沫细胞中脂质过氧化物和铁含量增加观察两组细胞内脂质过氧化物、GSH 和铁离子水平变化,结果显示,与Control 组相比,Ox⁃LDL 组细胞ROS、MDA 表达水平明显增高(均P<0.01),而GSH 含量显著降低(P<0.01),Fe2+含量升高(P<0.05),见图8。
3 讨论
随着AS 的发生发展,泡沫细胞逐渐在动脉内膜中堆积形成脂质斑块,当动脉壁中的脂质斑块发生破裂,继发血栓形成,导致各种急慢性心血管疾病事件及其他并发症发生[6-8]。巨噬细胞/泡沫细胞死亡是晚期斑块的突出特征,也是导致坏死核心形成和斑块不稳定的主要因素。脂质过氧化是导致AS 的关键危险因素。铁累积和脂质过氧化是铁死亡发生的重要机制,也是AS 发病的重要危险因素[9]。因此探究铁死亡与AS 的关系,对于AS 的机制研究与防治具有重要意义。
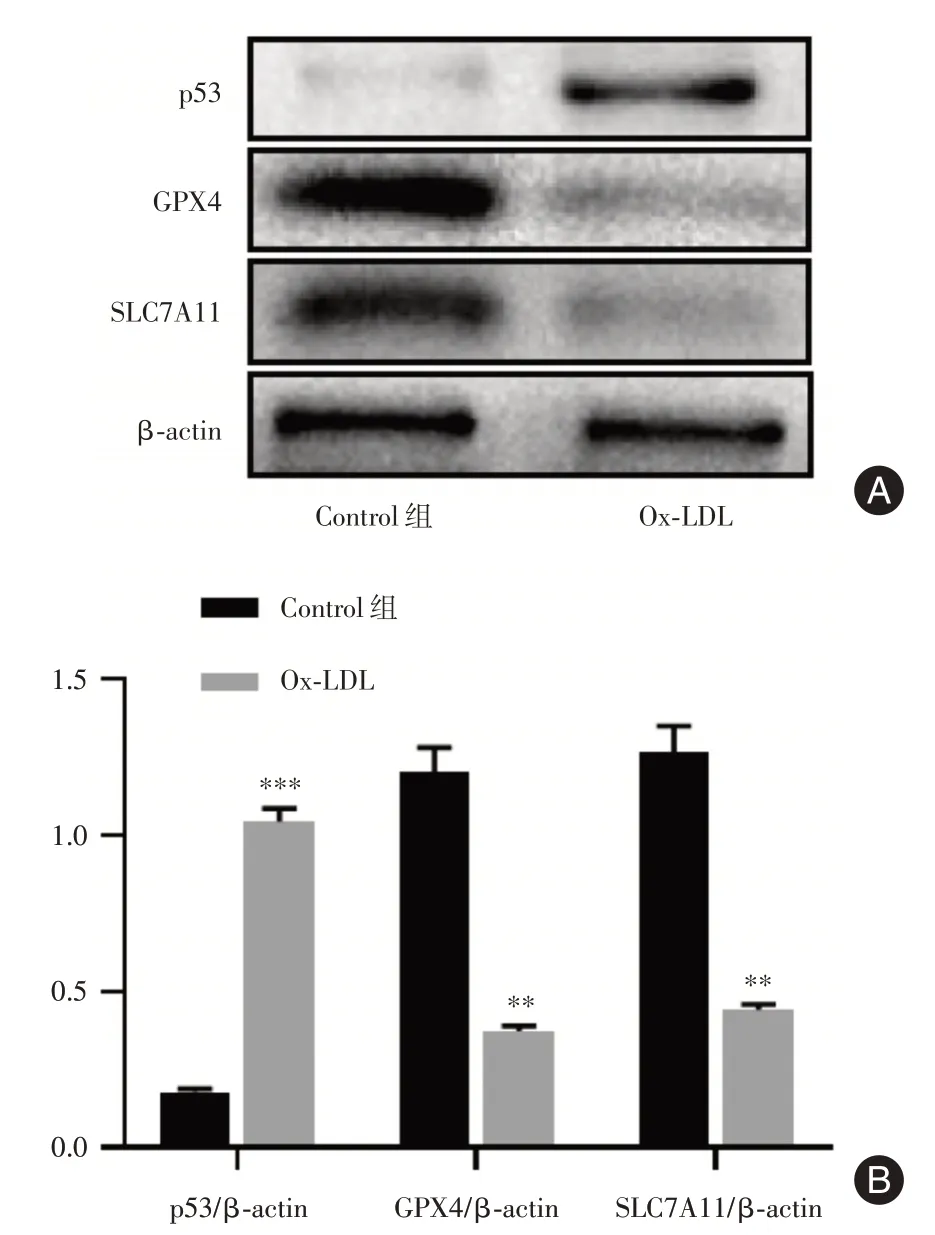
图7 Control 组和Ox⁃LDL 组中铁死亡相关基因的蛋白表达Fig.7 The protein expression of ferroptosis⁃related genes in Control and Ox⁃LDL groups
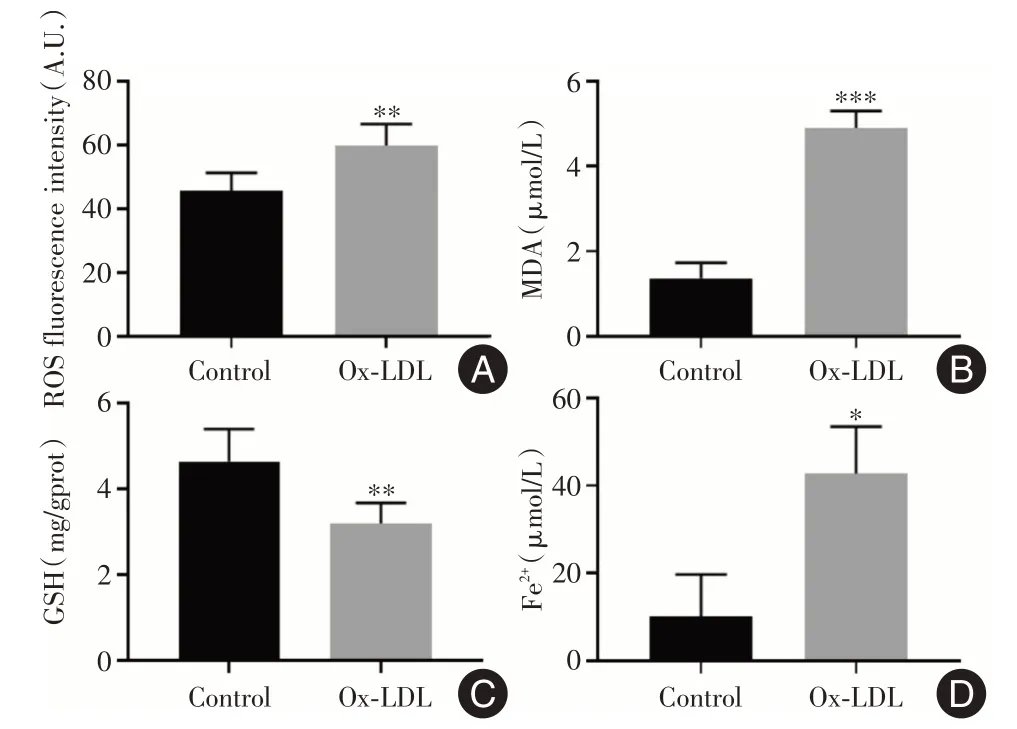
图8 ox⁃LDL 诱导的泡沫细胞中ROS、MDA、GSH 和Fe2+表达水平的影响Fig.8 The content of ROS,MDA,GSH and Fe2+in ox⁃LDL⁃induced foam cell
有研究发现,在高脂饮食喂养的ApoE-/-小鼠AS 模型的肝细胞损伤过程中有铁死亡发生[10]。细胞内脂质过氧化物积累导致细胞膜磷脂过氧化是细胞铁死亡的关键驱动因素[11],而抗氧化剂GPX4/GSH 体系在抑制这种脂质过氧化反应中发挥重要作用[12]。SLC7A11 是谷氨酸/胱氨酸转运体系统(System Xc-)的一个组成部分[13],摄入的胱氨酸合成GSH 通过与GPX4 结合,发挥清除脂质过氧化产物的作用。抑制Xc⁃转运系统导致合成GSH的前体半胱氨酸严重耗竭并伴随细胞内抗氧化能力不足,同时GSH 依赖的酶如GPX4[14]活性也会下降。p53 则可通过抑制SLC7A11 表达、增加ROS 的生成,来加快铁死亡进程[15]。基因和蛋白结果显示,与对照组相比,模型组小鼠SLC7A11 和GPX4表达水平显著降低,而p53 的表达水平则显著上升,提示铁死亡参与高脂饮食诱导的ApoE-/-小鼠AS的发生发展过程,但具体机制有待进一步研究。
在AS 斑块中,泡沫化的巨噬细胞发生凋亡或非凋亡形式的程序性死亡,释放形成坏死核心的细胞成分和脂质,是导致AS 斑块不稳定和易损的关键病理因素之一[16]。故本研究推测,泡沫细胞形成过程可能有铁死亡发生。结果显示,使用ox⁃LDL 处理后,Western blot 及qRT⁃PCR 检测到泡沫细胞中p53 表达水平增加,SLC7A11 和GPX4 的表达水平降低,并且细胞损伤和脂质过氧化作用加重,表现为ROS、MDA 的生成增加,抗氧化剂GSH 的减少,细胞内的铁离子水平也有所升高。结果提示ox⁃LDL 诱导的RAW264.7 巨噬细胞来源泡沫细胞中有铁死亡发生。
综上所述,本研究结果表明在高脂饮食诱导的ApoE-/-小鼠AS 中有铁死亡的参与,且ox⁃LDL 诱导RAW264.7 巨噬细胞泡沫化过程中有铁死亡参与。故针对死亡类型的药理学靶向方法是稳定易损斑块的一种有前途的方法,但泡沫细胞铁死亡在AS 中的具体作用机制,还需更进一步的研究。
