血小板活化对肠微血管内皮细胞血管生成影响的实验研究
2021-04-08翟金海张佳怡徐速
翟金海 张佳怡 徐速
1江苏医药职业学院医学院(江苏盐城224008);2南京中医药大学第一临床医学院(南京210001);3南京中医药大学附属盐城市中医院(江苏盐城224001)
克罗恩病(crohn disease,CD)是一种慢性非特异性肉芽肿性炎症[1],其发病机制尚不清楚,通常被认为与免疫因素有关,是消化科常见难治性疾病之一。由于肠壁的慢性炎症反复刺激,形成了整个肠纤维化层,导致肠道狭窄甚至梗阻。CD导致的肠腔狭窄等严重并发症[2],常需手术治疗。CD 活动期患者外周血小板的异常增高与活化,常与活动程度相关性较高,可作为疾病活动度的一个评估指标[3]。近几年国内外对肠纤维化的发病机制有较多研究进展,其中血管生成被认为是其中十分关键的环节[4],但目前还没有从干预血管生成的角度来改善肠纤维化的研究。本实验通过观察比较加入PI3K/mTOR 抑制剂BEZ235 前后,IMECs 细胞迁移、管腔形成能力的变化来研究活化的血小板对IMECs 血管生成的影响。观察对PI3K/AKT/mTOR 信号通路磷酸化相关蛋白及HIF⁃1α的蛋白表达的影响,以及对纤维化相关因子E⁃cadherin、α⁃SMA、CollagenI 蛋白表达变化和基因表达水平的影响,探讨血小板活化诱导的IMECs 细胞的EMT 的机制。
1 材料与方法
1.1 材料
1.1.1 实验细胞大鼠IMECs 细胞。
1.1.2 主要试剂DMEM/F12 细胞培养液和胰蛋白酶EDTA(美国GIBCO 公司),胎牛血清(Biologi⁃cal Industries,批号:1418110),Penicillin G Sodium Salt(AMRESCO公司Cat.No.2010242),Streptomycin Sulfate(AMRESCO 公司Cat.No.2010382),NaHCO3(美国Gibco 公司Cat.No.11810⁃033),Trypsin(AM⁃RESCO公司Cat.No.2010/04),Trizol(美国Invitrogen公司Cat No.15596⁃026),SDS:santacruze公司(Cat No.sc⁃264510),PVDF 转移膜(DOCLAB 公司Cat No.16220405),anti E⁃cadherin(美国Bioworld 公司),Antiα⁃SMA(Cell Signaling,美国;编号19245),anti Collagen I(美国abcam;编号AB90395),anti PI3K,anti p⁃PI3K(Sigma 公司,美国),antiAkt(武汉Protec⁃tech;编号60203⁃2),anti⁃pAkt(美国Cell Signaling;编号4060),antimTOR(美国AbCam;编号AB32028),anti⁃HIF⁃1α,anti⁃GAPDH,antip⁃mTOR(美国AbCam公司),antiGapdh(武汉Protectech;编号10494⁃1),BEZ235 抑制剂(Selleck 美国CAS915019⁃65⁃7),Matrigel 胶(Affinity 美国),逆转录及PCR 反应体系购自上海申能博彩生物科技有限公司。
1.2 方法
1.2.1 IMECs 分离、培养在无菌条件下取健康大鼠部分空肠剪碎,加入消化液(37 ℃,0.25%胰蛋白酶)1 mL,在0.25%胰酶1 mL 灭菌离心管中消化5 min,用15%FBS 基础培养基5 mL 终止消化。4 ℃、3 000 r/min 离心8 min,弃上清,加完全培养基(15% FCS⁃F12、0.5 μg/mL 胰岛素、1 μg/mL 氢化可的松、5 μg/mL 转铁蛋白、2 μmol/mL 谷氨酰胺);得到的悬液在4 ℃条件下,再离心8 min 后,吸除上清液,加入8 mL 完全培养基,轻轻吹打数次后,静置1 min,吸取悬液,转入0.1%明胶包被的25 cm2培养瓶中,补充青霉素100 U/mL、链霉素100 U/mL,置入37 ℃、5%CO2培养箱中培养。经培养96 h 后局部的消化处理和培养72 h 后的差速黏附处理,得到纯化内皮细胞。经上述处理的细胞,当细胞生长传代,取第三或四代用于实验。
1.2.2 鼠富PLT血浆(PRP)和洗涤血小板(washed platelet,WP)制备及血小板的活化的检测以上各组大鼠在麻醉处死前,腹主动脉取血。WP 制备:将抗凝管中的全血轻轻混匀,室温下离心,800 r/min 离心15 min,取上层PRP 再次室温下离心,2 000 r/min 离心10 min,加入1 μmol/L 的前列环素(prostacyclin,PGI2)防止血小板活化,弃上层血浆,以PBS 缓冲液洗涤PLT 两次,重新轻轻重悬于PBS 缓冲液或培养基中,制成血小板混合悬液,同时调整PLT 计数为2×108/mL[5]。
1.2.3 IMECs细胞的Transwell迁移实验24孔板的Transwell 小室(8 μmol/L 聚碳酸脂膜),上室膜表面均匀铺被去生长因子的Matrigel 的DMEM 培养基稀释液(1∶4,v/v)于37 ℃、5%CO2培养箱中放置30 min 使之凝固,备用。取对数生长期的IMECs细胞悬液100 μL 接种于上室,低血清培养(0.5%,v/v),下室加入无血清DMEM培养基600 μL。每组均设3 个复孔。根据分组情况,加入活化血小板、PI3K/mTOR 抑制剂BEZ235 作用于IMECs 细胞,培养24 h 后取出小室,弃去培养基,漂洗2 次,用镊子取下滤膜置于载玻片上,于倒置显微镜下随机选取5 个视野,观察并计数迁移细胞数目。
1.2.4 毛细血管管腔形成实验将基质胶Matrigel(100 μL/ 孔)加入48 孔培养板实验孔,37 ℃培养箱 内 温 育30 min 凝 固 后,每 孔 加 入1 × 105个IMECs 细胞,细胞中分别加入活化血小板及PI3K/mTOR 抑制剂BEZ235,共孵育12 h,对毛细血管管腔形成使用倒置显微镜观察和拍照,并以Image J软件对管腔形成长度进行定量分析。每组设三个复孔,每孔选5 个视野,实验重复3 次。
1.2.5 Western blot 法检测IMECs 细胞内PI3K/AKT/mTOR 信号通路蛋白表达刺激细胞作用结束时,加苯甲基磺酰氟(PMSF)+放射免疫沉淀试验(RIPA)细胞裂解液,4 ℃,12 000 r/min 离心10 min,上清液中的蛋白浓度以二喹啉甲酸(BCA)法测定。取等量蛋白与5×上样缓冲液混合煮沸5 min 后上样进行十二烷基硫酸钠⁃聚丙烯酰胺(SDS⁃PAGE)凝胶电泳。电泳后电转移至聚偏二氟乙烯(PVDF)膜,用含5%脱脂奶粉和TBST 缓冲液(20 mmol/L Tris HCl,150 mmol/L NaCl 和0.05%Tween 20)封闭1 h,加入一抗E⁃cadherin(1∶5 000)定影。同法测定各组细胞中α⁃SMA、CollagenI 蛋白含量。
1.2.6 RT⁃PCR 法检测IMECs 纤维化相关基因mRNA 水平的影响(1)提取细胞总RNA;(2)反转录反应:42 ℃15 min(反转录反应),95 ℃2 min(反转录酶的失活反应);(3)PCR 反应:预变性:95 ℃10 s;PCR反应:变性95 ℃5 s,退火/延伸60 ℃,30 s,共40 个循环。每个样本均做GAPDH 管作为内标。各样品的目的基因和管家基因分别进行RT⁃ PCR 反应。以标准品梯度的测量结果绘制标准曲线,以计算各样品所测基因含量,各样品目的基因的含量除以其管家基因的含量,即得到样品校正后的基因相对含量。E⁃cadherin 引物序列:上游5′⁃GCCAATCCTGATGAAATTGGAA⁃3′,下游5′⁃CAGAACCACTGCCCTCGTAATC⁃3′;α⁃SMA 引物序列:上游5′⁃ATAACATCAAGCCCAAATCTGC⁃3′,下游5′⁃TTCCTTTTTTCTTTCCCAACA⁃3′;colllagenⅠ引物序列:上游5′⁃TACAGCACGCTTGTGGATG⁃3′,下游5′⁃TTGGGATGGAGGGAGTTTA⁃3′;GAPDH 引物序列:上游5′⁃GAAGGTGAAGGTCGGAGTC⁃3′,下游5′⁃GAAGATGGTGATGGGATTTC⁃3′。
1.3 统计学方法应用SPSS 17.0 统计软件处理数据。各实验独立重复≥3 次,计量资料以()表示,两组间比较采用配对t⁃test,多组间比较采用Oneway⁃ANOVA。P<0.05 为差异有统计学意义。
2 结果
2.1 IMECs 鉴定经倒置显微镜形态学特征鉴定95%以上为内皮细胞特征,呈短梭形和多角形;免疫组织化学染色CD31 蛋白抗原阳性(图1)。

图1 IMECs 内皮细胞鉴定CD31 蛋白抗原检测(×400)Fig.1 CD31 protein antigen detection for IMECs endothelial cell identification(×400)
2.2 流式法检测静息及活化的血小板P⁃selectin抗体浓度加入终浓度为25 μmol/L 的血小板激动剂二磷酸腺苷(adenosine diphosphate,ADP)到上述血小板中[6],温箱中放置20 min 即为活化血小板。为了检测血小板活化程度,以流式法分别检测上述静息及活化的血小板P⁃selectin 抗体浓度。血小板活化采用P⁃selectin 活化指标检测其含量[模型组:ADP 诱导(25 μmol/L)],结果显示,加入ADP 后P⁃selectin 抗体浓度明显增高(P<0.01),表明活化血小板数量明显增加(图2)。

图2 流式法检测静息及活化的血小板P⁃selectin抗体浓度Fig.2 Flow cytometry for detection of resting and activated platelet P⁃Selectin antibody concentrations
2.3 PI3K/mTOR 抑制剂BEZ235 对血小板活化诱导的IMECs 细胞迁移能力的影响Platelets 诱导组细胞迁移数明显增加,而抑制剂处理组能显著抑制platelets 诱导所致的细胞迁移的增加(P<0.01,图3)。
2.4 PI3K/mTOR 抑制剂BEZ235 对血小板活化诱导的IMECs 细胞管腔形成的影响Platelets 诱导组细胞小管形成能力明显增强,而抑制剂处理组能显著抑制platelets 诱导所致的管腔形成(P<0.01,图4)。
2.5 PI3K/mTOR 抑制剂BEZ235对血小板活化诱导的IMECs通路蛋白磷酸化及HIF⁃1α的影响应用PI3K 抑制剂BEZ 处理后,再用活化的血小板上清诱导,PI3K/AKT/mTOR 蛋白无明显变化(P<0.05),而相关蛋白磷酸化水平明显受到抑制,HIF⁃1α受抑制(P<0.01,图5)。
2.6 PI3K/mTOR 抑制剂BEZ235 对血小板活化诱导的IMECs 细胞的EMT 影响抑制剂BEZ235处理后,纤维化相关蛋白α⁃SMA、Collagen I 明显受到抑制(P<0.01),而E⁃cadherin 表达上调(P<0.01,图6)。

图3 PI3K/mTOR 抑制剂BEZ235 对血小板诱导的IMECs 细胞迁移能力的影响(结晶紫染色×200)Fig.3 Effects of PI3K/mTOR inhibitor BEZ235 on platelet⁃induced IMECs cell migration(crystal violet staining× 200)

图4 PI3K/mTOR 抑制剂BEZ235 对血小板诱导的IMECs 细胞管腔形成的影响(×200)Fig.4 Effects of PI3K/mTOR inhibitor BEZ235 on platelet induced lumen formation of IMECs cells(×200)
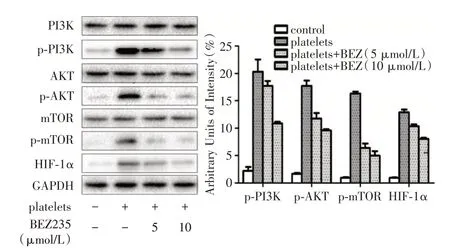
图5 加入BEZ235 后对通路蛋白磷酸化及HIF⁃1α的影响Fig.5 Effects of BEZ235 on phosphorylation of pathway proteins and HIF⁃1α
2.7 PI3K/mTOR 抑制剂BEZ235 对血小板活化诱导的IMECs 细胞EMT 相关基因表达的影响BEZ235 处理后,加入platelets 诱导,RT⁃PCR 检测纤维化指标,结果如图7 所示:platelets 诱导组纤维化相关基因(α⁃SMA,collagenⅠ)表达增加,而抑制剂处理组能显著抑制platelets 诱导所致的纤维化基因表达的增加。同时E⁃cadherin 基因表达相反,模型组显著降低,抑制剂处理后明显增加。
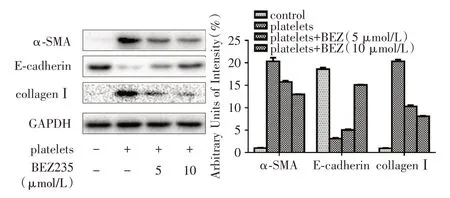
图6 加入BEZ235 后对细胞EMT 相关蛋白的影响Fig.6 Effects of BEZ235 on EMT⁃related proteins in cells
3 讨论
在本研究中,通过IMECs 细胞实验,在CD 细胞模型中研究了IMECs 细胞的EMT 机制。正常人体内血小板功能处于静息状态,而CD 患者肠道黏膜活检可见毛细血管内血小板的聚集,CD 患者活动期时肠道免疫紊乱引起白细胞在局部肠粘膜组织的聚集,肠道局部及血浆中不同炎性因子的改变,通过破坏内皮屏障功能,增加局部血管通透性,肠道微血管内皮细胞的受到损伤,基底膜胶原蛋白暴露,刺激了血小板生成及活化,血小板在受损血管的聚集、粘附,使肠道微血管栓塞,导致缺血性损伤坏死;同时体内血小板的聚集性增加,血液中纤维蛋白增多,粘滞性增高,患者体内呈现高凝状态,微血栓形成,继而肠道血流灌注量减少,肠黏膜细胞因缺血缺氧而变性,引起黏膜组织损伤,引发或加重炎症、溃疡、血管新生、纤维化修复等多种病理过程[7]。有研究表明,在炎症性肠病发病过程中,血小板增多和活化能参与炎症的起始过程,进一步激活血管生成,与血栓、纤维化等形成相关[8]。血小板活化与CD 的肠纤维化联系密切在临床已经得到证实,但其中现代医学机理的阐明,尚待研究。

图7 加入BEZ235 后对细胞EMT 相关基因表达的影响Fig.7 Effects of BEZ235 on the expression of EMT⁃related genes in cells
随着血小板和血管生成研究的不断深入,血小板在血管生成过程中的作用也逐渐得到了肯定。PINEDO 等[9]首先提出了血小板参与血管生成的证据,认为血小板的活化与血管生成关系密切。在微血管生成的过程中,血小板可以释放多种血管形成促进因子如VEGF、血小板衍生生长因子(platelet⁃derived growth factor,PDGF)等(最主要是VEGF),经旁分泌作用于内皮细胞,从而启动并促进血管生成过程,在血管生成早期阶段的内皮细胞形态学改变中发挥关键作用[10];在体外实验中,血小板能够促进内皮细胞的迁移和血管的管腔形成[11]。VEGF 受体中的VEGFR⁃2 直接参与血管生成,介导内皮细胞的生长和渗透;VEGF 家族中的VEGF⁃A 与VEGFR⁃2 结合是控制血管生成的关键途径[12]。二者结合引起受体二聚化,从而激活下游包括PI3K/AKT/mTOR 在内的信号转导通路,共同支持内皮细胞的生存和刺激其增殖,从而促进血管生成,是VEGF 引起内皮细胞血管生成的主要信号通路[13]。PI3K/AKT 信号通路广泛参与细胞生理活动,在维持细胞的正常生理功能,如细胞生长、分化、代谢等方面起着关键作用;mTOR 是丝氨酸/苏氨酸蛋白激酶,是调控细胞生长与增殖的关键通路,对细胞凋亡、基因转录、蛋白质翻译、代谢、血管新生以及细胞周期等进行调控;前期血小板相关实验亦证实血小板活化释放多种促血管生成因子作用于人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)发生血管生成[14]。目前,血小板活化对肠纤维化作用的机制尚不明确,而病理性血管生成为阐明该机理提供了一个新的视角,对以病理性血管生成及血小板活化为靶标的抗肠纤维化治疗的探索至关重要。
纤维化的病理过程包括炎症、缺氧、细胞外基质沉积等复杂过程[15]。研究显示:CD 肠道病变的早期炎症是纤维化过程的一个关键触发因素,细胞外基质(extracellular matrix,ECM)沉积为纤维化进程的特征。EMT 在启动和维持肠纤维化中有重要作用[16],EMT 作为生物体内的一种生理病理现象,除了参与胚胎形成、发育及新生血管形成外,也参与体内纤维化紊乱等过程。因此,对肠血管内皮细胞的EMT 机制研究,也是研究肠纤维化的重要方向。在EMT 过程中,内皮细胞不仅表型发生明显变化,相关标记物也同样发生了变化:内皮细胞标志物,如E⁃cadherin 表达量下降;间质细胞标记物,如α⁃SMA 等表达上调。此外,内皮细胞的迁移和增殖能力明显增强。
过度和异常的血管生成作为组织异常修复的中心环节越来越多地引起关注。缺氧是导致血管生成的最主要刺激因素,能够诱导细胞表达核心转录因子HIF⁃lα。几乎所有的促血管生成因子的表达都是由HIF⁃lα的转录活性改变而受到调控,如VEGF、PDGF 等,这些因子参与的信号转导途径能够影响内皮细胞相关基因的表达从而调控血管生成过程[17];而缺氧亦为导致器官纤维化的机制之一,HIF⁃lα诱导的EMT 通过一定的途径调控器官纤维化的形成和发展[18],如HIF⁃lα能够通过Snail 和β⁃catenin 信号通路调控endoEMT 从而干预早期肺纤维化的进程[19]。PI3K/AKT/mTOR 信号通路,被认为是HIF⁃lα主要的上游调节通路之一[20],而从上文可以看出其亦为VEGF 介导内皮细胞血管生成的主要通路。HIF⁃lα为从血管生成到纤维化进程中的关键枢纽性因子,而PI3K/AKT/mTOR通路为从血小板活化到血管生成最终形成纤维化这一进程中的关键信号通路。
最近的研究发现血管生成与纤维化密切相关[21-23]。VEGF 的高表达在血管生成发展中起着关键作用[24-26]。在本研究中,发现足量的活化的血小板可以刺激IMECs 的血管生成。此外,本研究还初步阐释了相关的作用机制和信号通路。本研究评价了VEGF 的相对蛋白表达,发现VEGFR组间差异无统计学意义,提示VEGF 与VEGFR 表达无相关性。
本研究结果显示加入PI3K/mTOR 抑制剂BEZ235前后比较,活化的血小板刺激增强了IMECs的细胞迁移能力、管腔形成的能力,对PI3K、AKT、mTOR 磷酸化蛋白及HIF⁃1α蛋白起到抑制作用,纤维化相关因子α⁃SMA、Collagen I 的蛋白生成及基因表达明显受到抑制,而E⁃cadherin 蛋白生成及基因表达则上调。表明活化血小板诱导的IMECs细胞的EMT 是通过PI3K/AKT/mTOR 信号通路影响血管生成实现的。
