系统性红斑狼疮合并强直性脊柱炎1例
2021-04-06蒋慧慧王晶吴斌
蒋慧慧 王晶 吴斌
[摘要] 系统性红斑狼疮和强直性脊柱炎均为自身免疫性疾病,但存在于同一患者的案例不多见。本文通过回顾1例系统性红斑狼疮合并强直性脊柱炎的病例,分析两者共通的发病机制,结果表明Thl、Th2细胞及其分泌的细胞因子和干扰素诱导蛋白10在两者的发病过程中均起到了推动作用。同时结合本案例提示临床医师,在疾病诊断过程中除“一元论”外,也需考虑两种乃至多种疾病合并的情况,避免漏诊;并提出更具个体化的治疗方案,以期为今后的临床诊疗提供参考。
[关键词] 系统性红斑狼疮;强直性脊柱炎;发病机制;自身免疫性疾病
[中图分类号] R593.241 [文献标识码] C [文章编号] 1673-9701(2021)04-0135-03
系统性红斑狼疮(Systemic lupus erythematosus,SLE)是一种以多脏器、多系统损害体内,有多种自身抗体为特征的自身免疫性结缔组织病,该病多见于18~40岁育龄期女性,男女发病率约为1∶9[1],以颜面部蝶形红斑为特征性表现。强直性脊柱炎(Ankylosing spondylitis,AS)是一种主要侵犯骶髂关节、脊柱骨突、脊柱旁软组织及外周关节的全身性、慢性炎症性疾病,严重者可发生脊柱畸形和强直。AS好发于15~35岁男性,在国内总体患病率约为0.29%,且还在逐步增加,男性患病率是女性的2.8倍[2]。虽然两者发病机制均与遗传和自身免疫等因素相关,但共存于同一患者的情况不多见,相关国内外文献报道也仅有十数篇。现将重庆市中医院风湿病科收治的1例SLE合并AS病例报道如下。
1 病例资料
患者,女,37岁,2019年10月16日因“面部红斑2年,腰骶部疼痛1年,加重1周”收入重庆市中医院风湿病科。患者于2年前无明显诱因出现面部红斑,伴乏力,当时就诊于第三军医大学大坪医院,完善相关检查提示补体下降(C3:0.35 g/L、C4:0.04 g/L)、抗双链DNA抗体(++)、抗Sm抗体(+),诊断为“系统性红斑狼疮”,予糖皮质激素等治疗后患者面部红斑、乏力好转。出院后患者长期服用“醋酸泼尼松片(5 mg,1次/3天)、甲氨蝶呤(10 mg,1次/周)、沙利度胺(100 mg,1次/d)”至今,面部红斑控制可。1年前,患者因“腰骶部和颈部疼痛”于重庆市中医院骨伤科住院治疗,诊断为“①颈推病;②系统性红斑狼疮;③强直性脊柱炎,待排”,予以中成药及物理治疗后症状好转出院。此后患者腰骶部疼痛间断发作,未予重视,未规范诊治。2019年10月9日患者无明显诱因出现腰骶部疼痛加重,晨起明显,活动后减轻,伴乏力,左髋部疼痛,无下肢放射痛、牵引痛。既往无传染病史、手术史、输血史及过敏史,无家族遗传病史。停经半年。专科查体:颜面部无明显红斑,无口腔溃疡、龋齿、狼疮发。脊柱轻度侧弯,腰椎3/4、4/5棘突、骶部、右髋部及周围组织压痛,双侧直腿抬高试驗、“4”字试验、枕墙距试验、指地距试验均为阴性,脊柱及四肢关节活动度正常。
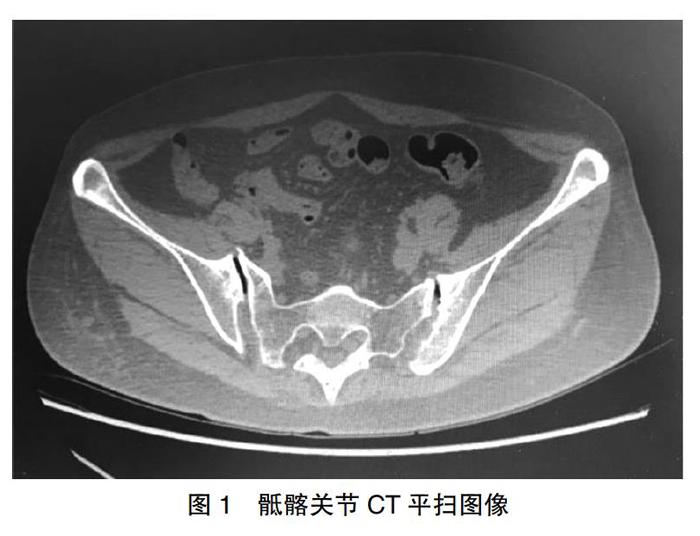
辅助检查:血常规:白细胞:3.35×109/L,淋巴细胞比率:19.8%,单核细胞比率:10.7%,淋巴细胞数:0.66×109/L。抗核抗体1:320(+),抗核抗体谱:天然SSA(++),重组SSA(++),抗组蛋白抗体(+)。抗双链DNA抗体(-),抗Sm抗体(-),人类白细胞抗原B27(-),类风湿因子:5 U/mL,补体C3:0.96 g/L,补体C4:0.24 g/L,C反应蛋白:7.82 mg/L,红细胞沉降率:13 mm/h。脊柱+骨盆正侧位片:①颈椎退行性变;②双髋关节退行性变;③双侧骶髂关节致密性骨炎待除外。双髋部+骶髂关节CT平扫:①骶髂关节改变,强直性脊柱炎待排?②双髋关节未见明确骨质破坏征象。骶髂关节MRI:①双侧骶髂关节征象,考虑炎症病变,强直性脊柱炎待除外;②腰背部软组织肿胀。
诊疗:患者现腰骶部疼痛明显,晨起加重,活动后减轻,疼痛时间超过3个月,影像学有典型骶髂关节改变,强直性脊柱炎诊断可成立。既往系统性红斑狼疮诊断明确,补体C3、补体C4、抗双链DNA抗体、C反应蛋白、红细胞沉降率均正常,表明系统性红斑狼疮病情控制尚可,目前腰骶部疼痛明显考虑由强直性脊柱炎活动导致。月经半年未至,考虑药物引起可能性大,故停用醋酸泼尼松片,调整治疗方案为硫酸羟氯喹片(0.2 g,2次/d)、甲氨蝶呤片(7.5 mg,1次/周)抑制免疫,洛索洛芬钠片(60 mg,3次/d)抗炎镇痛,尪痹片(2 g,3次/d)通络止痛。经7 d治疗后患者症状缓解出院,出院后规律服药。2020年4月15日随访诉腰骶部和左髋部疼痛已明显缓解,复查补体C3、补体C4、红细胞沉降率、C反应蛋白、肝肾功能、血尿常规,结果均正常。
2 讨论
SLE以产生大量自身抗体为特征,这些自身抗体与自身抗原相结合,损伤细胞,从而引起全身多个系统损伤[3]。而AS多以中轴关节病变为主,其特征性改变是附着端炎,即附着骨的肌腱、韧带、关节囊等炎症,发生在骶髂关节、椎间盘的纤维环、椎体周围韧带、跟腱等处,较少累及多脏器、多系统。同时与AS相比,SLE累及关节时也可出现骶髂关节炎,但不会引起骶髂关节的侵蚀性改变[4]。回顾本例患者病史,依据2009年美国风湿病学会SLE分类标准,符合面部红斑、补体C3、补体C4下降、抗Sm抗体(+)、抗双链DNA抗体(++)4项,可诊断为SLE。参考1984年修订的纽约AS标准,患者腰骶部疼痛持续3个月以上,晨起明显,活动后减轻,同时骶髂关节CT符合诊断指标(图1)。因此SLE合并AS诊断可成立。
结合近年来文献报道,SLE与AS能共存于同一患者的原因可能与两者的发病机制密切相关。SLE在多种致病因子的作用下,T淋巴细胞与B淋巴细胞协调失衡,致多克隆B淋巴细胞活化产生多种自身抗体,自身耐受和自我识别功能紊乱,造成自身组织损伤。B淋巴细胞具有释放细胞因子、呈递抗原和产生自身抗体的作用[5],但B淋巴细胞的活化有赖于T淋巴细胞的调节。调节性T细胞通过抑制树突状细胞活化和向Thl、Th2细胞的增殖,达到调节免疫应答的作用,参与SLE的发病过程。Thl细胞介导细胞免疫,主要分泌IFN-γ、TNF-α及IL-12,Th2细胞介导体液免疫,主要分泌IL-4、IL-5、IL-6及IL-10。IL-6和IL-10是B淋巴细胞最有力的激活剂,可激活B淋巴细胞产生大量自身抗体,同时IFN-γ通过显著上调单核细胞人类主要组织相容性复合体Ⅰ、Ⅱ类分子等免疫分子的表达,参与和介导免疫反应,从而促进SLE的发病[6]。人类白细胞抗原B27是人类主要组织相容性复合体Ⅰ类分子,主要作用是向T淋巴细胞提呈内源性抗原。虽然人类白细胞抗原B27是最早发现的与AS相关的风险因素,在AS的发病因素中占主导地位[7],但Thl、Th2细胞间的动态平衡和分泌的细胞因子在AS的发病中也起到了重要作用[8]。有研究[9]使用流式细胞术分析了42例AS患者和42例健康患者外周血T细胞亚群的比例,发现AS患者外周血Th细胞亚群存在失衡,以Thl细胞表达显著升高为特点,同时IL-6、IL-21水平均升高。
除Thl、Th2细胞及其分泌的细胞因子外,干扰素诱导蛋白10(IP-10)也在SLE和AS的发病中起到了推动作用。IP-10属CXC趋化因子家族,具有吸引中性粒细胞、促进多种细胞释放炎症因子的作用,在T淋巴细胞向炎症部位的迁移过程中发挥着重要作用。IP-10可通过细胞表面受体诱导单核细胞和T淋巴细胞的迁移和活化,介导Thl型炎症反应而参与SLE的发病[6,8]。已有研究证明,在SLE和AS患者的血清中IP-10水平均升高。汪佳远等[10]通过ELISA检测SLE患者和健康对照者外周血血清中IP-10和IFN-α水平,结果显示,IP-10在SLE患者血清中的水平明显高于健康对照者,同时发现SLE患者血清中IP-10水平与SLEDAI评分呈明显正相关,提示SLE患者中B淋巴细胞在IFN-α作用下直接活化产生抗体的同时,也可通过分泌IP-10参与病理性炎症反应。黄金星等[11]选取92例AS患者(其中稳定期42例、活动期50例)及100例健康对照者,采用RT-PCR检测两组外周血单个核细胞中IP-10、IFN-γ和IL-4 mRNA的表达水平,结果显示,AS患者外周血单个核细胞中IP-10、IFN-γ和IL-4 mRNA的表达水平均明显升高,且与病情程度有一定关系。
SLE和AS均为自身免疫性疾病,两者的治疗药物大体相似,又各有侧重。对SLE而言,糖皮质激素是首选药物,但使用激素类药物需尽量个体化,若患者出现重要器官受累可加大激素使用剂量[12]。免疫抑制剂以羟氯喹为基础药物,目前已有大量国内外文献报道,羟氯喹在控制SLE病情、预防病情活动的同时对患者的血糖、血脂、心功能等有一定的正效应[13]。AS的药物治疗以免疫抑制剂和生物制剂为主,免疫抑制剂以柳氮磺吡啶、沙利度胺[14]、甲氨蝶呤为一线治疗药物,两种或三种免疫抑制剂联合使用效果更佳[15-16]。目前国内可用于治疗AS的生物制剂主要有注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白(益赛普)、强克、英夫利昔单抗和阿达木单抗,其中益赛普是目前国内应用最广泛的肿瘤坏死抑制剂之一[17],对于年龄较小、C反应蛋白水平较高、MRI见骨髓水肿及未使用过TNF拮抗剂的活动期患者,尤其是伴双髋关节受累、眼葡萄膜炎者,应首选生物制剂治疗。本例患者在入院前长期服用醋酸泼尼松片、甲氨蝶呤和沙利度胺,治疗方案以侧重SLE为主。入院后完善检查提示SLE病情趋向平稳,且已出现明显的激素副作用,故调整后的治疗方案在兼顾SLE的同时更侧重于AS。通过本案例也提醒了在疾病诊断过程中不应只注重“一元论”,也需考虑两种乃至多种疾病合并的情况,避免漏诊;同时在治疗两种疾病共存的患者过程中,更需注重个体化的治疗方案。
[参考文献]
[1] 谢长好,李志军.系统性红斑狼疮的诊断与治疗[J].中华全科医学,2020,18(4):527-528.
[2] Jin lZ,Chu YH,He TH,et al.Prevalence of ankylosing spondylitis in a Chinese population:A systematic review and meta-analysis[J].Rheumatology International:Clinical and Experimental Investigations,2020,40(3):14.
[3] 卢红娟,吴歆,周凌,等.强直性脊柱炎合并系统性红斑狼疮病例报告1例[J].诊断学理论与实践践,2018,17(3):341-343.
[4] 李秋月,肖俊,鄢艷.强直性脊柱炎合并系统性红斑狼疮1例[J].广东医学,2011,32(2):259.
[5] 朱青青,吴冰冰,张莉莉,等.B细胞在系统性红斑狼疮发病机制中的作用[J].齐齐哈尔医学院学报,2019,40(3):351-354.
[6] 常晓萍,陈宏.系统性红斑狼疮发病机制研究进展[C].中国中西医结合学会,第五届全国中西医结合变态反应学术会议论文集,2011:189-192.
[7] 丁繁荣,姜萍,刘巍.强直性脊柱炎发病机制的研究进展[J].山东医药,2019,59(17):102-105.
[8] 陈俊岚,周时高.强直性脊柱炎相关细胞因子的研究进展[J].江西中医药,2019,50(7):64-68.
[9] 朱元悦,张玲,孙柔,等.强直性脊柱炎患者外周血T细胞亚群及相关免疫分子的变化[J].现代免疫学,2017, 37(1):14-19.
[10] 汪佳远,李玉梅,刘帅,等.SLE中IP-10的表达特征及其影响因素[J].现代免疫学,2020,40(2):100-106.
[11] 黄金星,唐光辉,文波,等.强直性脊柱炎患者PBMC中IP-10、IFN-γ和IL-4mRNA表达水平及意义[J].中南医学科学杂志,2019,47(4):346-349.
[12] 董玉梅.系统性红斑狼疮的诊断标准及治疗研究进展[J].临床医药文献电子杂志,2017,4(44):8711-8712.
[13] 杨荣杰,郭芸.羟氯喹在系统性红斑狼疮治疗中的进展[J].皮肤病与性病,2019,41(5):649-652.
[14] 侯涛.沙利度胺治疗强直性脊柱炎的效果分析[J].河南医学研究,2018,27(4):662-663.
[15] 徐水明.沙利度胺联合甲氨蝶呤治疗强直性脊柱炎的疗效及对血清炎症因子的影响[J].现代诊断与治疗,2019,30(21):3756-3757.
[16] 赵法来,刘士同.柳氮磺吡啶联合沙利度胺治疗强直性脊柱炎的效果[J].河南医学研究,2020,29(9):1648-1649.
[17] 翟功伟,张楷广,高延征,等.益赛普对强直性脊柱炎的疗效[J].河南医学研究,2020,29(9):1559-1561.
(收稿日期:2020-05-06)
