轻度认知障碍患者共情能力和淡漠的变化研究及其与灰质萎缩的相关性分析
2021-04-06吴旱淋汤其强
吴旱淋 汤其强


[摘要] 目的 研究輕度认知障碍患者共情能力与淡漠症状的变化,探索两者的联系及与脑灰质体积的相关性。 方法 纳入2019年7月至2020年7月诊断为MCI的病例22例,选择同时期性别、年龄、教育程度无差异的对照组21例,所有受试者完成神经心理学测评,包括MMSE、MoCA、SDS、IRI(包括PT、FS、EC、PD四个子项目)、BES(包括认知移情和情感移情)和AES-I评分,同时测量磁共振的灰质体积,两组结果进行对比并行相关性分析。 结果 MCI组的MMSE、MoCA评分明显低于对照组(P<0.05);MCI组的共情测量评分中IRI总分及PT、FS评分显著低于对照组;在移情测评中,MCI组BES总分低于对照组(P<0.05),主要是情感移情评分;淡漠评定量表-知情者版(AES-I)的测评中,MCI组的评分显著升高(P<0.05);MCI组的T1加权像VBM测量灰质体积显著小于对照组(P<0.05)。在进一步相关性及回归分析中,Pearson分析结果示共情能力与淡漠无相关性; IRI中的PD评分、淡漠评分与灰质萎缩呈显著负相关(B=-4.098,P=0.032;B=-2.987,P=0.022);而情感移情评分与灰质萎缩呈显著正相关(B=3.623,P=0.013)。 结论 轻度认知障碍患者共情能力减退,情感移情能力较低,出现淡漠等早期精神行为症状,已有一定的灰质萎缩,且灰质萎缩与患者共情能力减低及淡漠的程度有相关性。
[关键词] 轻度认知障碍;共情;淡漠;脑萎缩
[中图分类号] R749.1 [文献标识码] A [文章编号] 1673-9701(2021)04-0001-04
Changes of empathy and apathy in patients with mild cognitive impairment and its correlation with gray matter atrophy
WU Hanlin TANG Qiqiang
Department of Neurology, Provincial Hospital Affiliated to Anhui Medical University, Hefei 230001, China
[Abstract] Objective To study the changes of empathy and apathy symptoms in patients with mild cognitive impairment(MCI), and to explore the relationship between empathy and apathy symptoms and the correlation between empathy and gray matter volume. Methods A total of 22 cases diagnosed as MCI from July 2019 to July 2020 were enrolled in the study. 21 cases with no difference in gender, age and education level in the same period were taken as the control group. All subjects completed neuropsychological assessment, including MMSE, MoCA, SDS, IRI(including PT, FS, EC and PD), BES(including cognitive empathy and emotional empathy) and AES-I scores. At the same time, the gray matter volume of MRI was measured. The results of the two groups were compared and the correlation was analyzed. Results MMSE and MoCA scores in MCI group were significantly lower than those in the control group(P<0.05). The total score of IRI, PT and FS in empathy assessment scale of MCI group were significantly lower than those in the control group(P<0.05). In empathy evaluation, the total score of BES in MCI group was lower than that in the control group(P<0.05), which was mainly emotional empathy score. In apathy evaluation scale-insider version(AES-I), the score of MCI group increased significantly(P<0.05). The gray matter volume measured by VBM on T1 weighted images in MCI group was significantly smaller than that in control group(P<0.05). In the further correlation and regression analysis, Pearson analysis showed that there was no correlation between empathy and apathy. PD score and apathy score in IRI were negatively correlated with gray matter atrophy(B=-4.098, P=0.032; B=-2.987, P=0.022). The emotional empathy score was positively correlated with gray matter atrophy(B=3.623, P=0.013). Conclusion MCI patients have a decreased empathy, a low emotional empathy, early mental and behavioral symptoms such as apathy, and gray matter atrophy to some extent, and gray matter atrophy is related to the degree of decreased empathy and apathy.
[Key words] Mild cognitive impairment; Empathy; Apathy; Brain atrophy
轻度认知功能障碍(Mild cognitive impairment,MCI)是处于正常老化和痴呆之间的一种过渡状态,并有着极高的向痴呆转化的风险,分为遗忘型MCI和非遗忘型MCI。2018年,全世界有5000万人患有痴呆症,到2050年,这一数字可能增加2倍,达到1.52亿人,到2030年全球老年痴呆人数将突破7000万人,届时所消耗的社会成本将超过2万亿美元[1]。据报道,60岁及以上人群中MCI的患病率为4%~19%[2],约22%的受MCI影響的人在诊断MCI后3~10年内会进展为痴呆,而非MCI患者中只有3%发展为痴呆[3]。目前,MCI概念已逐渐扩大,涵盖记忆障碍、注意障碍、执行能力障碍等多个认知领域,同样包括其社会认知功能。关于神经退行性疾病的社会认知研究中,目前大多重心在额颞叶痴呆,对MCI及AD患者的心理理论研究则主要是探讨认知成分方面,关于情感成分研究较少[4-6]。共情是对他人的心理状态的理解能力,更为强调情绪状态,指理解并体验他人的情绪和知觉感受的能力,使我们能与他人分享高兴、悲伤、疼痛等体验,在认知障碍患者的心理理论中研究较多,但是在MCI患者的共情能力研究中仍存在争议。有文献研究发现,AD患者的观点采择(共情量表的子项目)主要与左侧颞顶叶萎缩相关,而广泛的双侧额叶、颞叶、顶叶和枕叶萎缩与行为变异型额颞叶痴呆(Behavioral variant frontotemporal dementia,bvFTD)有关。bvFTD患者移情的降低与左眶额、额下、岛叶皮质和双侧扣带回中部萎缩有关[7]。目前在MCI领域中应用的影像学技术有结构性MRI、功能性MRI和放射核素显像,临床应用较为广泛的是结构MRI和功能MRI。基于体素的形态测量学(Voxel-based morphometry,VBM)是目前国内外新兴的一种脑结构影像分析技术,应用较为广泛,可以定量分析脑结构变化,Sun等[8]研究者曾将此技术应用于探索健康成人睡眠剥夺24 h后脑灰质密度变化。本研究拟结合MCI患者共情和冷漠等方面功能变化,并结合使用VBM技术测量T1加权结构磁共振中的脑灰质体积,探讨MCI的情感心理理论是否存在损害及其与脑灰质萎缩是否相关。
1 资料与方法
1.1一般资料
选取2019年7月至2020年7月本院收治的诊断为MCI的患者22例,男10例,女12例,年龄54~74岁,平均(65.64±6.21)岁,受教育年限9.0(5.0,12.5)年;对照组21例,为同期住院无认知障碍患者,男12例,女9例,年龄50~74岁,平均(62.00±7.06)岁,受教育年限8.0(5.0,11.5)年。两组一般资料比较,年龄、性别及受教育年限等差异均无统计学意义(P>0.05),具有可比性。
纳入标准:MCI组标准采用Peterson 诊断标准[9]:(1)有记忆力下降的主诉,且有知情者(家属、同事等)证实;(2)有记忆损害的客观证据(记忆下降程度低于年龄和文化匹配对照的1.5个标准差以上);(3)日常生活能力基本正常(ADL:日常生活能力评分在正常范围);(4)临床痴呆评分量表评分为0.5分;(5)达不到痴呆诊断标准。对照组纳入标准:(1)无认知障碍主诉;(2)无严重精神心理疾病病史,如抑郁、焦虑、精神疾病等;无严重颅脑躯体疾病、酒精与药物滥用等;无严重听力障碍、视力障碍、阅读障碍、肢体运动障碍不能完成神经心理测评;(3)简易精神状态测试(Mini mental state test,MMSE)、蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)评分为正常,具有正常的视、听力及语言理解表达能力;(4)能配合完成实验任务。排除标准:排除其他病因导致的认知障碍(如中枢神经系统创伤、头颅外伤、癫痫、意识障碍、恶性肿瘤、感染、代谢性疾病等);排除体内有金属物质等原因不能进行磁共振扫描的受试者[10]。所有被试参与前均被告知实验目的,并取得所有被试者及家属的知情同意,同时通过我院医学伦理委员会批准。
1.2 方法
入院后所有受试者均接受全套神经心理学测评,在保证绝对安静无打扰的测评室,由专业测评师协助完成MMSE、MoCA、抑郁自评量表(Self-rating depression scale,SDS)、焦虑自评量表(Self-rating anxiety scale,SAS)、痴呆严重程度评分(Clinical dementia rating,CDR)、听觉词汇学习测验(Auditory vocabulary learning test,AVLT)、人际反应指数(Interpersonal response index,IRI)、基本移情量表(Basic empathy scale,BES)、采用淡漠评定量表-知情者(Apathy evaluation scale of informed person version,AES-I)版本等,测评过程中除标准提示语外无额外提示,患者测评时陪同家属需避开,知情者协助测定时患者本人需回避,保证结果的可信性。同时,所有患者在临床医师陪同下完成3.0T的结构磁共振扫描。
1.3 观察指标
IRI包括28个项目,分为观点采择(Perspective taking,PT)、想象(Fantasy scale,FS)、共情关注(Empathic concern,EC)、个人悲伤(Personal distress,PD)四个子项目评分;BES共20个项目,包括认知移情和情感移情两个分量表[11];情绪淡漠的评定采用AES-I版本[12-13]。对比两组患者的所有评分结果,并寻找共情能力与淡漠之间可能存在的联系。所有患者均完成T1加权像结构磁共振扫描,扫描得到的磁共振结果使用脑结构影像分析技术-基于体素的形态学分析(VBM),包括空间标准化、组织分割、平滑、统计建模等过程,基于感兴趣区(Region of intrest,ROI)测量所有受试者脑灰质体积。
1.4 统计学方法
应用SPSS 20.0统计学软件进行分析,实验结果符合正态分布的计量资料采用均数±标准差表示,不符合正态分布的用中位数(四分位数)表示;组间比较分类变量采用χ2检验,符合正态分布的计量资料使用t检验,不符合正态分布的计量资料用Mann-Whitney U检验;共情能力评分IRI(包括PT、FS、EC、PD)同移情评分(包括情感移情和认知移情)和淡漠评分之间相关性采用Pearson相关分析;两组共情、移情的详细子项目、冷漠评分与灰质体积进行线性回归分析,P<0.05为差异有统计学意义。
2 结果
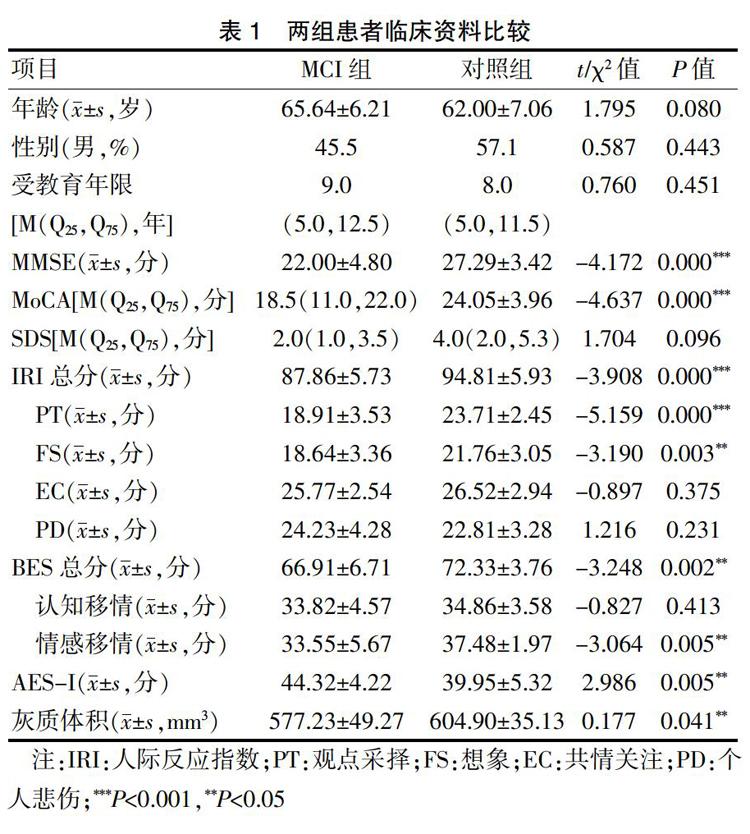
2.1 两组患者临床资料比较
MCI組的MMSE及MoCA评分均明显低于对照组(P<0.05),但两组的SDS评分比较,差异无统计学意义(P>0.05)。MCI组的共情测量评分中IRI总分显著低于对照组,其中子项目PT和FS评分显著降低(P<0.05),BES总分及情感移情评分MCI组低于对照组;AES-I版的测评中,MCI组的评分显著升高(P<0.05);MCI组的脑灰质体积显著低于对照组,萎缩较为明显(P<0.05)。见表1。
2.2 两组患者共情能力与淡漠相关性分析
相关性分析发现,共情能力与淡漠无相关性(P>0.05)。见表2。
2.3两组患者共情、淡漠评分与灰质体积的线性回归分析
线性回归发现,IRI中的PD、AES-I与灰质体积呈显著负相关(B=-4.098,B=-2.987,P<0.05),而情感移情评分与灰质体积呈明显正相关(B=3.623,P<0.05)。见表3。
3 讨论
虽然在AD的早期主要是内侧颞叶的萎缩,包括海马及内嗅皮层,但是随着疾病进展,额叶、顶叶等脑区均会有不同程度的萎缩[14],因此AD患者情感社会认知表现是受损的。本研究发现同样的损害发生在MCI患者中。本研究中MCI组与对照组的灰质体积存在明显差异,MCI患者生理上已经开始出现明显的脑灰质萎缩表现,且这样的萎缩可能对患者的心理理论、精神行为产生影响。
社会认知强调对认知过程的理解包括对他人、自我、人际关系、社会群体、社会角色和规则的认识,目前该领域的研究包括情绪知觉、心理理论和共情、归因和社会知识[15]。共情可以分为情感共情和认知共情,情感共情指个体的情绪感染、情绪识别,在婴儿时期就已出现,主要涉及皮层下脑区,即脑岛、前扣带回以及镜像神经系统(MNS);认知共情指个体对他人情感的理解,涉及的主要脑区为腹内侧前额叶。目前国内外使用较为普遍的共情量表是IRI,其中四个组分中,“PT”属于认知成分,“FS”“EC”和“PD”属于情感成分[16]。相关文献研究中发现MCI患者可能存在共情的受损,并且这种损害可能与情绪识别相关[10]。本研究发现MCI患者的共情能力较对照组明显下降,主要表现在“PT”和“FS”方面,提示在认知共情和情感共情方面,轻度认知障碍可能都存在一定的损害,这可以帮助早期识别认知障碍患者;且灰质萎缩与共情中的PD存在相关,进一步证实情感共情在疾病的早期阶段已经受到影响,且随着灰质萎缩的严重而逐渐加重。另外,述情量表的情感移情评分在MCI中显著低于对照组,同时,情感移情也与灰质萎缩显著相关;既往有研究认为,MCI患者的情感心理理论正常,保留了相关脑区功能及总体认知水平。在本研究中发现,社会认知中的情感认知早在轻度认知障碍阶段就出现了轻度异常,且与灰质体积相关联。
AD是最常见的认知功能障碍疾病,而淡漠被认为是AD最常见的精神行为症状。淡漠指的是对与之无关的外部事物漠不关心或缺乏认识、兴趣、关注及情感的行为。从脑结构和影像学方面来说,部分关于伴淡漠症状的阿尔茨海默病患者脑结构的影像研究表明,伴淡漠症状的AD与特定部位的灰质萎缩有关[17-18]。本研究中,MCI患者的淡漠评分明显高于对照组,提示在AD的早期就出现了精神行为的改变,考虑共情是对他人情绪的识别、感染,既往无研究证实共情与淡漠的关系,本研究结合二者,发现淡漠评分与共情、抑郁无相关性,即淡漠与共情移情能力未发现联系。另外,在淡漠评分和灰质体积改变的线性回归中发现,灰质体积越小,淡漠评分越高,淡漠程度越深。
综上所述,轻度认知障碍患者的共情移情能力减弱,出现淡漠,且观点采择、情感移情和淡漠与患者的脑灰质萎缩相关。本研究存在一定局限性,在今后的课题研究中,本研究小组将对各脑区的灰质体积及厚度进行精准测量,扩大样本量,进一步探索神经退行性病变中各脑区变化,及其对患者社会认知和精神行为症状的影响。
[参考文献]
[1] Patterson C.World Alzheimer report 2018-The state of the art of dementia research:New frontiers[M].London:Alzheimer′s Disease International,2018.
[2] Livingston G,Sommerlad A,Orgeta V,et al.Dementia prevention,intervention,and care[J].Lancet,2017,390:2673-2734.
[3] Mitchell AJ,Shiri-Feshki M.Rate of progression of mild cognitive impairment to dementia-meta-analysis of 41 robust inception cohort studies[J]. Acta Psychiatr Scand,2009,119:252-265.
[4] Poletti M,Borelli P,Bonuccelli U.The neuropsychological correlates of pathological lying: evidence from behavioral variant fronto-temporal dementia[J].J Neurol,2011, 258(11):2009-2013.
[5] Poletti M,Enrici I,Adenzato M.Cognitive and affective Theory of Mind in neurodegenerative diseases: neuropsychological,neuro-anatomical and neurochemical levels[J].Neurosci Biobehav Rev,2012,36(9):2147-2164.
[6] Desmarais Philippe,Lanctt Krista L,Masellis Mario,et al.Social inappropriateness in neurodegenerative disorders[J].Int Psychogeriatr,2018,30:197-207.
[7] Dermody Nadene,Wong Stephanie,Ahmed Rebekah,et al.Uncovering the Neural Bases of Cognitive and Affective Empathy Deficits in Alzheimer′s Disease and the Behavioral-Variant of Frontotemporal Dementia[J].J Alzh-eimers Dis,2016,53:801-816.
[8] Sun Jinbo,Zhao Rui,Yang Xuejuan,et al.Alteration of Brain Gray Matter Density After 24 h of Sleep Deprivation in Healthy Adults[J].Front Neurosci,2020,14:754.
[9] Petersen RC.Mild cognitive impairment as a diagnostic entity[J].J Intern Med,2004,256(3):183-194.
[10] Hanon Olivier,Vidal Jean-Sébastien,Lehmann Sylvain,et al.Plasma amyloid levels within the Alzheimer′s process and correlations with central biomarkers[J].Alzheimers Dement,2018,14:858-868.
[11] Pernigo Simone,Gambina Giuseppe,Valbusa Valeria,et al.Behavioral and neural correlates of visual emotion discrimination and empathy in mild cognitive impairment[J].Behav Brain Res,2015,294:111-122.
[12] Marin RS,Biedrzycki R,Firihciogullari S.Reliability and Validity of the apathy Evaluation Scale[J].Psychiatry Res,1991(38):143-162.
[13] Sockeel P.The Lille apathy rating scale(LARS),a new instrument for detecting and quantifying apathy:validation in Parkinson′s disease[J].J Neurol Neurosurgery Psychiatry,2006,77(5):579-584.
[14] Naggara O,Oppenheim C,Rieu D,et al.Diffusion tensor imaging in early Alzheimer's disease[J].Psychiatry Res,2006,146(3):243-249.
[15] Beadle Janelle N,de la Vega Christine E.Impact of Aging on Empathy:Review of Psychological and Neural Mechanisms[J].Front Psychiatry,2019,10:331.
[16] Deming Philip,Dargis Monika,Haas Brian W,et al.Psychopathy is associated with fear-specific reductions in neural activity during affective perspective-taking[J].Neuroimage,2020.
[17] Tunnard C,Whitehead D,Hurt C,et al.Apathy and cortical atrophy in Alzheimer′s disease[J].Int J Geriatr Psychiatry,2011,26:741-748.
[18] Richard E,Schmand B,Eikelenboom P,et al.Symptoms of apathy are associated with progression from mild cognitive impairment to Alzheimer′s disease in non-depressed subjects[J].Dement Geriatr Cogn Disord,2012, 33:204-209.
(收稿日期:2020-09-14)
