醋柴胡多糖VBCP-3的结构和抗炎作用研究
2021-04-06黄贤能赵瑞芝胡巧红
黄贤能,万 鹏,赵瑞芝,胡巧红*
(1.广东药科大学 药学院,广东广州 510006;2.广州中医药大学 第二临床医学院,广东广州 510006)
柴胡为伞形科植物柴胡(BupleurumchinenseDC)或狭叶柴胡的干燥根,分别习称为“北柴胡”及“南柴胡”,具有疏散退热、疏肝解郁、升举阳气的功效[1]。现代药理研究表明柴胡具有解热镇痛、保肝、抗病毒、免疫调节、抗溃疡、抗癌等多种药理作用[2-4]。柴胡的主要成分包括皂苷、挥发油以及多糖[5-6]。柴胡多糖具有抗炎、增强免疫功能和抗肿瘤等活性[7-8]。醋炙是柴胡的常见炮制方法,而柴胡醋炙后,柴胡多糖是否具有抗炎活性,目前鲜有报道。本研究通过脱脂、水提醇沉、脱蛋白和阴离子交换柱层析等方法对醋柴胡多糖进行分离纯化获得精制多糖并用LPS诱导巨噬细胞RAW264.7制备细胞炎症模型,探讨醋柴胡多糖对LPS 诱导的细胞炎症的影响。
1 材料与方法
1.1 材料
1.1.1 药材 醋柴胡(产地为湖北,批号:201706),经广东省中医院陈文良药师鉴定为伞形科植物北柴胡干燥根醋制品,康美药业有限公司。
1.1.2 试剂 乙酸酐(批号:20131102),广州化学试剂厂;盐酸羟胺(批号:H811236),广州菲博生物有限公司;DEAE-FF琼脂糖凝胶(批号:R16F8D29299),上海源叶生物有限公司; Dextran 855K、Dextran 215K、Dextran 130K、Dextran 60K、Dextran 40K、Dextran 18K(批号分别为:230-F、91418、98841、40KA、R4、95F),北京绿百草有限公司;甘露糖(批号:AA0416LA13)、鼠李糖(批号:S29D5G1)、阿拉伯糖标准品(批号:AJ0702FA14)、岩藻糖(批号:A31M7L155555;)、D-无水葡萄糖(批号:Y01D5Y3)、木糖(批号:B02M6W1)、半乳糖标准品(批号:YM0506YA14)均为上海源叶生物科技有限公司,纯度≥99%;地塞米松磷酸钠注射液(DXMS,国药准字12020515),天津金耀集团湖北天药药业股份有限公司;高糖DMEM培养基(批号:20171014),Gibco公司;MTT试剂(批号:DH343-1),广州威佳生物有限公司;二甲基亚砜(CP,批号:201703),广州化学试剂厂;一氧化氮试剂盒(批号:S0021),碧云天生物科技有限公司。
1.1.3 细胞 小鼠腹腔巨噬细胞RAW 264.7,购于上海ATCC细胞库。
1.1.4 主要仪器 气相质谱联用色谱仪(7890A/5975C),美国安捷伦公司;高效液相色谱仪(1260),美国安捷伦公司;傅里叶变换红外光谱仪(Vector 33),德国Bruck公司 ;紫外分光光度计(UV-2900),日本日立公司;酶标仪(VICTOR X5型)PerkinElmer公司;倒置显微镜(CKX41),日本Olympus公司;自动细胞计数仪(ZC-1000),上海睿钰生物科技有限公司。
1.2 方法
1.2.1 醋柴胡多糖的提取纯化
1.2.1.1 醋柴胡总多糖的提取和分离 根据文献工艺进行多糖提取和分离[9]。8 kg醋柴胡药材用700 mL/L乙醇冷浸过夜后,用5倍体积的700 mL/L乙醇加热回流提取4次,过滤。药渣用10倍体积水回流提取3次,过滤,减压浓缩至相当于生药量1 mg/mL,得醋柴胡水提液。醋柴胡水提液中加入乙醇,调节含醇量为80%,于4℃静置过夜。抽滤,收集沉淀,冻干得醋柴胡粗多糖。将醋柴胡粗多糖用Sevage法脱蛋白7次,减压浓缩除去有机溶剂后再次调节含醇量为80%,离心后收集沉淀,冻干得到醋柴胡总多糖。
1.2.1.2 醋柴胡精多糖的制备 称取800 mg醋柴胡总多糖,溶于20 mL纯水。以DEAE琼脂糖凝胶Fast flow离子交换层析柱(26×800 mm)进行分离纯化。分别用水、0.05、0.1、0.2、0.4、1 mol/L的NaCl溶液和0.5 mol/L的氢氧化钠溶液以3 mL/min进行洗脱,每管收集10 mL,以苯酚硫酸法进行隔管检测,作出洗脱曲线,收集0.2 mol/L NaCl溶液洗脱组分,减压浓缩,透析72 h后冻干,得到醋柴胡精多糖,命名为VBCP-3。
1.2.2 醋柴胡多糖VBCP-3的结构分析
1.2.2.1 VBCP-3的紫外光谱扫描 精密称取VBCP-3 5 mg,用超纯水配制为500 mg/L溶液。以超纯水为空白对照,利用紫外分光光度计在190 nm~550 nm范围进行全波长扫描。
1.2.2.2 VBCP-3的纯度与分子量测定 以葡聚糖D18K、D40K、D60K、D130K、D215K、D855K为标准品,分别将不同质量的葡聚糖标准品和VBCP-3配制成 2.0 mg/mL的溶液,过0.22 μm滤膜,以安捷伦高效液相1260检测。色谱柱为TSK G-4000PWXL,进样量为 20 μL,流动相为超纯水,流速为0.5 mL/min,柱温40℃,检测器为示差折光检测器,检测器温度为40℃。记录色谱图和保留时间,用标准品葡聚糖相对分子质量的对数lg(Mw)对保留时间作图,得到葡聚糖相对分子量分布标准曲线及标准方程,通过相对分子量方程计算VBCP-3的分子质量。
1.2.2.3 VBCP-3的红外光谱分析 称取VBCP-3 2 mg,干燥条件下压成薄片,于500 cm-1~4 000 cm-1进行常规IR分析。
1.2.2.4 VBCP-3的单糖组成分析 称取VBCP-3 10 mg,加入2 mol/L的三氟乙酸溶液4 mL,110℃加热6 h,将水解样品于50℃减压浓缩蒸干,加入适量体积甲醇重复减压浓缩,去除残留的三氟乙酸。
取 10 mg VBCP-3水解产物,加入10 mg盐酸羟胺、1 mL吡啶,于 90℃水浴加热30 min,加入乙酸酐1 mL,再于90℃继续水浴加热30 min,反应结束后冷却至室温,过0.22 μm滤膜后进行 GC-MS分析,与标准单糖比对分析单糖组成及比例。
色谱条件:Agilent 7890A-5975C气质联用仪;Agilent HP-5MS毛细管柱(0.25 μm×250 μm,30 m);汽化室温度 250℃,检测器温度 250℃,柱温 150℃;程序升温:150℃(2 min)→200℃(3 min)→250℃(10 min);载气流速:1 mL/min;吹扫:4.0 mL/min。
1.2.3 醋柴胡多糖VBCP-3的抗炎活性
1.2.3.1 RAW 264.7细胞培养 小鼠腹腔巨噬细胞(RAW 264.7)复苏,加入完全培养基离心弃上清之后,再次加入新的完全培养基反复吹打,分别加入到2个培养皿中,每个培养皿再次加入5 mL完全培养基,然后置于37℃、5% CO2环境下培养。
1.2.3.2 VBCP-3对细胞存活率的影响 将细胞RAW264.7接种于96孔板上(200 μL/孔)。置于37℃、5% CO2培养箱中培养24 h后,吸弃上清液,加入200 μL含不同浓度VBCP-3的细胞培养液(VBCP-3浓度分别为500、250、125、62.5、31.3、15.6、7.8、3.9 mg/L)。24 h后取出,用MTT法测定各组的细胞存活率。细胞存活率(%)=给药组平均吸光度/空白对照组平均吸光度×100%
1.2.3.3 VBCP-3对巨噬细胞产生NO的影响 将3×105个/mL RAW264.7细胞加入24孔板(1 mL/孔),培养24 h后,弃去上清,分为空白培养液组、LPS组(1 mg/L LPS)、阳性药物组(1 mg/L LPS+50 mg/L地塞米松)、VBCP-3组(1 mg/L LPS+(7.8~125) mg/L VBCP-3溶液),每组加入对应的供试液(或空白培养液)1 mL。培养24 h后,按照试剂盒说明操作。将1 mol/L NaNO2标准液稀释成0、1.62、3.12、6.25、12.5、25、50、100 μmol/L的NaNO2溶液,然后取50 μL不同浓度的NaNO2稀释液,置于96孔板上,加入50 μL试剂1,再加入50 μL试剂2,放置5 min后,用酶标仪测定540 nm处的吸光度并做出标准曲线。给药样品取上清液50 μL,按照上述方法测定,根据标准曲线计算样品中NO的含量。NO抑制率(%)=(1-给药组NO含量/LPS组NO含量)×100%
1.2.3.4 统计学处理 采用SPSS 21.0软件进行正态性分布检验和方差齐性检验,采用独立样本t检验对各组NO 抑制率进行比较,以P<0.01表示差异具有统计学意义。
2 结果
2.1 醋柴胡多糖VBCP-3的提取与纯化
醋柴胡采用700 mL/L乙醇脱脂,经过热水提取,水提醇沉,Sevage法脱蛋白后,得到醋柴胡总多糖。通过DEAE-FF阴离子交换柱以不同浓度洗脱剂洗脱(图1),获得不同的组分,其中0.2 mol/L NaCl溶液洗脱得到醋柴胡精多糖,命名为VBCP-3。
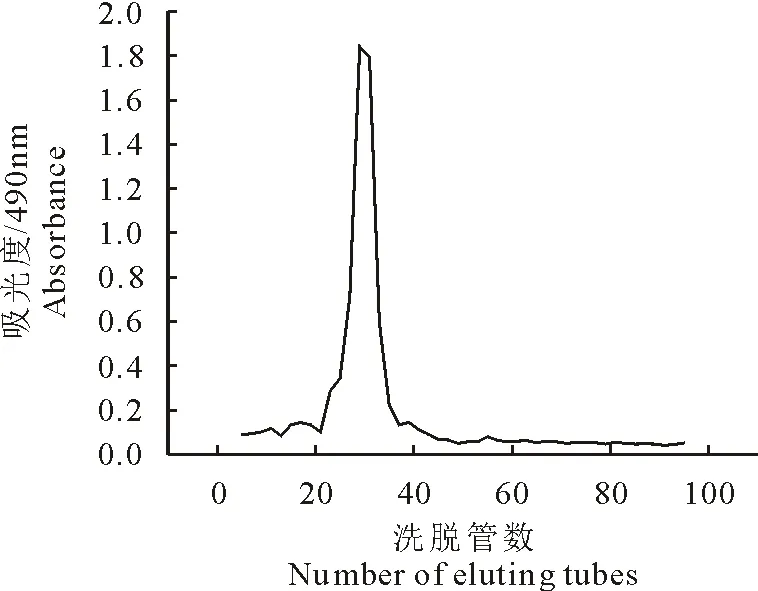
图1VBCP-3的DEAE-FF阴离子交换层析洗脱曲线图
2.2 醋柴胡多糖VBCP-3的结构
通过紫外分光度计全波长扫描可知, VBCP-3在260 nm和280 nm处无明显吸收峰,提示醋柴胡多糖VBCP-3不含核酸和蛋白质。以葡聚糖D18K、D40K、D60K、D215K、D855K为标准品绘制多糖分子量测定的标准曲线,求得线性回归方程为:t=-4.781 1×lg(Mw)+39.42(R2=0.9965)。醋柴胡多糖VBCP-3峰宽较窄,分布均一,其分子质量为436.221 ku(图2)。
VBCP-3的红外图谱(图3)显示其具有多糖的一般结构特征,在3 300.11 cm-1处有宽而钝的吸收,是O-H的伸缩振动峰,2942.8 cm-1处是C-H伸缩振动峰,1 594.30 cm-1处是-CHO的C=O的伸缩振动峰,在1 100 cm-1~1 010 cm-1附近有3个吸收峰,提示VBCP-3为吡喃糖。通过与标准单糖比对,并通过峰面积计算可知,VBCP-3的单糖组成及摩尔比为鼠李糖∶阿拉伯糖∶半乳糖∶葡萄糖=1.3∶24.9∶3.2∶1.00(图4、图5)。
2.3 醋柴胡多糖VBCP-3的抗炎活性
醋柴胡多糖VBCP-3对RAW264.7细胞增殖的影响见图6,VBCP-3在3.9 mg/L~125 mg/L范围内存活率均在80%以上,说明在该范围内VBCP-3对RAW264.7细胞无明显毒性,故可在3.9 mg/L~125 mg/L范围内选取合适浓度进行下一步试验。

图2VBCP-3分子量色谱图
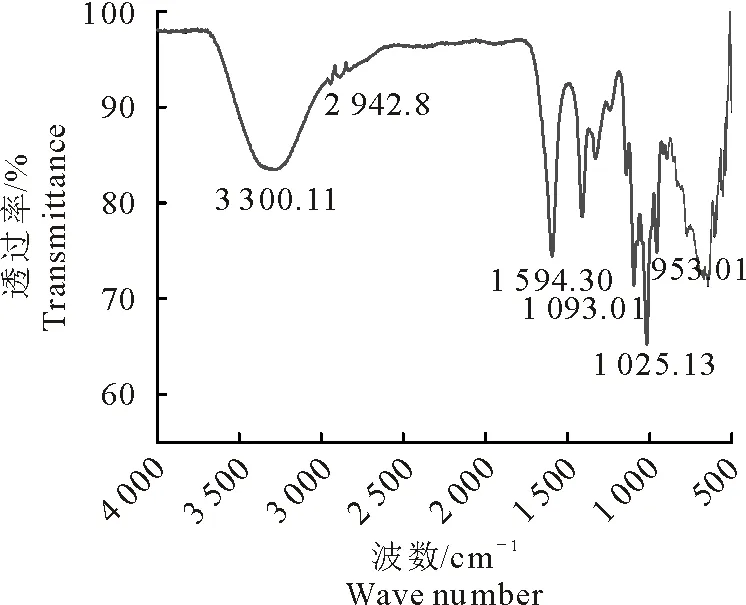
图3VBCP-3的红外光谱图
以LPS诱导RAW 264.7细胞,产生炎症因子,根据Griess法测定NO的释放量,考察待测药物对细胞炎症的影响。NO在0~100 μmol/L范围内的标准曲线为y=0.003 9x+0.040 6(R2=0.999 8)。与正常组相比,经LPS刺激后,细胞产生大量的NO(P<0.01);阳性药物地塞米松显著抑制NO释放(P<0.01),其抑制率为70.07%,说明炎症模型造模成功。与模型组相比,含量7.8 mg/L~125 mg/L的醋柴胡多糖VBCP-3能显著抑制炎症因子NO的释放,其中7.8、31.25、125 mg/L的VBCP-3的NO抑制率分别为44.18%、74.34%和86.53%(P<0.01),抑制效果随VBCP-3浓度增大而增强。与阳性药物地塞米松相比,125 mg/L的VBCP-3多糖具有显著的抗炎作用(P<0.01)(图7)。
3 讨论
柴胡多糖具有抗炎、抗肿瘤、免疫调节等作用,文献报道柴胡醋炙后抗炎作用减弱,疏肝解郁、减肥、降血脂等作用增强,而且能增加与其配伍药物在肝脏的分布[10-11],而醋制后柴胡多糖是否具有抗炎活性,目前少有报道。 本文从醋柴胡中提取、分离得到多糖VBCP-3,并对其结构及活性的进行初步探讨。结果显示得到的VBCP-3为吡喃糖,分子质量为436.221 ku,单糖组成及摩尔比为鼠李糖∶阿拉伯糖∶半乳糖∶葡萄糖=1.3∶24.9∶3.2∶1.00,属于中性杂多糖。VBCP-3的单糖组成和分子质量与文献已知的柴胡多糖均不同[12-13],为新发现的多糖。

图4单糖组成混合标准品色谱图

1.鼠李糖;2.阿拉伯糖;3.葡萄糖;4.半乳糖1.Rhamnose; 2.Arabinose; 3.Glucose; 4.Galactose

图6不同浓度VBCP-3的细胞存活率(n=3)
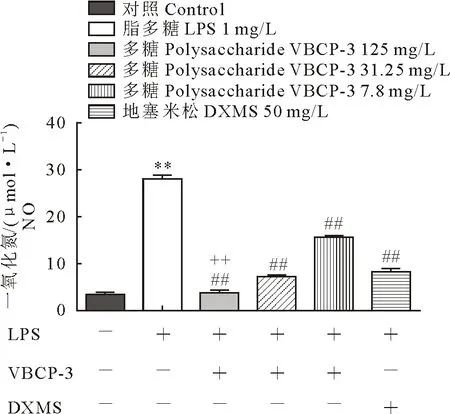
与空白组比较:**P<0.01;与模型组比较:##P<0.01;与阳性药物组比较,++P<0.01;+表示含有该物质,-表示不含该物质
一氧化氮(NO)在心血管、消化、免疫、呼吸等系统的调节中具有广泛的病理生理作用,被普遍认为是细胞内传导信号的第二信使。正常状态下,细胞NO含量很少。LPS为细菌等物质含有的多糖,是常见的致炎因子,当细胞被LPS等物质刺激时,大量的 NO 被诱导表达进而介导炎症等疾病的发生与发展,NO含量可以作为炎症反应程度的指标[14]。小鼠巨噬细胞在受LPS刺激后可以产生NO,柴胡多糖能显著降低LPS诱导的巨噬细胞分泌NO的水平(P<0.01),80 mg/L柴胡多糖溶液的NO抑制率为22.22%[15]。而本研究显示7.8 mg/L~125 mg/L浓度范围的醋柴胡多糖VBCP-3能显著抑制LPS诱导的巨噬细胞分泌NO(P<0.01),其中31.25 mg/L浓度VBCP-3的NO抑制率为74.34%,高于文献。提示VBCP-3对NO的抑制作用大于柴胡多糖,柴胡醋制后多糖仍具抗炎活性。本研究提取分离出分子质量为436.221 ku、均一的醋柴胡精多糖VBCP-3,能够抑制LPS诱导的小鼠巨噬细胞RAW264.7的NO分泌量,表明醋柴胡多糖也具有抗炎活性,有良好的应用潜力,但其抗炎作用的机制有待进一步探讨与论证。
