新城疫病毒感染性克隆全长cDNA转录载体的构建
2021-04-06郭承意仝丽娜李增魁刘海金杨增岐高小龙
郭承意,仝丽娜,周 雷,李增魁,文 英,刘海金,杨增岐*,高小龙*
(1.青海大学农牧学院,青海西宁 810000;2.西北农林科技大学动物医学院,陕西杨凌 712100)
新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)引起的一种烈性传染病,能够在鸡和多种禽类中广泛传播,是威胁养禽业的最主要疫病之一[1]。鸡感染后主要临床特征为呼吸困难、腹泻、神经紊乱以及黏膜和皮肤出血。世界动物卫生组织(OIE)将新城疫列为必须报告的动物传染病,我国将其列为一类动物疫病。NDV为不分节段单股负链RNA病毒,属于副黏病毒科(Paramyxoviridae)、副黏病毒亚科(Paramyxoviridae)、禽腮腺炎病毒属(Aoulavirus)[2]。NDV基因组由15186、15192或15198个核苷酸组成,全基因组上依次排列着NP、P、M、F、HN和L基因,分别编码核衣壳蛋白(NP)、磷蛋白(P)、基质蛋白(M)、融合蛋白(F)、血凝素-神经酪氨酸(HN)和大分子蛋白(L)[3]。
反向遗传技术是研究生物基因与性状关系,通过分子生物学技术在DNA水平对遗传物质进行一系列操作(如突变、缺失、插入、替换等),进而探究基因改变对生物性状的影响。人们已经构建了许多重组病毒,通过对比重组病毒和亲本毒株的差异,阐明了影响病毒毒力、复制能力、抗原位点变异、组织嗜性等许多科学问题[4-6]。NDV重组病毒的研究为后续NDV感染性克隆试验奠定了一定的基础[7]。近年已有多种NDV感染性克隆构建系统,根据全长cDNA转录载体转录时所用启动子不同,可将NDV感染性克隆分为两种,一种是基于T7启动子系统,另一种是巨细胞病毒(cytomegalovirus,CMV)启动子系统[8]。根据全长cDNA克隆的方法不同,又可分为传统酶切连接克隆法、不依赖酶切的克隆法(LIC)和合成克隆法。传统的酶切连接克隆法费时费力,且受酶切位点限制;而LIC主要依靠融合技术,相对酶切连接法效率高。为提高载体通用性及提高全长cDNA克隆效率,本研究拟构建一种NDV全长cDNA克隆双启动子转录载体,为简便快速构建NDV感染性克隆奠定基础。
1 材料与方法
1.1 材料
1.1.1 试剂 T4 DNA连接酶购自宝生物工程(大连)有限公司;SalⅠ、EcoR Ⅴ、BglⅡ、NotⅠ、SacⅠ限制性内切酶购自Thermo Fisher公司;琼脂糖凝胶回收试剂盒、质粒提取试剂盒均购自OMEGA公司;Lipofectamine 2000转染试剂购自Invitrogen公司;Trans 2K Plus DNA Marker,TransStart®Fast Pfu DNA Polymerase购自北京全式金生物技术有限公司;其余试剂均为国产分析纯试剂。
1.1.2 质粒 pCI-neo、pEGFP-N1、pAd-track CMV均为西北农林科技大学杨增岐教授馈赠,由青海大学农牧学院兽医公共卫生实验室保存。
1.1.3 主要仪器设备 梯度PCR仪,Eppendorf公司产品;核酸电泳设备、凝胶图像成像系统,上海天能科技有限公司产品;倒置荧光显微镜,日本尼康公司产品;超净工作台,苏州安泰空气技术有限公司产品;恒温水浴锅、恒温摇床、恒温培养箱,上海精宏实验设备有限公司产品。
1.2 方法
1.2.1 linker序列的设计与合成 参照文献[9-11],设计合成linker基因序列,该序列所含元件分别为“T7P-GGG-HamR-NDV 5′UTR-KpnⅠ-SmaⅠ-NDV 3′UTR-HdvR-T7 termi-SV3-NotⅠ”;设计好的序列由江苏金唯智公司合成,合成的linker序列装载于pUC57载体上。序列详细信息如下:

1.2.2 引物设计 参考pCI-neo、pEGFP-N1、pAd-track CMV载体的序列,分别设计扩增编码GFP和Kan基因的引物,引物由江苏金唯智公司合成(表1)。
1.2.3GFP和Kan基因片段的获得 以pEGFP-N1质粒作为模板,GFP-F和GFP-R为引物,在Pfu DNA聚合酶作用下通过PCR扩增获得GFP基因片段。PCR扩增体系如下:5×trans Pfu buffer 10 μL,2.5 mmol/L dNTP 5 μL,Pfu DNA聚合酶1 μL,上、下游引物各1.5 μL,pEGFP-N1质粒0.2 μL,用无酶ddH2O补足50 μL。反应条件为:95℃ 5 min;95℃ 40 s,57℃ 40 s,72℃ 50 s,35个循环;72℃ 10 min,4℃结束反应。10 g/L琼脂糖凝胶电泳检测PCR产物,预期条带大小1 000 bp,胶回收1 000 bp左右的目的条带,即为GFP基因片段。
以pAd-track CMV质粒为模板。以Kan-F和Kan-R为引物,在Pfu DNA聚合酶作用下通过PCR扩增获得Kan基因片段,加样体系如下:5×trans Pfu buffer 10 μL,2.5 mmol/L dNTP5 μL,Pfu DNA聚合酶1 μL,上、下游引物各1.5 μL,pAd-track CMV质粒 0.2 μL,用无酶ddH2O补足50 μL。反应条件为:95℃ 5 min;95℃ 40 s,62℃ 40 s,72℃ 1 min,35个循环;72℃ 10 min,4℃结束反应。10 g/L琼脂糖凝胶电泳检测PCR产物,预期条带大小2 800 bp,胶回收2 800 bp左右的目的条带,即为Kan基因片段。
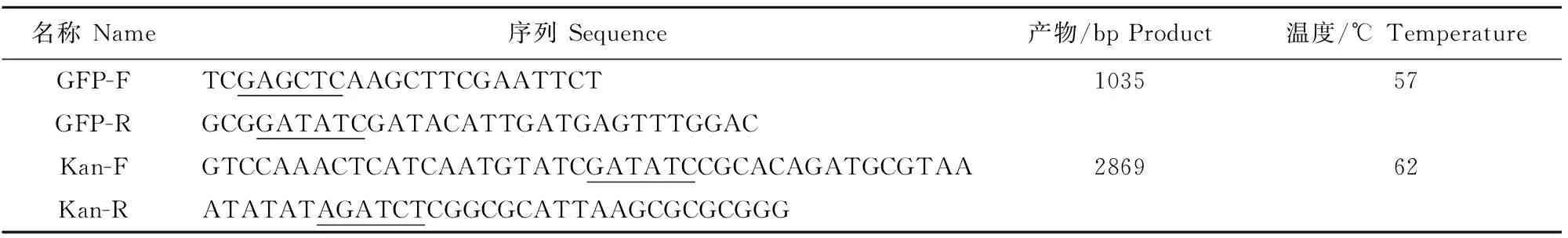
表1引物信息
1.2.4GFP和Kan基因片段的融合 以1.2.3中回收的GFP和Kan基因片段为模板,通过Overlap PCR扩增获得GFP-Kan融合基因片段,PCR加样体系如下:5×trans Pfu buffer 10 μL,2.5 mmol/L dNTP 5 μL,Pfu DNA聚合酶1 μL,引物GPF-F 1.5 μL,引物Kan-R 1.5 μL,回收的GFP基因片段1 μL,回收的Kan基因片段5 μL,用无酶ddH2O补足50 μL。反应条件为:95℃ 5 min;95℃ 40 s,55℃40 s,72℃ 1.5 min ,35个循环;72℃ 10 min,4℃结束反应。10 g/L琼脂糖凝胶电泳检测PCR产物,预期条带大小3 800 bp,胶回收目的条带,即为GFP-Kan融合基因片段。
1.2.5 pCI-GFP/Kan载体构建BglⅡ和SalⅠ双酶切pCI-neo载体和胶回收的GFP-Kan融合基因片段。酶切体系分别如下:①BglⅡ 0.5 μL,SalⅠ 0.5 μL,pCI-neo质粒4 μL,10×bufferO 2 μL,无酶ddH2O补足20 μL;②BglⅡ 0.5 μL,SalⅠ 0.5 μL,GFP-Kan融合片段9 μL,10×bufferO 2 μL,无酶ddH2O补足20 μL。37℃,酶切2 h。酶切产物用10 g/L琼脂糖凝胶电泳检测,回收①中1 000 bp和②中3 800 bp左右的目的条带。
用T4 DNA连接酶连接pCI-neo酶切后1 000 bp条带与GFP-Kan酶切后3 800 bp的条带。连接体系如下:10×T4 ligasebuffer 1 μL,T4 DNA连接酶0.5 μL,pCI-neo酶切产物3 μL,GFP-Kan基因酶切产物1.5 μL,无酶ddH2O补足10 μL。16℃连接过夜。次日将连接产物转化至DH5α感受态细胞中,转化产物涂布卡那抗性LB平板,挑选平板上的阳性克隆做酶切鉴定。
1.2.6 pCI-GFP/Kan载体鉴定 酶切鉴定正确的载体送生工生物工程(上海)股份有限公司测序,测序正确的重组载体命名为pCI-GFP/Kan。为进一步验证构建的pCI-GFP/Kan载体上CMV启动子能否正常工作,取2 μg pCI-GFP/Kan转染BHK21细胞,参照LipofectamineTM2000试剂说明书进行细胞转染。转染36 h后,于荧光倒置显微镜下观察荧光,并设立pEGFP-N1为阳性对照,未转染空细胞为阴性对照。
1.2.7 pCI-infect载体构建 用SacⅠ和NotⅠ双酶切pUC57-Linker和pCI-GFP/Kan,体系为①SacⅠ 0.6 μL,NotⅠ 0.6 μL,10×tango buffer 4 μL,pUC57-Linker 5 μL,无酶ddH2O补足20 μL;②SacⅠ 0.6 μL,NotⅠ 0.6 μL,10×tango buffer 4 μL,pCI-GFP/Kan 4 μL,无酶ddH2O补足20 μL。37℃酶切2 h,酶切产物用10 g/L琼脂糖凝胶电泳检测,回收①中3 800 bp和②中800 bp的目的条带进行连接,连接体系如下:10×T4 ligase buffer 1 μL,T4 DNA连接酶0.5 μL,pCI-GFP/Kan酶切回收产物1 μL,pUC57-Linker酶切回收产物2.5 μL,无酶ddH2O补足10 μL。16℃连接过夜,连接产物转化DH5α感受态细胞,转化产物涂布卡那抗性LB平板,挑选平板上的阳性克隆做酶切和测序鉴定,鉴定正确的重组载体命名为pCI-infect。
2 结果
2.1 GFP和Kan基因片段的扩增结果
以pEGFP-N1质粒为模板,用GFP-F和GFP-R为引物,在Pfu DNA聚合酶作用下通过PCR获得1 000 bp左右的GFP条带(图1)。胶回收1 000 bp的目的条带,即为GFP基因片段。以pAd-track CMV质粒为模板,用Kan-F和Kan-R为引物,在Pfu DNA聚合酶作用下扩增出2 800 bp左右的目的条带(图2)。胶回收此2 800 bp的目的条带,即为Kan基因片段。
2.2 GFP-Kan基因片段的融合扩增
以上步回收的GFP和Kan基因片段为模板,以GFP-F和Kan-R为引物,通过Overlap PCR扩增获得3 800 bp的GFP-Kan融合基因片段,同时在1 000 bp~2 000 bp和大于5 000 bp处有2条非特异性条带(图3)。胶回收3 800 bp目的条带,即为GFP-Kan融合基因片段。
2.3 pCI-EGFP/Kan载体构建与鉴定
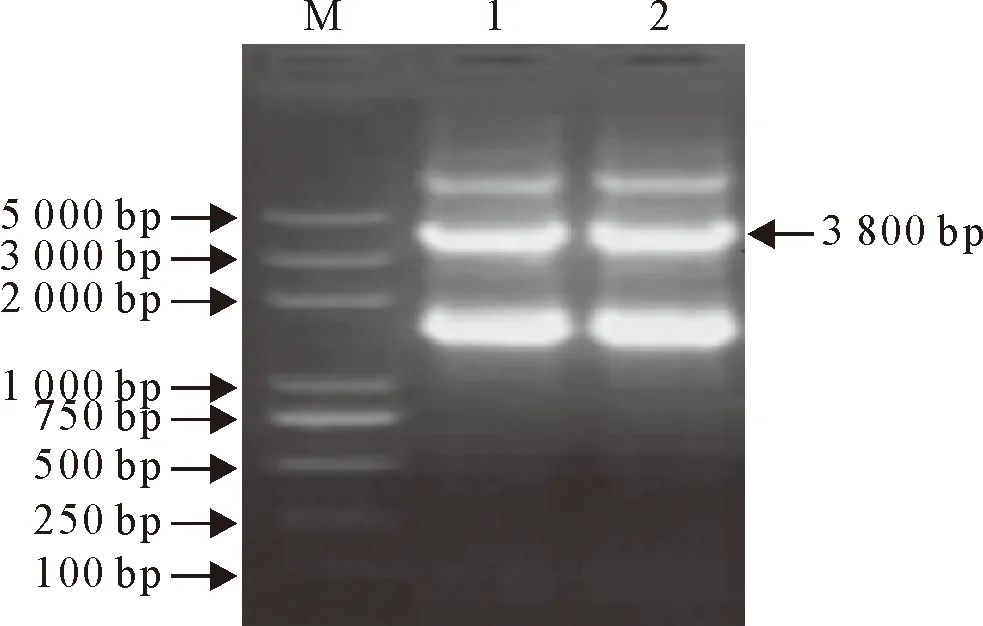
用BglⅡ和SalⅠ限制性内切酶双酶切pCI-neo质粒和GFP-Kan融合片段,切出1 000 bp和3 800 bp的目的条带(图4)。胶回收1 000 bp左右的pCI-neo酶切条带以及3 800 bp左右的GFP-Kan酶切条带,进行连接和转化,转化产物涂布卡那抗性LB平板,挑取平板上长出的阳性克隆,摇菌后抽提质粒。抽提的4个克隆的质粒用EcoRⅤ进行单酶切和测序鉴定,显示序列均正确,重组载体命名为pCI-GFP/Kan。为确定构建的pCI-GFP/Kan载体中CMV启动子可否正常工作,用2 μg pCI-GFP/Kan转染BHK-21细胞后36 h于倒置显荧光微镜下观察(图5),结果表明CMV启动子可以正常工作。

M.DNA标准DL 5 000;1~2.GFP基因片段M.DNA Marker DL 5 000; 1-2.GFP amplified products

M.DNA标准DL 5 000;1~2.Kan基因片段M.DNA Marker DL 5 000; 1-2.Kan amplified products
M.DNA标准DL 5 000;1~2.GFP/Kan基因片段M.DNA Marker DL 5 000; 1-2.GFP/Kan amplified products
M.DNA标准DL 5 000;1~2.pCI-neo载体双酶切;3~4.GFP/Kan基因片段双酶切

A.pCI-GFP/Kan; B.pEGFP-N1; C.Negative control
2.4 pCI-infect载体构建
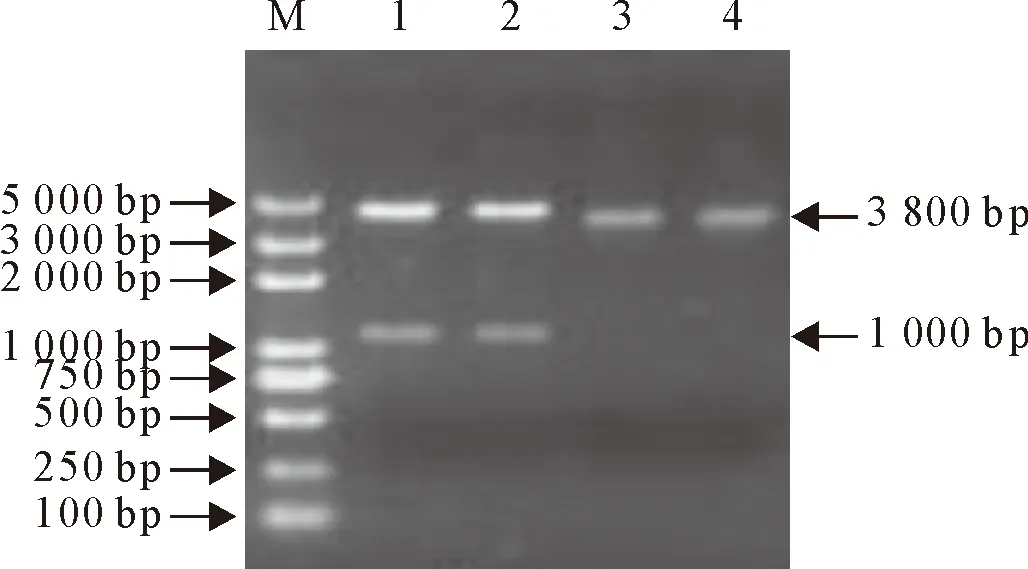
用SacⅠ和NotⅠ双酶切pCI-GFP/Kan和pUC57-linker载体(图6),切出3 800 bp和800 bp的目的条带。胶回收3 800 bp和800 bp的目的条带。将回收的条带用T4 DNA连接酶连接,连接产物转化DH5α感受态细胞,涂布卡那霉素抗性平板,培养后挑取平板上的克隆,摇菌提取质粒后用SacⅠ和NotⅠ进行双酶切鉴定,切出800 bp和3800 bp目的条带(图7)。进行测序后,显示序列均正确,表明pCI-infect构建成功。
M.DNA标准DL 5 000;1~2.pCI-GFP/Kan双酶切;3~4.pUC57-linker双酶切

M.DNA标准DL 5 000;1.pCI-infect双酶切M.DNA Marker DL 5 000; 1.Double enzyme digestion of pCI-infect
3 讨论
本研究为提高载体通用性,采用了双启动子系统,在反义基因组5′端同时设计了CMV和T7启动子,在CMV和T7启动子之间添加了intron,避免相互干扰。同时为了提高T7启动子转录效率,在T7启动子后添加了3个G[11]。转录后的病毒基因组RNA序列5′和3′末端的精确性对病毒拯救至关重要[12],为使病毒cDNA转录时能产生无任何冗余序列的精确5′末端和3′末端,提高拯救效率,在linker设计时在NDV 5′UTR和3′UTR区分别添加了58 bp的锤头状核酶(HamR)序列和89 bp的丙型肝炎病毒核酶(HdvR)序列元件,保证转录出精确的病毒RNA末端序列。
由于真核细胞RNA聚合酶一般位于细胞核中,在构建伯尔纳病毒感染性克隆微基因组时,在微基因组末端添加了衍生于猴病毒40(SV40)的SV3入核信号序列,显著提高了微基因组拯救效率。利用Ⅱ型RNA聚合酶构建感染性克隆时,相比于SV40早期多聚腺苷酸化信号,在HdvR后添加SV40晚期多聚腺苷酸化信号可显著提高cDNA转录效率[13]。本研究为保证后期cDNA获得较高的转录效率,在反义基因组3′末端HdvR序列后添加了SV3元件和SV40晚期多聚腺苷酸化信号。
载体的大小和抗性对全长cDNA克隆构建也有影响,本研究中载体大小由最初的5.4 kb(pCI-neo)变为4.6 kb(pCI-infect),易于后期NDV全基因克隆;为与常用的Amp抗性载体加以区分,避免污染和易于筛选,在构建中将pCI-neo载体上的Amp抗性替换为Kan抗性。但在融合Kan基因片段和GFP基因片段时,除扩增出3 800 bp大小的预期条带外,还出现两条非特异性条带(图3),一条非特异性条带大于5 000 bp,另一条非特异性条带大小为1 000 bp~2 000 bp,经优化退火温度和PCR反应体系,上述两条非特异性条带仍存在,但非特异性条带与3 800 bp的目的条带通过琼脂糖凝胶电泳可加以区分,且经切胶、回收克隆和测序后,显示GFP-Kan基因片段正确。本研究构建了一种NDV全长cDNA克隆双启动子转录载体,为简便快速构建NDV感染性克隆积累了材料。
