双峰驼FCGRT基因的原核表达及多克隆抗体的制备
2021-04-06刘丽萍火兴民张旺东吴秀萍王雯慧
刘丽萍,火兴民,谢 飞,张旺东,吴秀萍,李 瑞,陆 佳,王雯慧
(甘肃农业大学动物医学院,甘肃兰州 730070)
新生动物Fc受体(FcRn)是一种跨膜型的异质二聚体糖蛋白,由一条重链(α链)与一条可溶性的轻链(β链)β2-微球蛋白(β2m)以非共价键连接组成[1]。FcRn重链由FCGRT基因编码,由3个胞外结构域 (a1、a2和a3)、1个跨膜结构域和1个由44个氨基酸组成的细胞质尾部构成[2]。虽然FcRn与组织相容性复合体(MHC)Ⅰ在结构上高度相似,但由于其狭窄的抗原结合凹槽而不能与抗原肽结合[1,3]。FcRn结合配体IgG和白蛋白具有pH依赖性,即在低pH(pH ≤6.5)时能与它们的Fc区域结合,而在生理pH(7.3~7.4)下将其释放[4],从而保护IgG和白蛋白免受细胞内溶酶体的降解,延长它们在血液循环中的半衰期[5-6]。在缺乏FcRn的小鼠中,IgG和白蛋白的半衰期均缩短至约1 d,意味着IgG的半衰期缩短了4倍~5倍,并且白蛋白的半衰期缩短了1.5倍~2倍[3]。在动物模型中FcRn的缺乏会导致血浆中IgG浓度和对自身免疫性疾病的抵抗力均降低[7]。FcRn首次被发现在啮齿类动物中作为转运母体IgGs跨越新生儿肠黏膜的受体,其表达具有物种、年龄及组织细胞差异性。如FcRn在人类胎儿和成人肠上皮细胞中均可高度表达[8],但在啮齿类动物中,FcRn仅在新生儿的小肠近端肠上皮细胞中高度表达,断奶后其表达水平急剧下降[2],而在成年鼠中表达量不高[9]。FcRn在所有物种的肺泡巨噬细胞中均可高度表达,但在造血细胞系中,FcRn的表达仅限于髓细胞,包括巨噬细胞和树突状细胞[1]。作为一种抗体转运体,FcRn通过携带母体IgG穿过胎盘合胞体滋养层、呼吸道、肠道和生殖道的极化上皮细胞从而建立被动免疫[10]。FcRn也是提供药物、治疗和疫苗的一个目标[11]。总之,FcRn在建立早期新生儿免疫中起关键作用,并参与自然感染和疫苗接种的免疫反应。
本课题组已成功制备出双峰驼IgA、 IgM、IgE多克隆抗体,并研究了其在双峰驼腭扁桃体的分布特征[12-13];从血清中分离出双峰驼IgG抗体并研究其在小肠中的分布特征[14]。本试验首先合成双峰驼FCGRT基因序列并构建重组质粒,然后原核表达及优化表达条件,最后用纯化后的重组蛋白免疫家兔,制备兔抗双峰驼FcRn多克隆抗体,并通过间接ELISA和Western blot检测效价及特异性,为双峰驼黏膜免疫的深入研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 新西兰大白兔,雄性,体重约2.3 kg,购自中国农业科学院兰州兽医研究所实验动物中心。
1.1.2 主要试剂 载体pET-28a(+)、感受态细胞BL21(DE3),Solarbio生物科技有限公司产品; His标签蛋白纯化试剂盒(包涵体蛋白),康为世纪生物科技有限公司产品;HRP标记的山羊抗兔IgG, BOSTER生物工程有限公司产品;双峰驼FcRn重组蛋白,甘肃农业大学动物医学院病理实验室制备。
1.1.3 主要仪器 紫外分光光度仪,美国GE公司产品;超声波细胞破碎仪,浙江宁波新芝生物科技股份有限公司产品;全波长酶标仪,上海闪谱生物科技有限公司产品。
1.2 方法
1.2.1 双峰驼FCGRT基因的合成与重组质粒的构建 首先参照NCBI收录的双峰驼FcRn基因序列(GenBank accession no.XM-010946978.1),选取编码区(CDs),经DNA STAR和TMHMM Server 2.0软件进行FcRn蛋白抗原表位和跨膜结构预测,截取膜外部分;然后利用SignalP 4.1 Server软件进行FcRn蛋白信号肽预测,截除信号肽部分后,在碱基序列的上游和下游分别添加起始密码子ATG和终止密码子TAG;接着,用Primer 5进行酶切位点预测,添加酶切位点BamHⅠ和XhoⅠ;最终,将截取的FcRn进行碱基优化后送金唯智生物科技有限公司合成,并与pET-28a(+)载体连接后转化进DH5α感受态细胞,提取质粒经测序分析,将测序正确的阳性重组质粒命名为pET-28a-FcRn。
1.2.2 pET-28a-FcRn重组质粒在大肠埃希氏菌中的诱导表达及表达形式 将公司构建的pET-28a-FcRn重组质粒转入感受态细胞BL21(ED3)中,挑取单个菌落于灭菌的LB液体培养基中(Kan+),37℃培养至OD 600 nm值达到0.60.8时,用1.0 mmol/L的IPTG诱导6 h后收集菌体,置于-80℃反复冻融3次,超声破碎至液体清亮为止(约40 min),分别收集上清和沉淀。最终,将所有的样品进行SDS-PAGE检测。
1.2.3 双峰驼FcRn重组蛋白表达条件优化与纯化 为了提高FcRn重组蛋白的表达量,分别采用不同IPTG 浓度(0.1、0.3、0.5、0.7、0.9、1.0 mmol/L)和不同诱导时间(1、2、3、4、5、6、7、8、9、10 h)进行优化表达,然后进行SDS-PAGE检测。在最优条件下,大批量表达FcRn重组蛋白,超声破碎菌体,依据His标签蛋白纯化试剂盒(包涵体蛋白)中的操作步骤纯化目的蛋白,用SDS-PAGE检测,紫外分光光度仪测定蛋白含量。
1.2.4 双峰驼FcRn多克隆抗体的制备 将家兔适应性饲喂1周后,从耳缘静脉采集血液并收集血清。将纯化后的重组蛋白与等量的弗氏完全佐剂混匀,充分乳化后,按照800 μg/只的剂量采用背部皮下多点注射方式免疫家兔。1周后将纯化后重组蛋白与等量的弗氏不完全佐剂充分乳化,以400 μg/只的剂量在肩胛部及腘淋巴结多点注射。之后每间隔1周加强免疫1次(方法和剂量同第2次)。待第4次免疫6 d后,心脏采集血液,获得兔抗双峰驼FcRn的多抗血清。
1.2.5 双峰驼FcRn多克隆抗体血清效价的检测 将纯化的FcRn重组蛋白作为抗原,以5 μg/孔的量4℃过夜包被酶标板,经洗涤、封闭、洗涤后,加入按1∶2 000~1∶128 000梯度稀释的血清,37℃孵育1 h,洗涤后加入HRP标记的山羊抗兔IgG(1∶8 000稀释),37℃孵育1 h,再次洗涤后在避光条件下加入TMB底物显色液,显色15 min后加入2 mol/L的H2SO4终止反应(50 μL/孔),最后,用酶标仪测定450 nm处的吸光值(OD)。以OD待测/ OD阴性≥2.1的最高稀释倍数作为该多抗血清的效价。
1.2.6 双峰驼FcRn多克隆抗体的Western blot分析 将纯化后的FcRn重组蛋白经常规120 g/L SDS-PAGE电泳后,转移至PVDF膜上,然后放至含50 g/L脱脂奶粉的TBS-T 中,37℃封闭2 h后,分别用免疫前兔血清和兔抗血清为一抗(1∶500稀释),4℃孵育过夜;经TBS-T洗涤3次,用HRP标记的山羊抗兔IgG(1∶8 000稀释)室温孵育2 h,再经TBS-T洗涤3次后,滴加ECL发光液进行显色。
2 结果
2.1 双峰驼FCGRT基因合成与重组质粒构建的结果
通过对双峰驼FcRn蛋白亲水性(图1A)和抗原表位(图1B)的预测分析,表明该蛋白为抗原指数较高的疏水性蛋白;跨膜结构预测FcRn蛋白总共有355个氨基酸,其中氨基酸1-299为膜外区(图2),利用Editseq (DNASTAR 7.0)截取膜外部分;信号肽预测该蛋白氨基酸1-24为信号肽部分(图3),截除信号肽,剩余275个氨基酸,然后在上游和下游分别添加起始密码子ATG和终止密码子TAG,最终预测该FcRn重组蛋白大小为34 ku。
2.2 pET-28a-FcRn重组质粒在大肠埃希氏菌中诱导表达及表达形式
将重组菌37℃培养至OD 600 nm值为0.8时,用IPTG(1.0 mmol/L)诱导6 h后收集菌体,超声破碎后分别收集上清和沉淀,经SDS-PAGE检测重组菌诱导后产物与重组菌诱导前产物相比出现了明显的表达条带(图4);超声破碎离心后,目的条带只出现在重组菌诱导产物的沉淀中,说明重组蛋白FcRn在BL21中成功表达,且以包涵体的形式存在,其大小约为34 ku,与预期相符。
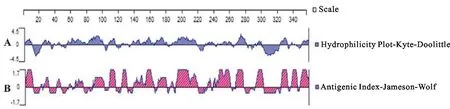
图1双峰驼FcRn蛋白亲水性与抗原表位的预测
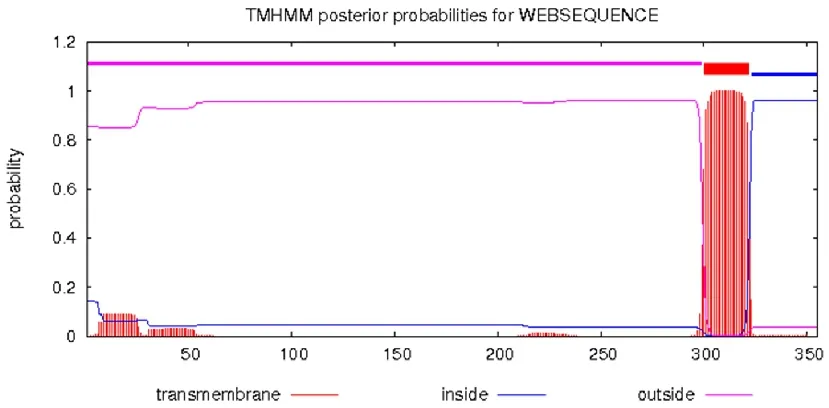
图2双峰驼FcRn蛋白跨膜区的预测

图3双峰驼FcRn蛋白信号肽的预测
2.3 双峰驼FcRn重组蛋白表达条件优化和纯化结果
对重组菌以不同浓度的IPTG进行诱导表达,SDS-PAGE检测在此IPTG浓度梯度范围内(0.1 mmol/L~1.0 mmol/L),IPTG的诱导作用不是很明显,但相比而言,在IPTG浓度为0.3 mmol/L时,蛋白表达量最多(图5),故FcRn重组蛋白表达的最佳IPTG诱导浓度为0.3 mmol/L。
对重组菌以不同的时间进行诱导表达(1 h~10 h),SDS-PAGE检测在添加0.3 mmol/L IPTG诱导1 h时,就有目的蛋白表达,随着时间的推移,表达量逐渐增加,6 h时目的蛋白的表达量达到了最高(图6),故FcRn重组蛋白表达的最佳诱导时间为6 h。

M.蛋白分子质量标准; 1.重组菌诱导前产物;2~3.重组菌诱导后产物; 4.重组菌诱导产物的上清;5.重组菌诱导产物的沉淀;6.纯化后的重组蛋白

M.蛋白分子质量标准;1.重组菌诱导前产物; 2~7.0.1、0.3、0.5、0.7、0.9、1.0 mmol/L的IPTG浓度诱导的重组菌产物
2.4 双峰驼FcRn重组蛋白的纯化结果
以最佳表达条件大批量表达FcRn重组蛋白,纯化时收集洗脱液,经紫外分光光度仪测定其最高蛋白含量为2.544 mg/mL,SDS-PAGE检测纯化后的重组蛋白纯度高,无杂蛋白,大小为34 ku(图7)。
2.5 双峰驼FcRn多克隆抗体血清效价的ELISA检测结果
用间接ELISA测定抗体效价,将抗血清与免疫前阴性血清分别以1∶32 000和1∶2 000稀释时,OD 450 nm(阳性)/OD 450 nm(阴性)>2.1,说明该抗体血清效价为1∶32 000。
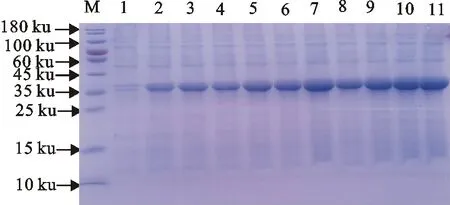
M.蛋白分子质量标准; 1.重组菌诱导前产物; 2~11.重组菌被诱导1、2、3、4、5、6、7、8、9、10 h的产物

M.蛋白分子质量标准; 1~4.纯化后的重组蛋白
2.6 双峰驼FcRn多克隆抗体的Western blot鉴定结果
Western blot鉴定在膜上约34 ku处有明显的蛋白印迹出现(图8),说明该兔抗双峰驼FcRn抗体能与重组蛋白特异性结合,即具有反应原性。

1.免疫前兔血清; 2.兔抗血清
3 讨论
双峰驼作为中国西北及华北荒漠、半荒漠地区特有的经济畜种之一,常年生活于干旱多沙和气温起伏很大的沙漠环境中,其怀孕周期(13个月)和产羔间隔(至少2年以上)长,母驼初配年龄在4岁~5岁,产羔时间主要于每年的1月~3月,这对于血液,特别是初乳的采集来说困难极大。2012年由内蒙古大学完成双峰驼全基因组序列图谱绘制和破译工作并在《Nature》系列科学杂志发表在线封面文章,随后由GenBank将双峰驼全基因组数据(Ref Seq GCF-000767855.1)向全球公开释放。而原核表达系具有目的基因表达水平高,培养周期短[15],操作简单,抗污染能力强,成本相对较低,遗传学、生理学特性明确等特点,所以用原核表达系统来制备抗体无疑是最佳的选择。
新生动物Fc受体其本质为跨膜蛋白,抗原表位主要集中于膜外部分,为了降低基因合成的成本,故截取膜外部分。另外,本实验室中未去掉信号肽的重组蛋白始终无法表达,而在同等条件下,去掉信号肽的重组蛋白却成功表达。根据“信号肽假说”,蛋白质分子中的信号肽是由15个~30个氨基酸残基组成,能引导新合成肽链转移到内质网上的一段疏水性多肽。但在原核表达的过程中,信号肽序列中的密码子对大肠埃希氏菌来说可能是稀有密码子,而大肠埃希氏菌中没有或具有很少量能识别这些密码子的tRNA。国内早有报道,在相同条件下,切除信号肽后能提高重组蛋白的表达量。
对双峰驼FcRn重组蛋白表达条件的优化过程中发现,IPTG诱导浓度对目的蛋白表达量的影响不显著,而诱导时间的影响极为显著,这与文献[16]的研究结果相一致。
本研究通过基因合成、原核表达等方法获得与预期大小相符的双峰驼FcRn重组蛋白,确定其最佳IPTG诱导浓度为0.3 mmol/L,最佳诱导时间为6 h。间接ELISA检测其效价为1∶32 000,Western blot鉴定该抗体能与重组蛋白发生特异性结合,上述结果证明已成功制备了高效价和特异性良好的兔抗双峰驼FcRn多克隆抗体,为进一步研究FcRn抗体在双峰驼黏膜表面的分布奠定了基础。
