Mettl9基因过表达促进氧糖剥夺大鼠离体星形胶质细胞损伤*
2021-04-06罗奇志邬力祥黄柏胜
罗奇志, 韩 仰, 李 威, 张 帆, 邬力祥, 黄柏胜△
(中南大学基础医学院 1免疫学系,2生理学系,湖南长沙410008)
脑缺血可导致神经功能障碍和神经退行性疾病甚至死亡,其可通过自由基释放、线粒体反应、神经兴奋毒性、蛋白质错误折叠和炎症反应等多种机制诱导神经损伤[1]。星形胶质细胞是中枢神经系统中数量最多的神经胶质细胞,是神经元功能活动的重要伙伴,与谷氨酸摄取、水和电解质稳态、维持血脑屏障、调节脑血流、分泌神经营养和神经保护因子及调节神经可塑性密切相关[2-4]。研究显示,脑缺血后星形胶质细胞活性降低、功能受损,从而影响神经元的功能活动及生存转归[4-5]。因此,如何减轻脑缺血对星形胶质细胞的损伤对保护神经元具有重要意义。甲基转移酶样蛋白9(methyltransferase-like protein 9,Mettl9)基因定位于大鼠染色体1q36,该基因编码一种类甲基化转移酶,属于DREVI转甲基酶基因家族[6],它在人和小鼠的同源基因为METTL9/PAP1基因,有关该基因的研究鲜见报道。研究报道,METTL9/PAP1基因在肺癌和小鼠胎肺的发育过程中呈特异性表达,且其表达信号的强弱与凋亡细胞的强弱成正相关[7-8],其在胚胎发育过程中的作用很可能是通过参与细胞凋亡来实现的[7]。但Mettl9基因在星形胶质细胞中的作用尚未阐明。本研究建立Mettl9基因过表达的原代培养SD大鼠离体星形胶质细胞模型,通过氧糖剥夺(oxygen-glucose deprivation,OGD)模拟体内脑缺血损伤过程,探讨Mettl9基因过表达对OGD 诱导的大鼠离体星形胶质细胞损伤的影响及作用机制。
材料和方法
1 材料
高糖及无糖DMEM 培养液购自HyClone;胎牛血清及胰蛋白酶购自Gibco;多聚-D-赖氨酸、MTT 及DMSO 购自Sigma;RNA 抽提试剂Trizol 购自Invitrogen;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒购自南京建成生物工程研究所;RT-qPCR 试剂购自TaKaRa;兔抗鼠Mettl9 Ⅰ抗购自Abcam;抗Bcl-2抗体、抗Bax 抗体及抗GAPDH 抗体购自Cell Signaling Technology;辣根过氧化物酶标记的山羊抗兔IgGⅡ抗购自北京博奥森生物技术有限公司;标准级N2和CO2购自长沙曙光电子厂气体分公司;慢病毒重组载体pLenti6.3-Mettl9为本实验室前期构建。
2 方法
2.1 星形胶质细胞的原代培养 原代SD 大鼠大脑皮层星形胶质细胞按照本实验室前期建立的方法进行体外培养[9]。大致步骤如下,取新生48 h 内的SD大鼠,无菌条件下分离大鼠双侧大脑皮层,以DHank"s 液冲洗3 次,再用吸管反复吹打制成细胞悬液,经直径200 μm 的不锈钢网过滤后转移入离心管中,以230 ×g离心5 min。弃上清,加入适量DMEM培养液重悬细胞,最后以终浓度为10%胎牛血清的DMEM 调整细胞密度为1.0×109/L 接种于预先用多聚-D-赖氨酸包被过的培养瓶内。每2~3 d 换液1次,待细胞生长融合成单层细胞后用0.25%胰酶消化传代,选择生长状态良好的第4 次传代细胞用于实验。
2.2 慢病毒重组载体转染 在培养的星形胶质细胞融合度为80%~90%时,更换新的培养基,分别将病毒滳度为1×109TU/L 的慢病毒重组载体pLenti6.3-Mettl9 和相应空载体转染至星形胶质细胞,建立正常对照(control,Con)组、空载体转染(negative control,NC)组及慢病毒重组载体pLenti6.3-Mettl9转染(Mettl9)组。各组细胞在转染6 h 后更换含有10%胎牛血清的DMEM 培养液,继续培养48 h 后收集细胞,分别采用RT-qPCR 及Western blot 检测转染效率。
2.3 OGD 损伤模型的建立 将缺氧密闭室置于培养箱内,N2和CO2通过流量控制阀按照95∶5 比例进入气体混合器,混合气体以(1.8~2)L/min 的流量进入缺氧密闭室。细胞缺氧前将培养液换成预先通以混合气体30 min 的无糖DMEM 培养液,立即置于37℃的缺氧密闭室内,继续通以混合气体30 min 后立即封闭,即为缺氧培养模型,并开始计算OGD 处理时间,根据本研究前期工作以缺氧8 h 为OGD 处理时间。本研究将星形胶质细胞分为6 组,除上述3组外,另外设正常对照+OGD 处理(Con+OGD)组,慢病毒空载体转染+OGD 处理(NC+OGD)组和慢病毒重组载体pLenti6.3-Mettl9 转染+OGD 处理(Mettl9+OGD)组。
2.4 LDH 漏出率的测定 收集各组细胞上清液至1.5 mL EP 管中,同时用PBS 洗涤细胞,然后加入等体积的0.5%TritonX-100,15 min 后收集细胞裂解液至另一1.5 mL EP 管中,4℃、900 ×g离心5 min。然后取EP 管中上清,按照LDH 试剂盒说明书操作步骤,用自动生化分析仪分别测定细胞上清液和细胞内的LDH 活性。LDH 漏出率(%)=上清液LDH 活性/(上清液LDH活性+细胞内LDH活性)×100%。
2.5 MTT 法检测细胞活力 在OGD 8 h 后,各组细胞分别加入5 g/L 的MTT 20 μL(终浓度为0.5 g/L),于37 ℃孵育4 h,弃上清,每孔加入200 μL DMSO,室温震荡20 min,置酶标仪于波长570 nm 处测定吸光度(A)值。每组设3 个复孔,以正常组细胞活力为100%,实验组细胞活力按以下公式计算:实验组细胞活力(%)=实验组A值/对照组A值×100%。
2.6 RT-qPCR 在OGD 8 h后,按照Trizol试剂说明书操作提取各组细胞总RNA,取4 μL RNA 模板做逆转录反应。RT-qPCR反应各引物序列如下:Mett19的上游引物序列为5’-TCTGCTGGATCGCTGTGATC-3’下游引物序列为5’-AGGGATGAAAGGGCAAAACC-3’,产物长度为110 bp;Bcl-2的上游引物序列为5’-GGCATCTGCACACCTGGAT-3’,下游引物序列为5’-ATCAAACAGAGGTCGCATGCT-3’,产物长度为86 bp;Bax的上游引物序列为5’-CCCACCAGCTCTGAACAGTTC-3’,下游引物序列为5’-TCTCCCCAGCCATCCTCTCT-3’,产物长度的88 bp;GAPDH 的上游引物序列为5’-AGGGCTGCCTTCTCTTGTGA-3’,下游引物序列为5’-AACTTGCCGTGGGTAGAGTCA-3’,产物长度为110 bp。反应总体系50 μL 包括:5×SYBR Green I PCR Buffer 10 μL,上、下游引物各1 μL,DNA 模板5 μL,ddH2O 33 μL。反应条件:95 ℃3 min;然后95 ℃30 s,60 ℃30 s,72 ℃30 s,共40 个循环。
2.7 Western blot 在OGD 8 h 后,用0.25%的胰酶消化收集各组细胞,230×g离心后弃上清;再分别用1 mL PBS重悬细胞,230×g离心弃上清,细胞沉淀用于提取蛋白。取一定量总蛋白样品进行SDS-PAGE,转移到PVDF 膜上,用含3%牛血清白蛋白的TBST(含0.05%Tween-20 的TBS)室温封闭1 h,分别用稀释的兔抗Mettl9,Bcl-2,Bax 和内参照GAPDH Ⅰ抗4 ℃孵育过夜。TBST漂洗3次,加入辣根过氧化物酶标记的羊抗兔IgG,室温孵育1 h。TBST 漂洗3 次,用ECL化学发光法检测各蛋白的表达。
3 统计学处理
用SPSS 17.0 软件分析实验数据,结果以均数±标准差(mean±SD)表示,多组间数据比较采用单因素方差分析(one-way ANOVA)。RT-qPCR 数值分析采用2-ΔΔCt分析法计算mRNA 表达的相对比值,以P<0.05为差异有统计学意义。
结果
1 慢病毒重组载体pLenti6.3-Mettl9转染星形胶质细胞的效率
1.1 RT-qPCR检测转染效率 RT-qPCR结果表明,与Con 组比较,NC 组Mettl9的mRNA 表达无显著差异,而Mettl9 组Mettl9的mRNA 表达显著增高(P<0.05),见图1,结果显示获得了Mettl9 过表达的星形胶质细胞。
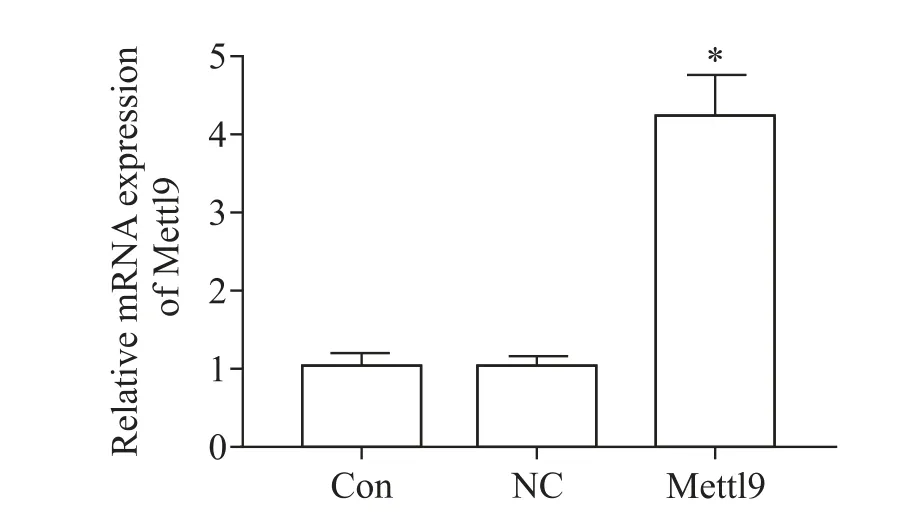
Figure 1. The transduction efficiency of lentiviral vector pLenti6.3-Mettl9 in astrocytes was verified by RT-qPCR assay. Mean±SD.n=3. *P<0.05 vs Con group.图1 RT-qPCR 检测慢病毒重组载体pLenti6.3-Mettl9转染星形胶质细胞的效率
1.2 Western blot 检测转染效率 Western blot 结果表明,与Con 组比较,NC 组Mettl9 的蛋白表达无显著差异,而Mettl9 组Mettl9 的蛋白表达显著增高,见图2,从蛋白水平进一步证明获得了Mettl9 过表达的星形胶质细胞。

Figure 2. The transduction efficiency of lentiviral vector pLenti6.3-Mettl9 in astrocytes was verified by Western blot assay.图2 Western blot 检测慢病毒重组载体pLenti6.3-Mettl9转染星形胶质细胞的效率
2 Mettl9 过表达对星形胶质细胞LDH 漏出率的影响
与Con 组比较,NC 组细胞LDH 漏出率无显著差异,而Mettl9 组星形胶质细胞的LDH 漏出率显著增高(P<0.05);与Con+OGD 组比较,NC+OGD 组细胞LDH 漏出率亦无显著差异,而Mettl9+OGD 组星形胶质 细 胞 的LDH 漏 出 率 进 一 步 增 高(P<0.05),见图3。

Figure 3. Effect of over-expression of Mettl9 gene on LDH leakage rate of astrocytes. Mean±SD. n=3. *P<0.05 vs Con group;#P<0.05 vs Con+OGD group.图3 Mettl9过表达对星形胶质细胞LDH漏出率的影响
3 Mettl9过表达对星形胶质细胞活力的影响
与Con 组比较,NC 组星形胶质细胞活力无显著差异,而Mettl9 组星形胶质细胞的活力显著降低(P<0.05);与Con+OGD 组比较,NC+OGD 组星形胶质细胞活力无显著差异,而Mettl9+OGD 组星形胶质细胞的活力进一步显著降(P<0.05),见图4。

Figure 4. Effect of over-expression of Mettl9 gene on the viability of astrocytes. Mean±SD. n=3.*P<0.05 vs Con group;#P<0.05 vs Con+OGD group.图4 Mettl9过表达对星形胶质细胞活力的影响
4 Mettl9 过表达对星形胶质细胞Bcl-2 和Bax mRNA表达的影响
RT-qPCR 结果显示,与Con 组比较,NC 组Bcl-2和Bax 的表达均无差异,而Mettl9 过表达组Bcl-2 的表达降低(P<0.05),Bax 的表达增高(P<0.05);对Mettl9 过表达的星形胶质细胞经OGD 处理8 h 后,与Con+OGD 组比较,NC+OGD 组Bcl-2 和Bax 的表达均无显著差异,而Mettl9+OGD 组Bcl-2 的表达显著降低(P<0.05),Bax 的 表 达 显 著 增 高(P<0.05),见图5。
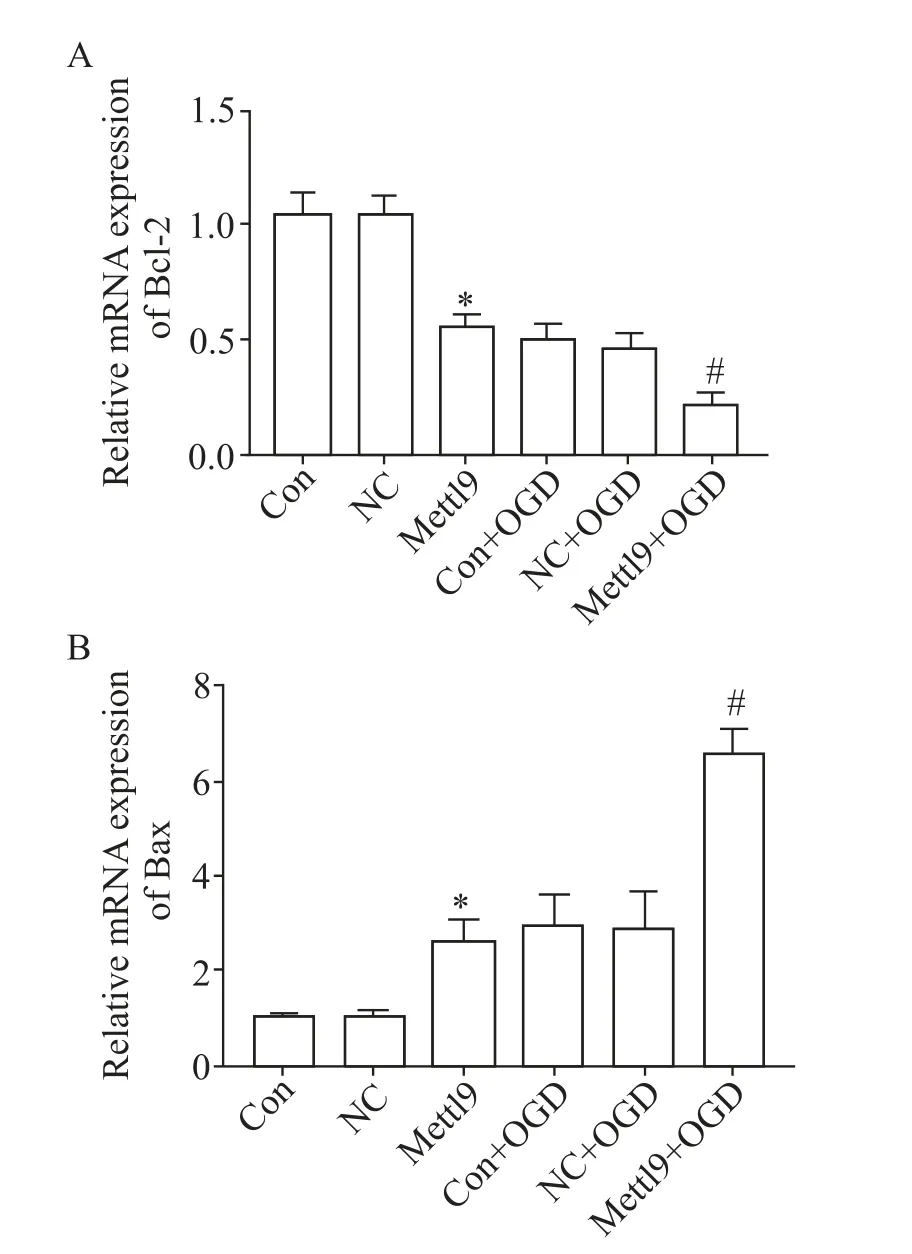
Figure 5. Effect of Mettl9 gene over-expression on Bcl-2 and Bax mRNA expression of astrocytes. A:relative mRNA expression of Bcl-2;B:relative mRNA expression of Bax. Mean±SD. n=3. *P<0.05 vs Con group;#P<0.05 vs Con+OGD group.图5 Mettl9 过表达对星形胶质细胞Bcl-2 及Bax mRNA 表达的影响
5 Mettl9 过表达对星形胶质细胞Bcl-2 和Bax 蛋白表达的影响
Western blot结果显示,与Con组比较,NC组Bcl-2和Bax蛋白表达均无显著差异,而Mettl9过表达组,Bcl-2蛋白表达降低,Bax蛋白的表达增高(P<0.05);在Mettl9过表达的星形胶质细胞经OGD 处理8 h后,与Con+OGD 组比较,NC+OGD 组Bcl-2 和Bax 蛋白表达均无显著差异,而Mettl9+OGD 组Bcl-2 蛋白的表达显著下降、Bax 蛋白的表达显著增高(P<0.05),图6。
讨论
缺血性脑卒中为临床常见的急重症,脑缺血可影响各种脑功能区,涉及复杂的损伤反应,脑缺血损伤时,星形胶质细胞的存活影响神经元的存活和突触重塑,因此,研究脑缺血损伤时如何有效干预星形胶质细胞的存活,对神经元的生存和转归具有重要意义。星形胶质细胞是重要的神经细胞,对缺血耐受性较强,该细胞与突触信号传递、能量代谢、氧化还原稳态平衡、炎症反应及维持脑结构功能等多种功能有关。星形胶质细胞终足与周围毛细血管壁连接,参与血脑屏障维持,在脑缺血损伤中发挥重要作用[10-11]。脑缺血产生的损伤在本质上主要是脑组织氧、糖缺乏而引发的一系列结果。OGD 损伤诱导星形胶质细胞、小胶质细胞和神经元等细胞发生凋亡[12],其机制可能与细胞自噬[5,13]、钙超载、一氧化氮、线粒体功能障碍、转录信号的激活[14]及微小RNA(microRNA,miRNA)对靶基因的调控[15]等多种因素有关。

Figure 6. Effect of Mettl9 gene over-expression on the protein expression of Bcl-2 and Bax of astrocytes. Mean±SD.n=3. *P<0.05 vs Con group;#P<0.05 vs Con+OGD group.图6 Mettl9过表达对星形胶质细胞Bcl-2和Bax蛋白表达的影响
Mettl9基因在人和小鼠的同源基因为METTL9/PAP1,其在肺癌和小鼠胎肺发育过程中表达信号的强弱与凋亡细胞的强弱呈正相关,且在胚胎发育过程中的作用很可能是通过参与细胞凋亡来实现的[7]。METTL9基因编码一种类甲基化转移酶,属于DREVI转甲基酶基因家族,它作为p53的一个下游基因,与野生型P53蛋白结合,使DNA 上的多个基因位点发生高甲基化,从而导致肿瘤抑制因子等基因失活。由于DNA的S-腺苷甲硫氨酸的甲基转移到胞嘧啶上,形成5-甲基胞嘧啶,最终导致DNA 甲基化,引起肿瘤的发生[16]。本研究通过慢病毒重组载体pLenti6.3-Mettl9 转染原代培养的SD 大鼠离体星形胶质细胞并进行OGD 处理,观察星形胶质细胞活力及损伤情况。RT-qPCR 及Western blot 结果显示,与对照组比较,Mettl9慢病毒重组载体转导组Mettl9 的mRNA 及蛋白表达均显著增高,结果表明获得了Mettl9 过表达的星形胶质细胞。LDH 漏出率结果观察到过表达Mettl9 组较Con 组的LDH 漏出率增高,而Mettl9+OGD 组较Mettl9 组LDH 漏出率进一步增高,结果表明细胞内的LDH 在外界刺激下分泌到细胞外,导致LDH 漏出率增加,此时细胞损伤加剧。MTT 结果观察到Mettl9 过表达组细胞活力下降,而Mettl9+OGD 组较Mettl9 组细胞活力进一步降低,结果表明转染Mettl9 促进细胞损伤、活力下降,而OGD加剧细胞损伤。本研究表明,过表达Mettl9 增加了星形胶质细胞的损伤,而OGD 进一步加剧了过表达Mettl9星形胶质细胞的损伤,推测Mettl9参与了OGD诱导的星形胶质细胞凋亡。随着星形胶质细胞在OGD 损伤环境中的时间延长,其产生损害和活力降低逐渐明显,除无氧代谢能量的生成效率降低,糖耗增加外[17],较长时间的无氧代谢过程中产生的乳酸使细胞环境pH 下降,已有研究证实酸中毒能加重缺氧、缺糖造成的细胞损伤[18]。
Bcl-2/Bax 是启动细胞凋亡的分子开关[19],细胞凋亡的发生发展与Bcl-2 和Bax 的表达水平密切相关,其中Bcl-2 在细胞凋亡过程中发挥抗凋亡作用,其表达量的增加抑制细胞凋亡,而Bax 在细胞凋亡过程中发挥促凋亡作用,其表达量的增加促进细胞凋亡[20-23]。基因表达水平的异常可引起Bcl-2 及Bax表达的改变,本研究在分子水平探讨了Mettl9基因过表达对星形胶质细胞损伤的机制,RT-qPCR 及Western blot 结果显示,与Con 组比较,Mettl9 过表达组Bcl-2 的mRNA 及蛋白表达均降低,Bax 的mRNA及蛋白表达均增高;与Con+OGD 比较,Mettl9+OGD组Bcl-2 的mRNA 及蛋白表达进一步降低,Bax 的mRNA 及蛋白表达进一步增高。从该研究结果可推测Mettl9 参与星形胶质细胞的凋亡,Mettl9 过表达促进OGD 大鼠离体星形胶质细胞的损伤,其机制可能是通过调控Bcl-2/Bax信号通路的蛋白表达影响细胞活力和凋亡等方式实现的。
本研究采用原代培养的大鼠离体星形胶质细胞,通过OGD模拟体内脑缺血损伤过程,探讨了Met-tl9基因过表达对OGD 大鼠离体星形胶质细胞损伤的影响及其可能的作用机制,但尚需从整体动物实验进一步研究。
